甜牛大力和苦牛大力对免疫抑制小鼠免疫调节作用的比较研究
2016-06-06黄慧学邓日健刘华钢梁秋云
谢 婵,黄慧学,邓日健,刘华钢,梁秋云
(1.广西医科大学药学院,广西南宁 530021;2.广西中医药大学药学院,广西南宁 530200;3.广西南宁市嘉元中药材专业合作社,广西南宁 530041)
◇中医药研究◇
甜牛大力和苦牛大力对免疫抑制小鼠免疫调节作用的比较研究
谢婵1,黄慧学2,邓日健3,刘华钢1,梁秋云1
(1.广西医科大学药学院,广西南宁530021;2.广西中医药大学药学院,广西南宁530200;3.广西南宁市嘉元中药材专业合作社,广西南宁530041)
摘要:目的比较甜牛大力和苦牛大力对免疫抑制小鼠的免疫调节作用。方法昆明种(KM)小鼠随机分为正常对照组、环磷酰胺(CTX)组(模型组)、左旋咪唑(LMS)组(阳性对照组)与高、中、低剂量(20、10、5 g/kg)的甜牛大力(Radix Millettia Speciosa, RM Speciosa)组及苦牛大力(Radix Millettia Championi, RM Championi)组,连续灌胃给药20 d,1次/d。并于第8、10、12天,除正常对照组外,均腹腔注射(ip)CTX 80 mg/kg造成小鼠免疫抑制模型。测定并比较各组小鼠体质量增量、免疫器官指数、白细胞(WBC)数目、迟发型超敏反应(DTH)程度及巨噬细胞吞噬功能的差异。结果与模型组比较,一定剂量的甜牛大力和苦牛大力均可明显提高模型小鼠的WBC(P<0.01或P<0.05)数目;促进模型小鼠的DTH程度(P<0.01);增加模型小鼠的单核巨噬细胞的吞噬功能(P<0.01或P<0.05);不同程度提高模型小鼠的体质量、脾脏指数及胸腺指数(P<0.01或P<0.05)。其中,甜牛大力高、中剂量组(20、10 g/kg)在提高胸腺指数和DTH程度方面,稍优于苦牛大力对应剂量组(P<0.05或P<0.01),而在其余指标上,甜牛大力与苦牛大力的作用差异无统计学意义(P>0.05)。结论甜牛大力和苦牛大力对CTX免疫抑制小鼠均具有一定的免疫功能增强作用,其中甜牛大力提高细胞免疫能力稍强于苦牛大力。
关键词:甜牛大力;苦牛大力;免疫调节功能;环磷酰胺;免疫抑制
牛大力(RadixMillettiaSpeciosa, RM Speciosa)为豆科美丽崖豆藤(MillettiaSpeciosaChamp)的干燥根,又称为牛牯大力、山莲藕、大力薯等,其性平、味甘,归肺、肾经,具有补虚润肺、强筋活络等功效,常用于治疗肾虚、气虚、腰膝酸痛、风湿痹痛、慢性肝炎等病症[1]。因其根味甜,故习称甜牛大力[2]。商品中的苦味牛大力(RadixMillettiaChampioni, RM Championi),又叫大力牛,是豆科绿花崖豆藤(M.championiBenth)的干燥根,根味苦,习称苦牛大力[3]。研究发现,甜牛大力含有维生素E、不饱和脂肪酸、生物碱、香豆素类、多糖类、三萜类及植物甾醇等多种活性成分[4-5],具有调节免疫作用[6]。而对于苦牛大力的免疫功效,未见国内外文献报道,但民间却常将两者混用。本实验通过用环磷酰胺(CTX)造成小鼠免疫抑制模型,研究甜牛大力和苦牛大力对小鼠免疫功能的影响,观察两者在免疫调节方面的差异,旨在为牛大力的开发应用提供可靠的实验依据。
1材料与方法
1.1实验动物健康昆明(KM)小鼠,体质量(20±2)g,雌雄各半,SPF级,广西医科大学实验动物中心提供,合格证号:SCXK(桂)2014-0002。
1.2药物、试剂及仪器牛大力(广西南宁市嘉元中药材专业合作社提供,经广西中医药研究所赖茂祥研究员鉴定为豆科崖豆藤属植物美丽崖豆藤(MillettiaspeciosaChamp)和绿花崖豆藤(M.championiBenth)的干燥根;印度墨汁(北京博奥拓达科技有限公司,批号20130718);盐酸左旋咪唑片(Levamisole, LMS,桂林南药股份有限公司,批号21005);注射用CTX(江苏恒瑞医药股份有限公司,批号04131209)。鸡红细胞(CRBC)取新鲜鸡血,按常规方法制备CRBC悬液[7]。SpectraMax Plus 384酶标仪(Molecular Devices公司);倒置显微镜(Olympus公司)。
1.3实验药物的制备取干燥苦、甜牛大力生药饮片适量,粉碎至40目,以750 mL/L乙醇为提取溶剂,按料液比1∶8于85 ℃水浴中浸提3次,过滤,合并滤液,浓缩成含生药量为2 g/mL的药液,备用。
1.4实验分组及处理KM小鼠随机分成9组,每组10只,各组小鼠按实验设计每天灌胃1次,连续20 d,即正常对照组(生理盐水10 mL/kg)、CTX组(生理盐水10 mL/kg)、LMS组(阳性对照组,30 mg/kg)及苦牛大力高、中、低剂量组(20、10、5 g/kg)和甜牛大力高、中、低剂量组(20、10、5 g/kg)。同时,再分别于实验第8、10、12天,正常对照组腹腔注射(ip)生理盐水10 mL/kg,其余各组ip等体积CTX 80 mg/kg,建立小鼠免疫低下模型。
1.5白细胞计数各组KM小鼠末次给药30 min,经内眦静脉丛取血20 μL,立即加入380 μL白细胞稀释液中,混匀。待红细胞完全破坏、液体变成棕褐色后,滴入血球计数板于低倍镜下计数白细胞总数(个/L)。白细胞数/(个/L)=N/4×10×20×106;其中:N为4个大方格内白细胞总数。
1.6采用足跖增厚法观察迟发型变态反应(DTH)于实验第16天,10% CRBC悬液0.2 mL腹腔注射各小鼠进行致敏。致敏后第4天,右后足跖部皮下注射20 μL 10% CRBC,24 h后,用游标卡尺分别测量双侧足跖厚度,测量3次取均值,以左右足跖厚度的差值来表示DTH的程度。足跖肿胀度(mm)=右侧足跖厚度-左侧足跖厚度。
1.7单核巨噬细胞功能[8]及免疫器官指数的测定末次给药30 min,于小鼠内眦静脉丛注射稀释5倍印度墨汁0.1 mL/10g,分别于注射后2 min(t1)和10 min(t2)从小鼠内眦静脉丛取血20 μL,立即置于含有2 mL 1 g/L Na2CO3溶液的试管中,摇匀,于酶标仪650 nm处测定吸光度值(A1、A2);分别脱颈椎处死并解剖各组小鼠,取肝脏和脾脏,滤纸吸干脏器表面血污,称重,计算廓清指数K和吞噬指数α,并计算脾脏指数和胸腺指数。廓清指数(k)=(lgA1-lgA2)/(t2-t1);吞噬指数(α)=体质量/(肝质量+脾质量)×K1/3。脏器指数(mg/g)=脏器质量/小鼠体质量。
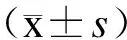
2结果
2.1各组小鼠WBC及DTH的变化与正常对照组比较,CTX组小鼠WBC数显著下降(P<0.01),DTH程度显著降低(P<0.01),表明小鼠免疫低下模型造模成功;与CTX组比较,苦牛大力、甜牛大力高剂量和中剂量组均能提高免疫抑制小鼠的WBC总数(P<0.01或P<0.05),苦牛大力、甜牛大力低剂量组的作用均不明显;苦牛大力、甜牛大力各剂量组均能增加免疫抑制小鼠的DTH程度(P<0.01),其中甜牛大力高、中剂量组致敏作用较苦牛大力相应剂量组明显,两者之间差异有统计学意义(P<0.01或P<0.05,表1)。提示苦、甜牛大力均具有一定增强细胞免疫的作用。
表1苦牛大力及甜牛大力对小鼠WBC及DTH的影响
Tab.1Effects of RM Championi and RM Speciosa on WBC and DTH of the mice
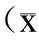
±s, n=10)
与正常对照组比较,*P<0.05,**P<0.01;与CTX组比较,#P<0.05,##P<0.01;与相应剂量的苦牛大力组比较,△P<0.05,△△P<0.01。
2.2苦牛大力及甜牛大力对小鼠单核-巨噬细胞免疫功能的影响与正常对照组比较,CTX组吞噬率、吞噬指数显著降低(P<0.01);苦牛大力、甜牛大力各剂量组小鼠吞噬率有明显提高(P<0.01或P<0.05),但仍低于正常对照组,苦牛大力、甜牛大力对应剂量组之间差异无统计学意义(P>0.05);与CTX组比较,甜牛大力可显著增加巨噬细胞的吞噬指数(P<0.01),并呈现一定的剂量依赖性(表2)。这提示苦牛大力、甜牛大力对单核-巨噬细胞吞噬功能的调节作用可能不同,但两者均对CTX免疫抑制小鼠单核-巨噬细胞系统的吞噬功能有一定的激活作用。
2.3苦牛大力及甜牛大力对小鼠免疫器官的影响与CTX组比较,苦牛大力、甜牛大力组均能不同程度拮抗CTX造成的胸腺萎缩(P<0.01或P<0.05),提高脾脏指数(P<0.01或P<0.05);甜牛大力高、中剂量组对胸腺的保护作用稍强,与苦牛大力对应剂量组比较,差异有统计学意义(P<0.01或P<0.05);与正常对照组比较,CTX组小鼠体毛干枯,精神倦怠乏力,进食和饮水减少,生存质量下降;经苦牛大力、甜牛大力治疗后的各组小鼠,进食和饮水增多,体毛较有光泽,活动度增加,身体状况均有不同程度的改善;同时小鼠体质量增加,但与CTX组比较,差异无统计学意义(P>0.05,表3)。
表2苦牛大力及甜牛大力对小鼠单核-巨噬细胞免疫功能的影响
Tab.2Effects of RM Championi and RM Speciosa on the phagocytic function of mononuclear macrophages of the mice
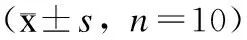
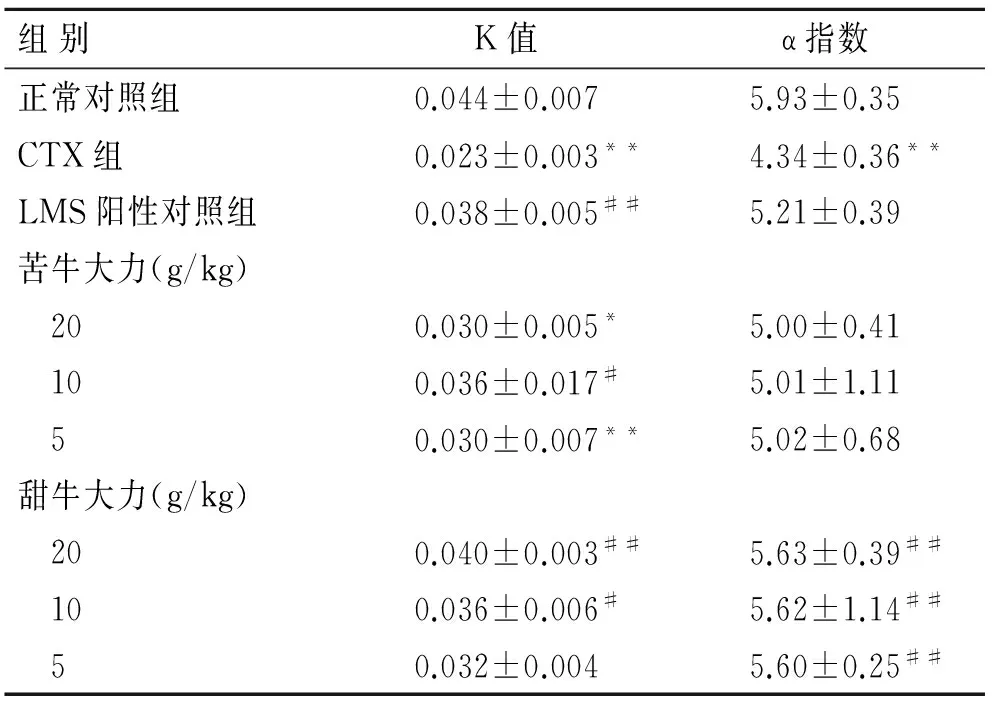
组别K值α指数正常对照组0.044±0.0075.93±0.35CTX组0.023±0.003**4.34±0.36**LMS阳性对照组0.038±0.005##5.21±0.39苦牛大力(g/kg) 200.030±0.005*5.00±0.41 100.036±0.017#5.01±1.11 50.030±0.007**5.02±0.68甜牛大力(g/kg) 200.040±0.003##5.63±0.39## 100.036±0.006#5.62±1.14## 50.032±0.0045.60±0.25##
与正常对照组比较,*P<0.05,**P<0.01;与CTX组比较,#P<0.05,##P<0.01。
表3苦牛大力及甜牛大力对小鼠体质量及免疫器官的影响
Tab.3Effects of RM Championi and RM Speciosa on body weight and immune organ index of the mice
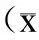
±s, n=10)
与正常对照组比较,*P<0.05,**P<0.01;与CTX组比较,#P<0.05,##P<0.01;与相应剂量的苦牛大力组比较,△P<0.05,△△P<0.01。
3讨论
CTX是一种较强的烷化剂,广泛应用于临床化疗。已有大量研究表明,CTX可抑制动物的体液和细胞免疫应答,造成动物的免疫抑制[7,9]。小鼠腹腔注射 CTX后能否形成免疫低下模型与CTX的给药剂量和给药时间关系密切。CTX的给药剂量过低,不仅不能对机体起免疫抑制作用,反而可能会提高机体的免疫功能。此外,免疫细胞在免疫应答和免疫调节过程中都需要被充分激活,随着给药时间的后移可能会使抑制作用减弱[10]。本研究采用80 mg/kg CTX腹腔注射正常小鼠3 d,可引起较为严重的免疫抑制。
胸腺是T淋巴细胞分化成熟的中枢免疫器官,脾脏则是体内最大的外周免疫器官,在免疫激活过程中,免疫细胞的大量增殖和分化成熟会导致两者的质量增加,故观察其质量的改变可以直观地反映小鼠免疫功能的变化。有研究报道CTX可引起脾脏萎缩[11],实验中CTX组脾指数明显升高,提示可能由于CTX停用后,引起代偿性脾脏增生;而胸腺指数降低,则可能是胸腺淋巴细胞较脾淋巴细胞更易于凋亡。此外,胸腺淋巴细胞的凋亡也可直接或间接地促进脾淋巴细胞的增殖[12-13]。本研究结果显示,苦牛大力、甜牛大力在一定剂量范围内可增加免疫抑制小鼠的体质量和免疫器官质量,提示苦牛大力、甜牛大力对免疫低下小鼠免疫器官具有一定的保护和恢复作用。
骨髓是人和哺乳动物的造血器官和中枢免疫器官,外周白细胞是机体抵御外界微生物的重要组成部分,其寿命短暂,需骨髓干细胞源源不断分化补充[14]。本研究结果显示,高、中剂量的苦牛大力、甜牛大力组均可显著拮抗CTX导致的骨髓抑制状态,明显增加免疫低下小鼠白细胞数量。细胞免疫是以T细胞为主的免疫应答,DTH即是以T细胞介导的超敏反应,机体细胞免疫功能强弱常用足趾增厚法检验[15]。苦牛大力、甜牛大力各剂量组可显著促进免疫低下小鼠的DTH程度,其中高、中剂量甜牛大力组致敏作用较苦牛大力相应剂量组明显,提示二者在免疫调节方面具有相似作用。
单核-巨噬细胞系统(mononuclear phagocytic system, MPS)是机体非特异性免疫系统的重要组成部分,巨噬细胞在免疫应答过程中可活化并通过产生反应性氧中间物和反应性氮中间物而杀伤微生物,从而发挥抗肿瘤、抗感染功能[16]。印度墨汁作为颗粒状异物静脉注射进入血循环,能迅速被单核吞噬细胞清除,故测定单核吞噬细胞的吞噬能力可以反映MPS吞噬功能的强弱。本研究结果显示,苦牛大力、甜牛大力均可增加巨噬细胞的吞噬功能,其中甜牛大力组呈现一定的剂量依赖性,而苦牛大力组并没体现出明显的量效关系,提示两者对单核-巨噬细胞吞噬功能的调节作用可能不同。
本实验通过检测以上免疫学指标,综合评价与比较苦牛大力、甜牛大力的免疫调节功能。结果表明,甜牛大力在提高细胞免疫功能方面的作用稍强于苦牛大力,而在其余指标上,甜牛大力与苦牛大力的作用差异无统计学意义。提示苦牛大力同样可作为一种免疫增强剂,应用于肿瘤患者手术、放疗及化疗的后期恢复。此外,本实验发现,造模一段时间后,雄性小鼠对比雌性小鼠生理状态较差,体毛脱落严重,且睾丸有不同程度萎缩;而甜牛大力与苦牛大力处理组的雄性小鼠生理状态有较大改善,睾丸萎缩程度较CTX免疫抑制小鼠轻。有研究报道,CTX可对雄性小鼠生殖系统造成影响[17]。因此,后期可以设计小鼠精子畸形试验、小鼠睾丸染色体畸变试验等,进一步观察牛大力是否能拮抗CTX的生殖毒性。苦牛大力、甜牛大力的干预并不能完全阻断CTX不良反应的发生,其提高免疫力的详细机制还有待进一步的研究。
参考文献:
[1] 国家中医药管理局《中华本草》编委会. 中华本草[M]. 上海:上海科学技术出版社, 1999:571-572.
[2] 广东省食品药品监督管理局. 广东省中药材标准(第一册)[S]. 广东:广东科技出版社, 2004:40.
[3] 王春华,王英,王国才,等. 牛大力的化学成分研究[J]. 中草药, 2008, 39(7):972-975.
[4] 陈德力,弓宝,刘洋洋,等. 牛大力根脂溶性成分的GC-MS分析[J]. 陕西中医, 2015, 36(9):1248-1250.
[5] 韦玉燕,巫繁菁,曾海生,等. 牛大力研究概况[J]. 广西科学院学报, 2010, 26(3):380-382.
[6] 韦翠萍,刘丹丹,唐立海,等. 牛大力对小鼠免疫功能的影响[J]. 广州中医药大学学报, 2009, 26(6):539-542.
[7] 赵英虎,高莉,赵恒寿,等. 阿司匹林对环磷酰胺模型小鼠免疫功能的影响[J]. 中国抗生素杂志, 2013, 38(2):149-154.
[8] 陈霆,李枫棣,邓巍,等. 小鼠内眦静脉丛注射与尾静脉注射比较[J]. 中国比较医学杂志, 2014, 24(1): 72-73.
[9] MOTOYOSHI Y, KAMINODA K, SAITOH O, et al. Different mechanisms for anti-tumor effects of low-and high-dose cyclophosphamide[J]. Oncol Rep, 2006, 16(1):141-146.
[10] 赵弋清,罗霞,陈东辉,等. 不同剂量环磷酰胺诱导正常小鼠免疫抑制的对比研究[J]. 免疫学杂志, 2005, 21(3):122-124.
[11] 王晓丹,杨洪武,袁雪芬,等. 海参粉对小鼠机体免疫功能影响[J]. 中国公共卫生, 2014, 30(12):1542-1544.
[12] KUVIBIDILA SR, VELEZ M, GARDNER R, et al. Iron deficiency reduces serum andinvitrosecretion of interleukin-4 in mice independent of altered spleen cell proliferation[J]. Nutr Res, 2012, 32(2):107-115.
[13] LI N, JI PY, SONG LG, et al. The expression of molecule CD28 and CD38 on CD4+/CD8+T lymphocytes in thymus and spleen elicited by Schistosoma japonicum infection in mice model[J]. Parasitol Res, 2015, 114(8): 3047-3058.
[14] HATHERLEY D, BARCLAY AN. The CD200 and CD200 receptor cell surface proteins interact through their N-terminal immunoglobulin-like domains[J]. Eur J Immunol, 2004, 34(6):1688-1694.
[15] 富校轶,李博群,张时莹,等. 超滤大豆蛋白肽对小鼠免疫功能的影响[J]. 食品工业科技, 2012, 33(7):338-341.
[16] 吴小南,杨雪帆,朱萍萍,等. 慈菇多糖对免疫功能低下小鼠免疫调节作用[M]. 中国公共卫生, 2015, 31(1):73-75.
[17] KIM SH, LEE IC, BAEK HS, et al. Protective effect of diallyl disulfide on cyclophosphamide-induced testicular toxicity in rats[J]. Lab Animl Res, 2013, 29(4):204-211.
(编辑国荣)
Comparison of the immunoregulatory effects of Radix Millettia Speciosa and Radix Millettia Championi on immunosuppressed mice
XIE Chan1, HUANG Hui-xue2, DENG Ri-jian3, LIU Hua-gang1, LIANG Qiu-yun1
(1. College of Pharmacy, Guangxi Medical University, Nanning 530021;2. College of Pharmacy, Guangxi University of Chinese Medicine, Nanning 530200;3. Jiayuan Herbal Medicine Professional Cooperatives, Nanning 530041, China)
ABSTRACT:ObjectiveTo compare the immunoregulatory effects of Radix Millettia Speciosa (RM Speciosa) and Radix Millettia Championi (RM Championi) on immunosuppressed mice. MethodsKunming mice were randomly divided into normal control group, CTX model group, LMS positive group, RM Speciosa groups and RM Championi groups (20, 10 and 5 g/kg). The mice were treated respectively with drug or NS once a day for consecutive 20 days. Mice in the other groups were injected intraperitoneally with CTX at days 8, 10 and 12 to establish immunosuppressed mice model except the normal group. The changes of body weight, immune organ weight, white blood cell (WBC) number, carbon particle clearance capability of macrophages and delayed type hypersensitivity (DTH) of mice in all groups were determined and compared. ResultsCompared with that in CTX group, the WBC number was significantly increased (P<0.01 or P<0.05) and the degree of DTH (P<0.01) was enhanced at different doses in RM Speciosa groups and RM Championi groups. The activity of macrophages and the index of thymus and spleen were also improved in the treatment groups (P<0.05 or P<0.01). The index of thymus and the degree of DTH in RM Speciosa groups (20 and 10 g/kg) were slightly higher than those in the corresponding RM Championi groups (P<0.01 or P<0.05). For other indicators, RM Speciosa groups did not significantly differ from RM Championi groups (P>0.05). ConclusionBoth RM Speciosa and RM Championi can improve the immune function of CTX-induced immunosuppressed mice, and RM Speciosa is slightly superior to RM Championi in improving specific cellular immunity.
KEY WORDS:Radix Millettia Speciosa (RM Speciosa); Radix Millettia Championi (RM Championi); immuno-regulation function; cyclophosphamide; immunosuppression
收稿日期:2015-08-12修回日期:2015-11-17
通讯作者:梁秋云. E-mail:qiuyun_liang@163.com
中图分类号:R967
文献标志码:A
DOI:10.7652/jdyxb201603031
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160411.1559.022.html(2016-04-11)
