高同型半胱氨酸血症对急性ST段抬高型心肌梗死患者淋巴细胞KV1.3-CaN-NFAT信号通路的影响
2016-06-06王玉岭贾绍斌侯建军丛广志杨绍兵
王玉岭,贾绍斌,侯建军,丛广志,杨绍兵,崔 莹,王 凯
(1.宁夏医科大学,宁夏银川 750004;2. 宁夏医科大学总院心脏中心,宁夏银川 750004)
◇临床研究◇
高同型半胱氨酸血症对急性ST段抬高型心肌梗死患者淋巴细胞KV1.3-CaN-NFAT信号通路的影响
王玉岭1,贾绍斌2,侯建军2,丛广志2,杨绍兵1,崔莹1,王凯1
(1.宁夏医科大学,宁夏银川750004;2. 宁夏医科大学总院心脏中心,宁夏银川750004)
摘要:目的观察不同水平高同型半胱氨酸血症(Hhcy)对急性ST段抬高型心肌梗死(STEMI)患者淋巴细胞内电压门控性钾离子通道(KV1.3通道)-钙调神经磷酸酶(CaN)-活化T细胞核因子(NFAT)-炎性因子(IL-6、TNF-α)mRNA及蛋白表达水平的影响。方法入选STEMI患者90例,根据血浆Hcy水平分为3组:实验A组(STEMI组,Hcy<15 μmol/L, n=30)、实验B组(STEMI+轻度Hhcy组,Hcy 15~30 μmol/L, n=30)、实验C组(STEMI+中度Hhcy组,Hcy>30 μmol/L, n=30),另选取健康体检者30例为对照组。抽取血标本后使用全自动生化仪测定血浆Hcy浓度,密度梯度离心法提取淋巴细胞,RT-PCR检测KV1.3、CnAα、NFAT1、IL-6、TNF-α mRNA的表达,Western blot检测KV1.3、CnAα、NFAT1 蛋白的表达。结果各实验组较对照组KV1.3、CnAα和NFAT1的mRNA和蛋白表达水平升高(P<0.05或P<0.01),各实验组间两两比较显示,实验B组较实验A组表达水平升高(P<0.05或P<0.01),实验C组较实验B组和实验A组表达水平升高(P<0.05或P<0.01)。各实验组IL-6和TNF-α的mRNA表达水平高于对照组(P<0.01),各实验组间两两比较显示,实验B组较实验A组表达水平升高(P<0.01),实验C组较实验B组和实验A组表达水平升高(P<0.01)。实验组血浆Hcy水平与KV1.3 mRNA和蛋白表达之间呈正相关,相关系数分别为r=0.503(P=0.000)、r=0.726(P=0.000)。结论血浆Hcy浓度水平越高,STEMI患者淋巴细胞内KV1.3-CnAα-NFAT1的mRNA和蛋白表达水平及炎性因子IL-6、TNF-α的mRNA表达水平越高,这一信号通路可能是Hcy加重STEMI炎症反应的机制之一。
关键词:高同型半胱氨酸血症;急性ST段抬高型心肌梗死;淋巴细胞;信号通路;炎症反应;白细胞介素-6(IL-6);肿瘤坏死因子-α(TNF-α)
已形成的粥样硬化斑块破裂和随之形成的血栓是发生急性ST段抬高型心肌梗死(acute ST-segment elevation myocardial infarction, STEMI)的关键因素。多种免疫细胞,特别是淋巴细胞和单核细胞持续入侵病变部位是导致粥样硬化斑块不稳定的重要因素[1]。已证明同型半胱氨酸(homocysteine, Hcy)是动脉粥样硬化发生的独立危险因素,与动脉病变的严重程度和病变支数呈正相关[2]。Hcy与血管壁免疫炎症反应的关系越来越受到重视,但其与淋巴细胞之间作用机制的报道甚少。目前认为淋巴细胞经抗原刺激后,细胞膜电压门控性钾离子通道(voltage dependent K+channel, KV1.3 channel)基因高表达是其活化的关键因素,继而活化钙调神经磷酸酶(calcineurin, CaN),使得活化T细胞核因子(nuclear factor of activated T cell, NFAT)去磷酸化,并转移至核内,进而引起炎性因子表达增加[3]。目前,鲜有Hcy对上述信号通路影响的研究。本课题选取STEMI合并血浆Hcy不同浓度水平患者,通过对淋巴细胞内KV1.3通道、CnAα、NFAT1 mRNA和蛋白及炎性因子白细胞介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)mRNA表达水平的测定,探讨高同型半胱氨酸血症(hyperhomocysteinemia, Hhcy)作用于淋巴细胞进而加重STEMI炎症反应的发生机制。
1材料与方法
1.1主要试剂及仪器 淋巴细胞分离液(北京索来宝),Trizol(美国Life technologies),反转录及SYBR Green qPCR试剂(Thermo公司),全蛋白提取试剂盒及BCA蛋白定量检测试剂盒(凯基生物公司),KV1.3、CnAα、NFAT1、IL-6、TNF-α、GAPDH引物(上海生工公司设计合成),KV1.3、CnAα、NFAT1一抗(abcam产品),辣根酶标记山羊抗小鼠、山羊抗兔IgG(H+L)(中杉金桥产品),QT-PCR机子(Bio-Rad IQ 5产品),Western blot试剂(Biorad公司),Hcy检测仪(拜耳ADVIA2400)。
1.2研究对象根据2013年ACC/AHA的STEMI的诊断标准[4],入选2014年10月~2015年7月在宁夏医科大学总医院确诊的90例STEMI患者。男70例,女20例,年龄35~70岁,平均年龄(54.23±10.30)岁。血浆Hcy>15 μmol/L作为Hhcy的诊断标准[5],将STEMI患者分为实验A组(STEMI组,Hcy<15 μmol/L,n=30)、实验B组(STEMI合并轻度Hhcy血症组,Hcy 15~30 μmol/L,n=30)和实验C组(STEMI合并中度Hhcy血症组,Hcy>30 μmol/L,n=30)。对照组为同期在我院体检的30例健康者,其中男18例,女12例,年龄35~70岁,平均年龄(53.4±6.26)岁。排除标准:心源性休克、重度心力衰竭、严重室性心律失常、肝功能异常、肾功能异常,同时患有其他炎症性疾病、感染、恶性肿瘤或其他免疫系统和造血系统疾病,近期服用叶酸、B族维生素药物及怀孕或授乳期妇女。本研究获宁夏医科大学总医院医学伦理委员会批准,受试者均签署知情同意书。
1.3一般资料收集及危险因素的评估与定义一般临床资料采集自受试对象本人,如果与患者无法沟通,通过其直系亲属采集。一般临床资料收集包括姓名、性别、年龄,危险因素包括高血压病史、糖尿病史、高脂血症、吸烟史。高血压病诊断标准依据JNC8《2014成人高血压管理指南》[6],糖尿病诊断标准依据《2015年AACE、ACE糖尿病指南》[7],高脂血症诊断标准依据《2013ACC/AHA ASCVD血脂指南》[8]。
1.4全自动生化仪测定血浆Hcy浓度STEMI患者于入院后次日晨,对照组于体检日晨空腹抽取静脉血2 mL,置含有20 g/L乙二胺酸二钠抗凝试管中,Hcy浓度由宁夏医科大学总院检验科使用拜耳ADVIA2400全自动生化仪测定。
1.5淋巴细胞的分离提取及相关检测
1.5.1淋巴细胞的分离提取STEMI患者于入院后次日晨,对照组于体检日晨抽取肘静脉血5 mL置于肝素抗凝试管中。生理盐水稀释抗凝血后缓慢加于等体积的淋巴细胞分离液上,密度梯度离心法离心吸出试管中第2层白色絮状物,再次加入生理盐水离心后弃上清,加入含100 mL/L胎牛血清的1640培养基混匀细胞沉淀,37 ℃、50 mL/L CO2温箱孵育2 h,取含淋巴细胞的上清液,以去除贴壁单核细胞。
1.5.2实时荧光定量PCR检测KV1.3、CnAα、NFAT1、IL-6和TNF-α的mRNA表达按照TRIzol reagent说明书操作提取淋巴细胞总RNA,使用RevertAidTMFirst Strand cDNA Synthesis Kit将RNA逆转录合成cDNA,然后进行PCR扩增反应,引物见表1。于Bio-Rad IQ5定量分析仪进行PCR反应:每个样品设置复孔3个,预变性95 ℃、10 min,变性95 ℃、15 s,退火60 ℃、30 s,延伸72 ℃、30 s,变性、退火和延伸共40个循环。分析样本Ct值,mRNA相对表达水平根据2-ΔΔCt计算获得。ΔΔCt=(Ct目的基因―Ct管家基因)实验组―(Ct目的基因―Ct管家基因)对照组,以GAPDH为内参,对照组为基线。
表1KV1.3、CnAα、NFAT1、IL-6、TNF-α、内参β-actin的引物序列
Tab.1Primer sequences of KV1.3, CnAα, NFAT1, IL-6, TNF-α and β-actin
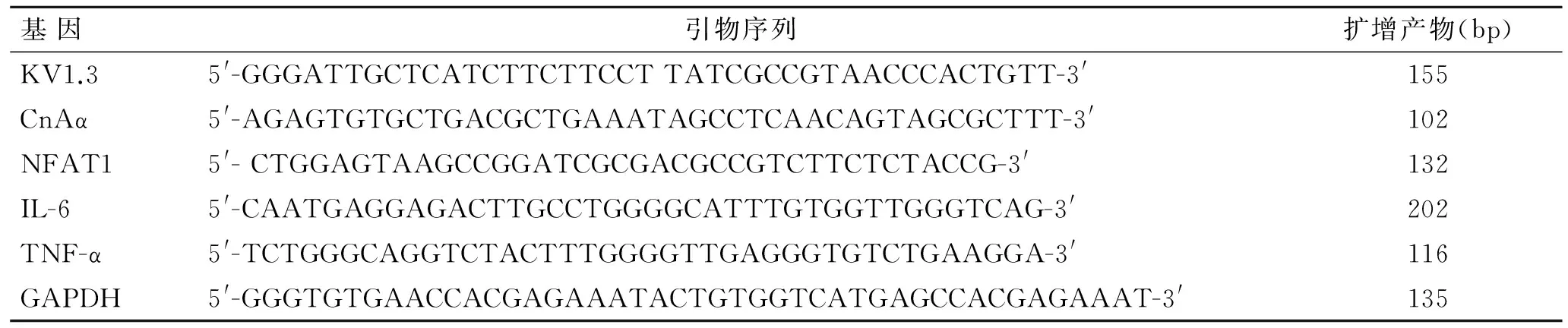
基因引物序列扩增产物(bp)KV1.35'-GGGATTGCTCATCTTCTTCCTTATCGCCGTAACCCACTGTT-3'155CnAα5'-AGAGTGTGCTGACGCTGAAATAGCCTCAACAGTAGCGCTTT-3'102NFAT15'-CTGGAGTAAGCCGGATCGCGACGCCGTCTTCTCTACCG-3'132IL-65'-CAATGAGGAGACTTGCCTGGGGCATTTGTGGTTGGGTCAG-3'202TNF-α5'-TCTGGGCAGGTCTACTTTGGGGTTGAGGGTGTCTGAAGGA-3'116GAPDH5'-GGGTGTGAACCACGAGAAATACTGTGGTCATGAGCCACGAGAAAT-3'135
1.5.3Western blot检测KV1.3、CnAα和NFAT1蛋白的表达应用全蛋白提取试剂提取淋巴细胞总蛋白,采用BCA法定量蛋白浓度。将等量的蛋白质样品点于SDS-PAGE凝胶小孔进行电泳分离,经湿转法转移至PVDF膜上。PVDF膜经1×TBST洗涤3次后浸入50 g/L脱脂奶粉液封闭2 h。分别加入鼠抗KV1.3单克隆抗体(1∶300稀释)、兔抗CnAα单克隆抗体(1∶700稀释)、鼠抗NFAT1单克隆抗体(1∶200稀释)和鼠抗β-Actin单克隆抗体(1∶5 000稀释),4 ℃摇床过夜后取出膜用TBST洗涤后,KV1.3、NFAT1、β-Actin因子加入辣根酶标记山羊抗小鼠IgG(H+L)、CnAα因子加入辣根酶标记山羊抗兔IgG(H+L)(1∶5 000稀释),室温孵育2 h,再次用TBST洗膜后使用加强型ECL试剂进行化学发光反应。经曝光及显影定影后,使用凝胶成像分析系统Quantity One软件分析蛋白条带灰度值,计算目的基因蛋白与β-Actin灰度值的比值,进行统计学分析。

2结果
2.1各组一般临床资料的比较各组间性别、年龄、吸烟、高血压病、糖尿病和高脂血症差异无统计学意义(P>0.05)。4组间血浆Hcy水平比较,差异有统计学意义(P<0.05);进一步两两比较,实验A组与对照组差异无统计学意义(P>0.05),实验B组与实验C组差异有统计学意义(P<0.05),并且均与对照组差异有统计学意义(P<0.05,表2)。
2.2各组淋巴细胞KV1.3、CnAα、NFAT1、IL-6和TNF-α的mRNA表达各实验组较对照组表达水平明显升高;在各实验组间,随着Hcy浓度的升高,KV1.3、CnAα、NFAT1、IL-6和TNF-α的mRNA表达水平升高,方差分析及组间两两比较差异有统计学意义(P<0.05或P<0.01,表3)。
2.3各组淋巴细胞KV1.3、CnAα、NFAT1的蛋白表达各实验组较对照组KV1.3、CnAα和NFAT1蛋白表达水平明显升高,在各实验组间,随着Hcy浓度的升高,KV1.3、CnAα和NFAT1的蛋白表达水平升高,方差分析及组间两两比较,差异有统计学意义(P<0.05或P<0.01,图1、图2)。
表2各组一般临床资料的比较
Tab.2The comparison of general clinical date in each group
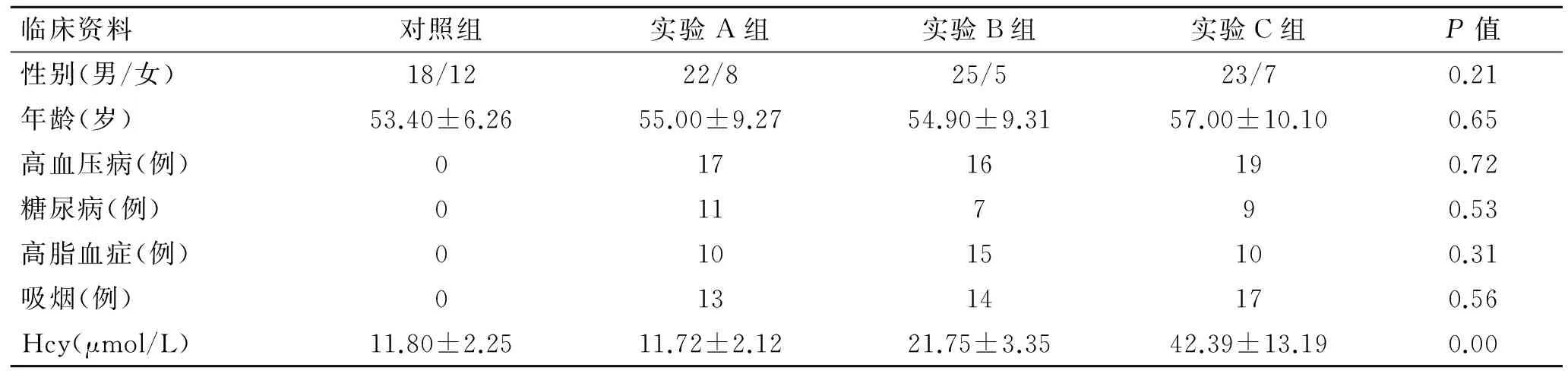
(n=30)
实验A组:STEMI组,Hcy<15 μmol/L;实验B组:STEMI合并轻度Hhcy血症组,Hcy 15~30 μmol/L;实验C组:STEMI合并中度Hhcy血症组,Hcy>30 μmol/L。
表3各组淋巴细胞KV1.3、CnAα、NFAT1、IL-6和TNF-α的mRNA相对表达量
Tab.3The relative expressions of KV1.3, CnAα, NFAT1, IL-6 and TNF-α mRNA in each group
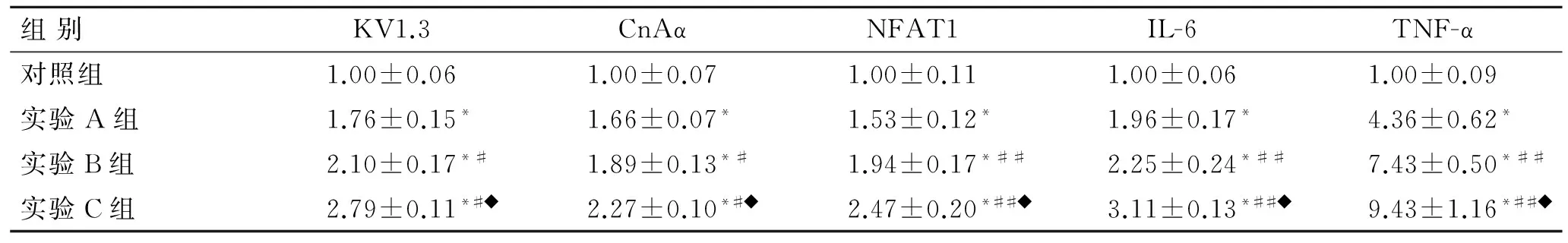
组别KV1.3CnAαNFAT1IL-6TNF-α对照组1.00±0.061.00±0.071.00±0.111.00±0.061.00±0.09实验A组1.76±0.15*1.66±0.07*1.53±0.12*1.96±0.17*4.36±0.62*实验B组2.10±0.17*#1.89±0.13*#1.94±0.17*##2.25±0.24*##7.43±0.50*##实验C组2.79±0.11*#◆2.27±0.10*#◆2.47±0.20*##◆3.11±0.13*##◆9.43±1.16*##◆
与对照组比较,*P<0.01;与实验A组比较,#P<0.05,##P<0.01;与实验B组比较,◆P<0.01。
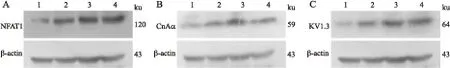
图1Western blot检测各组淋巴细胞KV1.3(A)、CnAα(B)、NFAT1(C)蛋白的表达条带图
Fig.1 CnAα(A), CnAα(B) and NFAT1(C) protein expressions in each group detected by Western blot
1:对照组;2:实验A组;3:实验B组;4:实验C组。
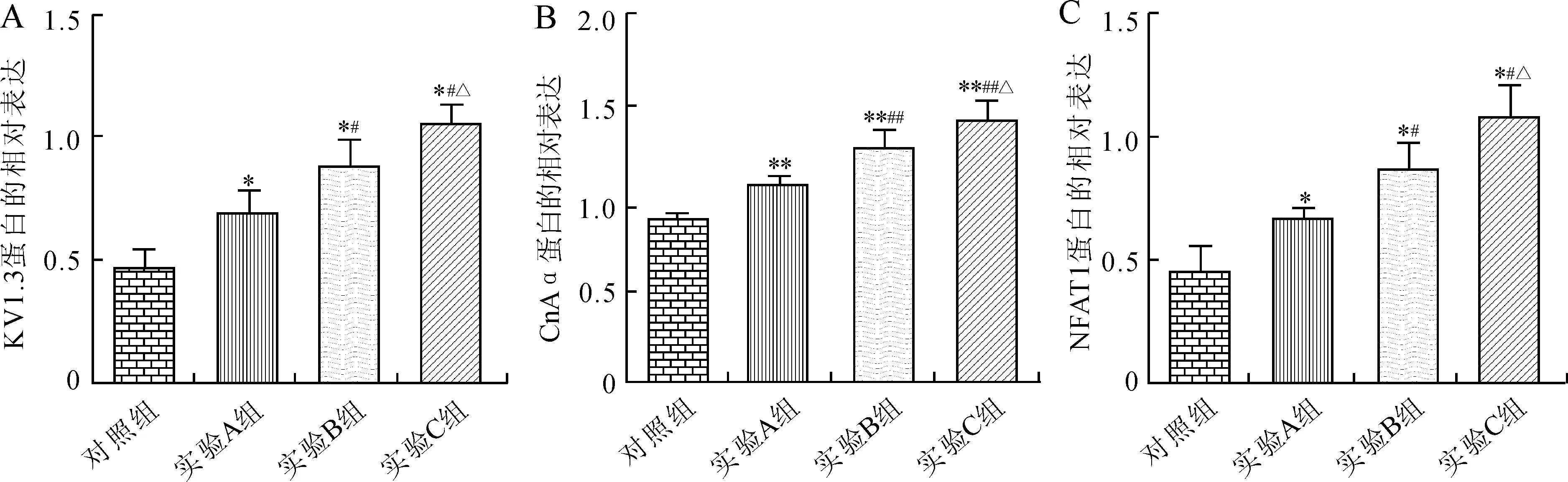
图2各组淋巴细胞KV1.3(A)、CnAα(B)及NFAT1(C)蛋白相对表达量的统计学分析
与对照组比较,*P<0.05,**P<0.01;与实验A组比较,#P<0.05,##P<0.01;与实验B组比较,△P<0.05。
2.4Hcy与KV1.3的相关性分析对实验各组Hcy与KV1.3的mRNA和蛋白表达量之间进行线性相关分析,结果表明:Hcy与KV1.3 mRNA表达量呈正相关(r=0.503,P=0.000),Hcy与KV1.3蛋白表达量呈正相关(r=0.726,P=0.000,图3)。
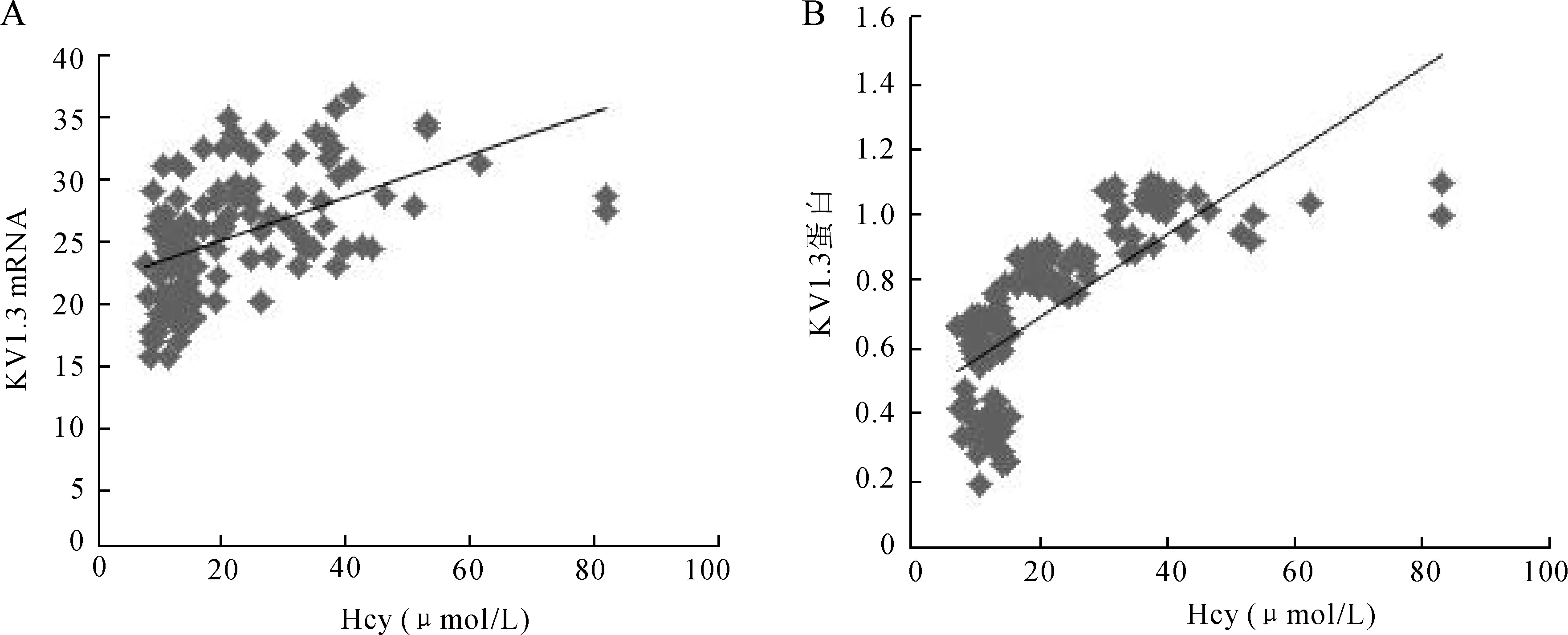
图3Hcy 与KV1.3 mRNA(A)及蛋白(B)的线性相关分析
Fig.3 Linear correlation analysis between Hcy and KV1.3 mRNA(A) and protein(B)
3讨论
近年来,研究提示急性STEMI的发生和发展与炎症反应密切相关,其中淋巴细胞介导的免疫炎性反应在这一过程中发挥了重要作用[9]。做为一种促炎症因子,许多研究显示Hcy通过多个方面作用于由细胞免疫介导的局部和全身慢性炎症,抑制内皮细胞的生长和损伤后的血管内皮再生,刺激血管平滑肌的增殖和炎症性单核细胞的分化;在淋巴细胞中具有促进伴刀豆球蛋白A(ConA)所致的T淋巴细胞的增殖和脂多糖诱导的B淋巴细胞的增殖作用[10]。这种增殖是Hcy经由产生活性氧自由基,以及蛋白激酶C、氧化还原敏感性的核因子-κB途径实现的,然而Hcy和淋巴细胞膜KV1.3通道之间的作用机制报道甚少。本实验通过对STEMI合并不同血浆浓度Hcy患者和健康体检者的淋巴细胞KV1.3通道、CnAα和NFAT1 mRNA和蛋白进行检测,结果显示,STEMI患者KV1.3、CnAα和NFAT1的mRNA和蛋白表达水平较健康体检者明显增高,且随着STEMI患者Hcy水平的升高,其表达水平逐渐升高。实验表明,不同血浆浓度Hcy作用于淋巴细胞,其KV1.3、CnAα和NFAT1 mRNA和蛋白表达水平也不同。Hcy浓度与KV1.3的mRNA和蛋白表达具有正相关性,Hcy浓度越高,KV1.3 mRNA和蛋白表达水平也越高,进而导致CnAα和NFAT1 mRNA和蛋白表达水平也相应增高。膜片钳研究显示,TEM淋巴细胞膜上主要表达KV1.3通道,在形成K+通过质膜的扩散电位和加强Ca2+内流致淋巴细胞活化和增殖中发挥关键作用[3]。选择性抑制KV1.3通道,可导致细胞膜的去极化,抑制效应T细胞的钙信号传导、炎症因子分泌、T淋巴细胞在体外的增殖和在体内迁移到组织等功能[11]。
近年大量资料表明,CaN是淋巴细胞膜KV1.3通道活化致炎症反应发生发展过程中一个关键的信号酶,NFAT是CaN最重要的底物[12]。CaN属丝氨酸/苏氨酸蛋白磷酸酶家族,其催化亚基(calcineurin A, CnA)有3种主要同工酶:CnAα、CnAβ、CnAγ。心脏中CnAα的含量显著高于其他两型。NFAT是T淋巴细胞受抗原刺激后产生细胞因子所需的转录因子,NFAT1-4在心脏都有表达[13]。CaN-NFAT信号通路的调控过程为:炎症因子通过刺激淋巴细胞致维持静息电位的KV1.3通道活化、开放增多,细胞内K+胞外流增多,细胞膜的超极化使胞外钙内流增多诱发CnA构象改变,暴露其磷酸酶活性位点致CaN活化。激活的CaN使NFAT去磷酸化,暴露其原本被掩蔽的核输出信号,转运入核内并作用于基因启动子中的顺式作用元件而调控许多细胞因子(如IL-2、IL-6、IFN-γ和TNF-α等)的基因表达[14-15]。当抑制CaN活性时,NFAT在NFAT激酶作用下重新磷酸化并迅速转运出细胞核,NFAT依赖性基因的表达被终止[15]。
为了进一步发现Hcy是否能通过KV1.3-CnAα-NFAT1途径影响STEMI患者淋巴细胞的炎性因子分泌,本实验用RT-PCR进一步检测了炎性因子IL-6、TNF-α的mRNA表达水平。结果显示,STEMI患者IL-6、TNF-α的mRNA表达水平较健康体检者明显增高,且随着STEMI患者Hcy水平的升高,其表达水平逐渐升高。IL-6作为一种重要的促炎性因子,可诱导趋化蛋白和粘附分子,包括血管细胞粘附分子(VCAM)-1和细胞间粘附分子(ICAM)-1,激活炎性细胞在内皮下组织的趋化和浸润,还可触发基质蛋白降解酶和活性氧的释放,加重动脉粥样硬化病变的进展[16]。TNF-α与动脉粥样硬化的形成密功相关,主要作用是增强白细胞趋化,增加血管细胞增殖迁移,介导主要组织相容性复合体(MHC)抗原的表达和基质沉积等血管炎症反应,直接损伤内皮细胞使脂质易于沉积形成动脉粥样斑块,诱导血小板粘附,产生血小板源性生长因子,破坏血凝-抗血凝平衡,促进血栓形成[17]。本实验表明Hcy通过作用于淋巴细胞KV1.3-CnAα-NFAT1途径使炎性因子IL-6、TNF-α的表达增加。
本研究提示,抑制Hcy刺激的淋巴细胞免疫炎症反应,进而改善粥样硬化斑块的稳定性,可能成为防治STEMI合并Hhcy的有效干预点,并具有一定的临床应用前景。然而,在心血管事件中,通过补充B族维生素和叶酸降低Hcy水平作用并不明显[18]。因此,高选择性的KV1.3抑制剂四氨基吡啶(4-AP)、四乙铵(TEA)[19],CaN抑制剂环孢素A(CsA)、他克莫司(FK506)或NFAT抑制剂VIVIT肽[20]可为抑制STEMI合并Hhcy的炎症反应和减少心血管事件的发生提供新思路。
参考文献:
[1] 袁祖贻,郜珊珊. 巨噬细胞亚型在动脉粥样硬化过程中的影响及淋巴细胞对其亚型分化作用的影响[J]. 西安交通大学学报(医学版), 2013, 34(3):277-281.
[2] FANG P, ZHANG D, CHENG Z, et al. Hyperhomocysteinemia potentiates hyperglycemia-induced inflammatory monocyte differentiation and atherosclerosis[J]. Diabetes, 2014, 63(12):4275-4290.
[3] KAZAMA I. Physiological significance of delayed rectifier K(+) channels (Kv1.3) expressed in T lymphocytes and their pathological significance in chronic kidney disease[J]. JPS, 2015, 65(1):25-35.
[4] O’GARA PT, KUSHNER FG, ASCHEIM DD, et al. 2013 ACCF/AHA Guideline for the Management of ST-elevation Myocardial Infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J]. J Am Coll Cardiol, 2013, 61(4):140-178.
[5] 中国高血压防治指南修订各委员会. 中国高血压防治指南2010 [J]. 中华高血压杂志, 2011, 19(8):701-741.
[6] ARMSTRONG C. JNC8 Guidelines for the Management of Hypertension in Adults[J]. Am Fami Physician, 2014, 90(7):503-504.
[7] HANDELSMAN Y, BLOOMGARDEN ZT, GRUNBERGER G, et al. American Association of Clinical Endocrinologists and American College of Endocrinology—Clinical Practice Guidelines for Developing a Diabetes Mellitus Comprehensive Care Plan—2015[J]. Endoc Prac, 2015, 21(6):11-87.
[8] LIM TH, ORIJA IB, PEARLMAN BL. The new cholesterol treatment guidelines from the American College of Cardiology/American Heart Association, 2013:what clinicians need to know[J]. Postgrad Med, 2014, 126(7):35-44.
[9] 聂大奥,赵一俏,靳文,等. 外周血T细胞亚群构成比例与冠状动脉粥样硬化的关系[J]. 中国动脉硬化杂志, 2013, 21(6):532-537.
[10] CHANG L, ZHANG Z, LI W, et al. Liver-X-receptor activator prevents homocysteine-induced production of IgG antibodies from murine B lymphocytes via the ROS-NF-kappaB pathway[J]. Biochem Biophysical Res Commun, 2007, 357(3):772-778.
[11] BEETON C, WULFF H, STANDIFER NE, et al. KV1.3 channels are a therapeutic target for T cell-mediated autoimmune diseases[J]. PNAS, 2006, 103(46):17414-17419.
[12] HOGAN PG, CHEN L, NARDONE J, et al. Transcriptional regulation by calcium, calcineurin, and NFAT [J]. Genes Dev, 2003, 17(18):2205-2232.
[13] FRIC J, LIM CX, KOH EG, et al. Calcineurin/NFAT signalling inhibits myeloid haematopoiesis[J]. EMBO Mol Med, 2012, 4(4):269-282.
[14] ZHANG S, LUO L, WANG Y, et al. Nuclear factor of activated T cells regulates neutrophil recruitment, systemic inflammation, and T-cell dysfunction in abdominal sepsis[J]. Infec Immun, 2014, 82(8):3275-3288.
[15] FRIC J, ZELANTE T, WONG AY, et al. NFAT control of innate immunity [J]. Blood, 2012, 120(7):1380-1389.
[16] SCHUETT H, OESTREICH R, WAETZIG GH, et al. Transsignaling of interleukin-6 crucially contributes to atherosclerosis in mice[J]. Arterioscler thromb Vasc Biol, 2012, 32(2):281-90.
[17] BABAEI M, DASHTI N, LAMEI N, et al. Evaluation of plasma concentrations of homocysteine, IL-6, TNF-alpha, hs-CRP, and total antioxidant capacity in patients with end-stage renal failure[J]. Acta Med Iran, 2014, 52(12):893-898.
[18] BANECKA-MAJKUTEWICZ Z, SAWUA W, KADZISKI L, et al. Homocysteine, heat shock proteins, genistein and vitamins in ischemic stroke —pathogenic and therapeutic implications[J]. Acta Biochim Pol, 2012, 59(4):495-499.
[19] XU R, CAO M, WU X, et al. KV1.3 channels as a potential target for immunomodulation of CD4+CD28null T cells in patients with acute coronary syndrome[J]. Clin Immunol, 2012, 142(2):209-217.
[20] SHOU J, JING J, XIE J, et al. Nuclear factor of activated T cells in cancer development and treatment[J]. Cancer Lett, 2015, 361(2):174-184.
(编辑国荣)
Influence of hyperhomocysteinemia on signal pathway of KV1.3-CaN-NFAT in lymphocytes of patients with acute ST-segment elevation myocardial infarction
WANG Yu-ling1, JIA Shao-bin2, HOU Jian-jun2, CONG Guang-zhi2,YANG Shao-bing1, CUI Ying1, WANG Kai1
(1.Ningxia Medical University, Yinchuan 750004; 2. Heart Center, General Hospital of Ningxia Medical University, Yinchuan 750004, China)
ABSTRACT:ObjectiveTo observe the influence of different level of hyperhomocysteinemia on mRNA and protein expressions of KV1.3,CaN, NFAT, IL-6 and TNF-α in lymphocytes of patients with acute ST-segment elevation myocardial infarction (STEMI). MethodsWe selected 90 STEMI patients and divided them into three groups according to the level of plasma homocysteine: the first experimental group (STEMI group, Hcy<15 μmol/L, n=30), the second experimental group (STEMI with mild Hhcy group, Hcy 15~30 μmol/L, n=30) and the third experimental group (STEMI with intermediate Hhcy group, Hcy>30 μmol/L, n=30). Another 30 healthy examined people were selected as control group (n=30). Peripheral lymphocytes were isolated by Ficoll density gradient centrifugation. The Hcy in the plasma was measured with the IMX assays. Real-time quantitative PCR (RT-PCR) was used to detect mRNA expressions of KV1.3, CnAα, NFAT1, IL-6 and TNF-α and Western blot technique was used to detect the expressions of KV1.3, CnAα and NFAT1. ResultsThe mRNA and protein expression levels of KV1.3, CnAα and NFAT1 in each experimental group were significantly higher than those in control group (P<0.05 or P<0.01). Multiple comparison in each experimental group showed that compared with that in the first experimental group, the expression level of the second experimental group increased (P<0.05 or P<0.01) and compared with first and second experimental groups, the expression level of the third experimental group increased (P<0.05 or P<0.01). The mRNA expression levels of IL-6 and TNF-α in each experimental group were significantly higher than those in control group (P<0.05 or P<0.01). Multiple comparison in each experimental group showed that compared with that in the first experimental group, the expression level of the second experimental group increased (P<0.05 or P<0.01)and compared with first and second experimental groups, the expression level of the third experimental group increased (P<0.01). Plasma total Hcy levels were positively correlated with mRNA and protein expressions of KV1.3 in all observed groups (r=0.503 P=0.000, r=0.726 P=0.000). ConclusionThe higher level of Hcy in plasma, the higher mRNA and protein expression levels of KV1.3, CnAα , NFAT1 and the higher mRNA expression levels of IL-6, TNF-α in the lymphocyte of STEMI patients, which may be one mechanism for Hcy exacerbating the inflammatory reaction of STEMI.
KEY WORDS:hyperhomocysteinemia; acute ST-segment elevation acute myocardial infarction; lymphocyte; signal pathway; inflammation reaction; IL-6; TNF-α
收稿日期:2015-07-28修回日期:2015-11-13
基金项目:宁夏医科大学优势学科群建设科研项目(No.xy2014016)
通讯作者:贾绍斌. E-mail: jsbxn@163.com
中图分类号:R543.3
文献标志码:A
DOI:10.7652/jdyxb201603023
Supported by Ningxia Medical University Scientific Research Project (No.xy2014016)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160418.1817.004.html(2016-04-18)
