甲状腺微小乳头状癌诊断与治疗中国专家共识(2016版)中国抗癌协会甲状腺癌专业委员会(CATO)
2016-06-06高明,葛明华,嵇庆海等
甲状腺微小乳头状癌诊断与治疗中国专家共识(2016版)中国抗癌协会甲状腺癌专业委员会(CATO)
近年,甲状腺乳头状癌(papillary thyroid carcino⁃ma,PTC)发病趋势呈全球化激增,其中甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC)所占比重逐渐上升,其诊治热点与争议日益凸显。为进一步提高我国PTMC的诊治水平,并提供更加合理及规范的诊治方案,中国抗癌协会甲状腺癌专业委员会(Chinese Association of Thyroid Oncology,CATO)就目前PTMC的诊治现状制定了2016版中国《甲状腺微小乳头状癌诊断与治疗专家共识》,内容涵盖外科、病理、影像、内分泌、核医学等专业领域,结合近年来PTMC领域的最新临床研究成果和国内的实际情况,达成以下共识。本专家共识共23条推荐条款,鉴于目前国内外可供参考的资料尤其是前瞻性资料有限,疏漏在所难免,也希望专业人士多提宝贵意见,以便今后定期修订(推荐等级、条款见表1、表2)。
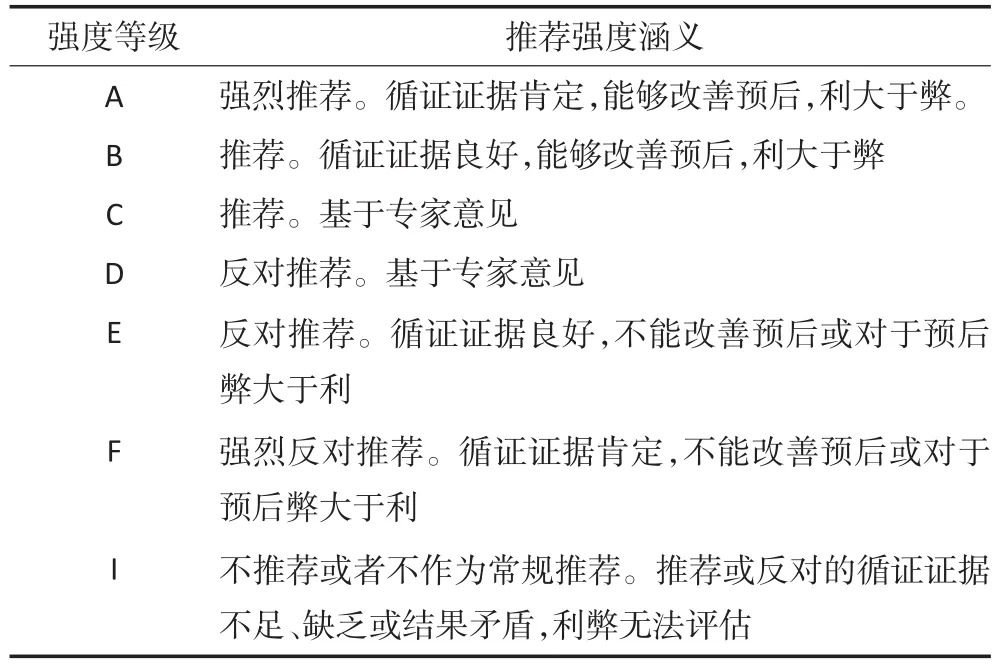
表1 推荐等级Table 1 Grade of recommendation

表2 推荐条款Table 2 Recommendating terms
1 PTMC的流行病学
世界卫生组织(WHO)定义甲状腺微小乳头状癌(PTMC)指肿瘤最大直径≤10 mm的甲状腺乳头状癌。近年来的SEER(surveillance epidemiology and end re⁃sults)数据库显示:甲状腺癌的患病率显著增加,其中以PTMC的增长为主且增速最快,但是其死亡率并无明显增加。2014年WHO公布的全球癌症报告指出,甲状腺癌新发病例中超过50%为PTMC。目前PTMC在国内外许多临床中心占据甲状腺癌诊疗的重要权重。
专家推荐:
(1)PTMC患病率上升明显,占据甲状腺癌诊治的重要权重;推荐等级:A
2 PTMC的影像诊断
PTMC影像学定性诊断的首选方法推荐采用高分辨率超声影像检查,而计算机断层扫描(CT)、磁共振成像(MRI)及正电子发射断层扫描(PET-CT)对于PTMC的定性效果均不及超声,因此不建议将CT、MRI和PET-CT作为诊断PTMC的常规检查方法。高分辨率超声影像检查建议应用二维成像(横切面加纵切面成像)并对多灶性PTMC进行分别定义,描述结节的位置和数量,进行“定位”与“定量”诊断,同时对颈部淋巴结情况进行评估。对于转移灶较大且或怀疑有周围组织侵犯的PTMC,强化CT/MRI可以作为评估手段。
目前在国内许多医院已应用甲状腺影像报告和数据系统分级(thyroid imaging-reporting and data sys⁃tem,TI-RADS)。超声科医师应在PTMC的TI-RADS分级方面统一认识(改良TI-RADS分级系统见表3),同时为进一步明确诊断,可采取超声引导下细针穿刺活检(fine needle aspiration biopsy,FNAB),必要时辅助分子标志物检测,可使PTMC术前诊断的准确率得到进一步的提高。超声造影及超声弹性成像对于高分辨率超声影像检查诊断困难的病例,可作为补充手段,但不建议常规使用。
专家推荐:
(2)PTMC首选的影像学诊断方法推荐采用高分辨率超声影像检查;推荐等级:A
(3)为进一步确诊PTMC,可推荐采取超声引导下FNAB;推荐等级:B
(4)超声造影及超声弹性成像可以作为超声诊断PTMC的补充手段但不建议常规应用;推荐等级:D
(5)强化CT/MRI对于评估转移灶较大且或怀疑有周围组织侵犯的PTMC患者有一定价值;推荐等级:B
(6)PET-CT不推荐作为PTMC的常规检查;推荐等级:E
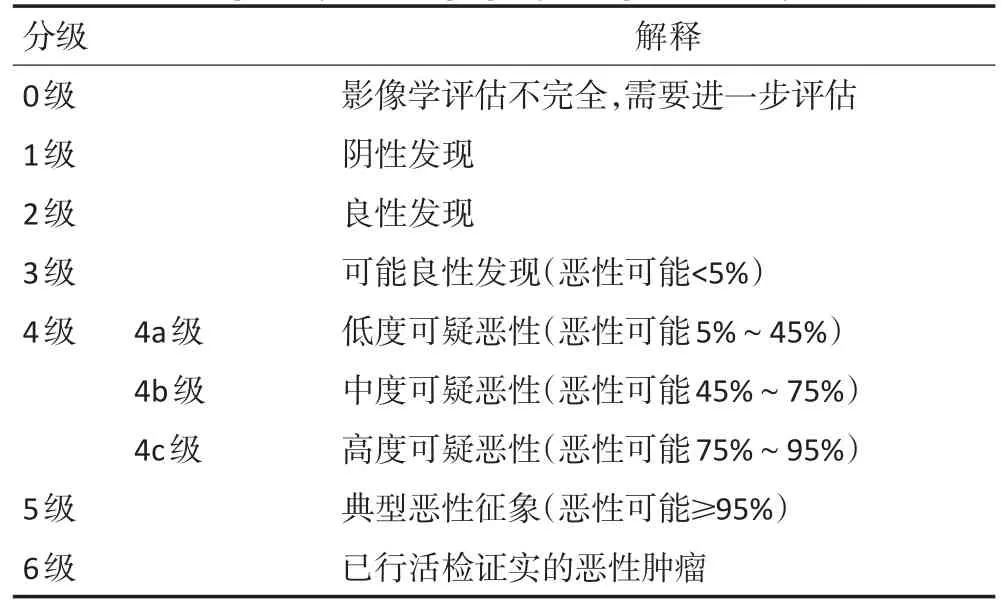
表3 甲状腺影像报告和数据系统分级(TI-RADS)Table 3 Grading of thyroid imaging-reporting and data system(TI-RADS)
3 PTMC的病理诊断
1)PTMC的细胞学诊断:目前对于PTMC行穿刺活检的直径标准并未统一。根据国内外研究显示,直径≥5 mm的PTMC可进行FNAB,建议在超声引导下行细针穿刺活检,无影像学引导的盲穿准确率低。FNAB的细胞学诊断报告多采用Bethesda诊断系统,该系统共分为6类:①不能诊断或标本不满意;②良性;③意义不明确的细胞非典型病变或意义不明确的滤泡性病变;④滤泡性肿瘤或怀疑滤泡性肿瘤;⑤可疑恶性;⑥恶性。一次穿刺活检未能明确诊断的BethesdaⅠ类及Ⅲ、Ⅳ类患者必要时可于3个月后重复穿刺活检。
2)PTMC的分子病理诊断:辅助分子标志物的检测可使PTMC术前诊断准确率得到进一步的提高。推荐FNAB细胞学结果不确定的患者可以联合检测分子标志物(如BRAF、RAS、TERT、RET/PTC、Pax8-PPAR及Galectin-3)。有研究已经证实了手术前BRAF检测对手术方案具有指导意义,并对复发、随访有一定的临床价值。
在评估PTMC患者可疑颈部淋巴结时,可选择性将FNA穿刺针洗脱液Tg检测(FNA-Tg)作为辅助诊断方法。
3)PTMC的病理诊断:与甲状腺乳头状癌相同,PTMC亦可依据形态学表现分为诸多亚型,主要包括:滤泡亚型、实性亚型、包膜内亚型、弥漫硬化亚型、高细胞亚型、柱状细胞亚型及嗜酸细胞亚型等。其中PTMC最常见的亚型为:包膜内亚型、滤泡亚型、柱状细胞亚型、嗜酸细胞亚型及弥漫硬化亚型等。免疫组织化学染色对于PTMC的诊断具有一定的辅助作用,细胞角蛋白(CK)、甲状腺球蛋白(Tg)和甲状腺转录因子-1(TTF-1)呈免疫阳性反应。CK19、Galectin-3和HBME-1在PTMC中亦有较高的表达率。
专家推荐:
(7)直径≥5mm的PTMC可行FNAB,并建议应用Bethesda诊断系统进行分类;推荐等级:B
(8)辅助分子标志物检测可使PTMC术前诊断的准确率得到进一步的提高;推荐等级:C
(9)在评估患者可疑颈部淋巴结时,FNA穿刺针洗脱液Tg检测可作为辅助诊断方法但不常规推荐;推荐等级:I
(10)建议PTMC病理诊断时进行亚型分类;推荐等级:C
4 PTMC的外科处理
目前,关于PTMC的治疗方案仍然不统一,国内外争议的焦点主要是PTMC手术的必要性和手术范围。有文献报道虽然PTMC预后良好,但并非均倾向于不进展的亚临床状态,任何晚期PTC均由PTMC进展而来。且部分PTMC可合并高侵袭性组织学变型,甚至早期就出现局部侵犯或淋巴结及远处转移。同时因为PTMC的总体治疗效果较好,多数患者经过外科治疗即可根治,所以更应该积极手术治疗,并注重手术的彻底性和规范性,这样可以有效降低复发率和转移率。也有文献报道部分PTMC处于亚临床状态,很少发展成为具有临床意义的甲状腺癌,有些患者甚至终生无症状,即使有些病例出现临床症状或颈部淋巴结转移,但对生存率影响不大,提出对于无转移、无症状的PTMC可不给予任何治疗,密切观察即可。本共识专家认为PTMC是否需要手术治疗应该综合危险评估、超声二维成像特征、肿瘤的组织学特性(浸润性、多灶性、淋巴结转移等),并适当考虑患者的愿意及依从性等方面而决定。
对于需要外科手术的PTMC,主要的争议在于原发灶和颈部淋巴结的处理范围等方面。本共识专家认为原发灶的术式应该在腺叶+峡叶切除和全/近全甲状腺切除术中合理选择,继发灶(颈部淋巴结)的清除范围也应遵循个体化治疗原则,一般建议行中央区淋巴结清除,侧颈淋巴结处理建议在选择性颈淋巴结清扫术式中合理选定。
1)PTMC手术亦或观察:对于采取积极治疗的PTMC患者,手术切除是首选的治疗方式。本共识专家认为肿瘤的大小并非评判肿瘤侵袭和转移的唯一指标,临床常见PTMC侵出被膜或侵犯周围重要组织,也可出现中央区甚至颈侧区淋巴结转移。因此,目前对于有符合下列任一条高危因素的PTMC患者均建议行手术治疗(PTMC手术治疗的适应证):①青少年或童年时期颈部放射暴露史;②甲状腺癌家族史;③已确定或高度怀疑颈淋巴结转移甚至远处转移;④癌灶有腺外侵犯(如侵犯喉返神经、气管、食管等);⑤病理学高危亚型(高细胞亚型、柱状细胞亚型、弥漫硬化型、实体/岛状型、嗜酸细胞亚型);⑥穿刺标本检测BRAF基因突变阳性;⑦癌灶短期内进行性增大(6个月内直径增大超过3 mm)。
本共识专家建议PTMC手术治疗的相对适应证包括:①癌灶直径≥6 mm;②多灶癌,尤其双侧癌;③患者心理负担大,要求手术;④TSH水平持续高于正常。
对于腺内型PTMC(尤其直径≤5 mm)是否可以采用密切观察的方式,目前争论较多。在未完全了解PTMC的临床生物学行为之前,应结合临床分期、危险评估综合分析,并与患者及家属充分沟通后决定。PTMC有以下情况也可以考虑密切观察:①非病理学高危亚型;②肿瘤直径≤5 mm;③肿瘤不靠近甲状腺被膜且无周围组织侵犯;④无淋巴结或远处转移证据;⑤无甲状腺癌家族史;⑥无青少年或童年时期颈部放射暴露史;⑦患者心理压力不大、能积极配合。满足以上全部条件的患者可建议密切观察(同时具备①~⑥属于低危PTMC)。初始观察周期可设为3~6个月,后根据病情进行调整,如病情稳定可适当延长,患者应签署知情同意书并最好有统一规范的观察记录。密切观察过程中出现下列情况应考虑手术治疗:①肿瘤直径增大超过3 mm;②发现临床淋巴结转移;③患者改变意愿,要求手术。
专家推荐:
(11)对于具有高危因素的PTMC患者,建议外科手术治疗;推荐等级:B
(12)对于低危因素的PTMC患者,严格选择指征并充分结合患者意愿,可考虑密切观察随访;推荐等级:C
(13)临床观察的PTMC应有严格的观察时限与记录,复查首选高分辨率超声影像检查;推荐等级:B
2)原发灶的切除范围:对于PTMC临床上多采用一侧腺叶+峡叶切除的手术方式,不宜强调全甲状腺切除,因为大多数PTMC为早期病变,全甲状腺切除可能会对许多患者造成不必要的治疗过度,建议根据临床分期、危险评估及各种术式的利弊,同时一定程度上结合部分患者的意愿,细化外科处理原则,制定个体化治疗方案。本共识专家建议PTMC行甲状腺腺叶+峡叶切除的适应证包括:①局限于一侧腺叶内的单发PTMC;②复发危险度低;③无青少年或童年时期颈部放射暴露史;④无甲状腺癌家族史;⑤无颈淋巴结转移和远处转移;⑥对侧腺叶内无结节。
部分PTMC需行全/近全甲状腺切除术,全/近全甲状腺切除术具有以下优点:①最大限度地保证原发灶切除的彻底性;②利于术后放射性碘(131I)治疗;③利于术后监测肿瘤的复发和转移;④可以切除隐匿病灶。本共识专家建议PTMC行全/近全甲状腺切除术的适应证包括:①青少年或童年时期颈部放射暴露史;②甲状腺癌家族史;③多灶癌,尤其是双侧癌;④双侧颈淋巴结转移或远处转移;⑤癌灶有腺外侵犯,不能保证手术能彻底切除,术后需行131I治疗。
本共识专家建议PTMC行全/近全甲状腺切除术的相对适应证包括:①同侧颈淋巴结转移;②伴有甲状腺癌复发高危因素;③合并对侧甲状腺结节;④病理学高危亚型(高细胞亚型、柱状细胞亚型、弥漫硬化型、实体/岛状型、嗜酸细胞亚型)。
本共识专家建议外科医生应参加专业培训、规范手术方式、掌握手术技巧,在行PTMC手术时,应熟悉喉返神经及喉上神经的解剖及保护,重视甲状旁腺的识别和原位血管化功能保留,以减少术后并发症的发生。
专家推荐:
(14)PTMC术式应根据病灶临床特性及危险评估合理选用甲状腺腺叶+峡叶切除或全/近全甲状腺切除术;推荐等级:A
(15)PTMC手术时应重视喉返神经、甲状旁腺及喉上神经的保护;推荐等级:A
3)颈部淋巴结清扫术:颈部淋巴结转移是PTMC患者复发率增高的危险因素,文献报道影响PTMC颈部淋巴结转移的因素较多,包括年龄、肿瘤直径、甲状腺被膜侵犯等。部分PTMC患者诊断时即存在颈部淋巴结转移,还有相当部分cN0期患者术后发现隐匿性颈淋巴结转移,而中央区淋巴结是PTMC最常见的转移部位。本共识专家建议应该结合术前及术中的危险评估,在有技术保障的情况下,原发灶手术同时行预防性中央区淋巴结清扫,要求手术医师熟练掌握喉返神经以及甲状旁腺的显露及保留技巧,这是减少中央区淋巴结清扫术后并发症的关键。同时建议在行中央区淋巴结清扫时注意左右侧解剖结构的区别,右侧喉返神经深面的区域清扫时不应遗漏。
颈侧区淋巴结一般不建议进行预防性清扫,PTMC颈侧区清扫的适应证为术前或术中证实有颈侧区淋巴结转移。相对适应证包括:①中央区转移淋巴结有结外侵犯或淋巴结转移数≥3枚;②癌灶位于甲状腺上极且存在被膜侵犯者。
专家推荐:
(16)cN+期的PTMC患者应常规行相应区域的淋巴结清扫;推荐等级:A
(17)对于cN0期的PTMC患者,建议在有技术保障的条件下行预防性中央区淋巴结清扫;推荐等级:B
(18)PTMC患者不建议行预防性颈侧区淋巴结清扫;推荐等级:E
5 PTMC的放射性碘治疗
大多数PTMC不需要后续的131I清除手术后残留的甲状腺组织(简称131I清甲)。因此不建议将131I清甲作为PTMC术后的常规处理手段。不过,根据长期的临床实践以及国内外的相关研究报道显示,有些PTMC可有不同程度的颈淋巴转移,个别病例甚至存在远处转移。对合并有转移(尤其远处转移)的PTMC患者,131I治疗有助于消除手术残留的病灶或不能通过手术切除的转移灶,有助于缓解病情并减低PTMC复发的风险。PTMC术后(全/近全甲状腺切除术)131I清甲的适应证包括:①检查明确有远处转移灶;②肿瘤未能完整切除、术中有残留;③仍存在不易解释的异常血清Tg持续升高。针对PTMC合并转移的患者,如需实施131I治疗,其方法学、治疗过程中的相关注意事项以及131I治疗后的长期TSH抑制治疗及随访观察等,与PTC的131I治疗通则基本一致。
专家推荐:
(19)不建议将131I清甲作为PTMC术后的常规处理手段;推荐等级:E
(20)PTMC术后131I治疗应根据病情选择性应用;推荐等级:B
(21)PTMC131I治疗的剂量及相关注意事项与DTC基本一致。推荐等级:A
6 PTMC的术后抑制治疗和随访
1)PTMC的TSH抑制治疗:总体而言,PTMC术后TSH抑制治疗的原理、用药、控制目标和不良反应,均与非微小PTC的TSH抑制治疗相同,可参照2012版中国《甲状腺结节和分化型甲状腺癌诊治指南》。因为PTMC不完全等同于低危DTC,故术后治疗也需根据复发风险度进行分层管理。根据近年的研究结果,TSH抑制治疗的策略出现了下述变化趋势:①根据患者的双风险-肿瘤复发风险和抑制治疗不良反应风险评估结果,制订TSH抑制治疗目标;②对低危PTMC患者而言,与TSH轻度抑制(0.1~0.5 mU/L)相比,激进的TSH抑制治疗目标(<0.1 mU/L)无更多获益;③部分低危PTMC患者经过手术治疗后,如Tg水平低至检测不到且TgAb(抗甲状腺球蛋白抗体)阴性,相关影像学检查未见明确的复发或转移病灶等情况,则其TSH抑制的目标值可设定为0.5~2.0 mU/L;④抑制治疗的TSH目标并非从一而终,宜通过动态评估患者对治疗的反应进行调整。
专家推荐:
(22)PTMC术后仍需要TSH抑制治疗,应根据PTMC患者的肿瘤复发危险度和TSH抑制治疗的副作用风险实施个体化治疗;推荐等级:B
2)PTMC的随访:对PTMC患者应进行长期随访。根据PTMC手术与否,随访的目标和内容有所不同。针对选择严密观察的PTMC患者,随访的目的在于确定是否发生肿瘤进展,是否需要及时行手术治疗。高分辨率超声影像检查是常用的监测手段,但目前监测的频度尚无定论,初始观察周期可设为3~6个月,后根据病情进行调整,如病情稳定可适当延长(如2~3年后改为6~12个月复查)。针对手术治疗后的PTMC患者,长期随访的目的为:①早期发现肿瘤复发和转移,动态观察病情的进展和治疗效果,调整治疗方案;②监控TSH抑制治疗的效果和不良反应,对某些伴发疾病(如心脏疾病、其他恶性肿瘤等)病情进行动态观察。
专家推荐:
(23)PTMC患者无论手术与否均应进行长期随访;推荐等级:A
7 展望
1)需要发现更多分子标志物用于诊断、预后评估以及治疗靶点:随着基础医学研究的不断进展,越来越多的分子标志物被应用于甲状腺癌的诊断、预后评估及治疗靶点中。美国学者已经组建Cancer Genome Atlas Research Network并针对甲状腺乳头状癌进行了基因分析。BRAF、TERT、TP53等基因突变的检测有助于进一步对甲状腺乳头状癌进行风险分层。我们希望发现更多的分子标志物并转化于PTMC的诊治,从而进一步细化PTMC的风险分层、预后预测及治疗靶点等问题。
2)期待更多PTMC患者的前瞻性多中心临床研究:国外学者对于PTMC患者的非手术观察性研究为PTMC的治疗决策提供了重要参考资料,但目前仍存在较多问题,如患者选择的非随机性、PTMC的观察指标、随访的科学性、TSH控制目标等。期待更多有价值的前瞻性临床研究的出现,全国多中心的大数据临床试验可能会为研究PTMC的生物学特性提供更准确、更有力的依据。
3)对于消融技术治疗PTMC的评价:由于消融技术(射频、微波等)属于局部治疗,不能保证PTMC治疗的彻底性且不符合最小治疗单位为侧叶的原则,属复发高危;同时即便是临床cN0期的PTMC也存在一部分隐匿性的颈淋巴结转移,但消融技术不能解决;且经消融治疗后的病灶再行手术的难度增大,故目前不推荐将消融技术作为治疗PTMC的常规手段。未来对于消融技术是否能在严格选择腺内型病例、患者充分知情、并在有资质专业人员规范操作下治疗PTMC还有待更多的科学观察。
参加共识撰写的专家:
编写组组长:
高明(天津医科大学肿瘤医院)
副组长:
葛明华(浙江省肿瘤医院)
嵇庆海(复旦大学附属肿瘤医院)
徐震纲(中国医学科学院肿瘤医院)
陆汉魁(上海交通大学附属第六人民医院)
程若川(昆明医科大学附属第一医院)
关海霞(中国医科大学附属第一医院)
编写组成员:(按姓名首字母顺序排列)
高力(浙江大学医学院附属邵逸夫医院)
郭朱明(中山大学肿瘤医院)
黄韬(华中科技大学同济医学院附属协和医院)
黄晓明(中山大学孙逸仙纪念医院)
李晓明(白求恩国际和平医院)
林岩松(北京协和医院)
刘勤江(甘肃省肿瘤医院)
倪鑫(首都医科大学附属北京儿童医院)
潘毅(天津医科大学肿瘤医院)
秦建武(河南省肿瘤医院)
单忠艳(中国医科大学附属第一医院)
孙辉(吉林大学中日联谊医院)
王旭东(天津医科大学肿瘤医院)
于洋(天津医科大学肿瘤医院)
赵代伟(贵阳医学院第二附属医院)
张乃嵩(北京大学肿瘤医院)
张晟(天津医科大学肿瘤医院)
郑颖(吉林省肿瘤医院)
朱精强(四川大学华西医院)
编写组秘书:
郑向前(天津医科大学肿瘤医院)
李大鹏(天津医科大学肿瘤医院)
参考文献
[1]American Thyroid Association(ATA)Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer,Cooper DS,Doherty GM,et al.Revised American thyroid association management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J].Thyroid,2009,19(11):1167-1214.
[2]Haugen BR,Alexander EK,Bible KC,et al.2015 American thyroid association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer:the American thyroid association guidelines task force on thyroid nodules and differentiated thyroid cancer[J].Thyroid,2016,26(1):1-133.
[3]Tuttle RM,Haddad RI,Ball DW,et al.Thyroid carcinoma,version 2.2014[J].J Natl Compr Canc Netw,2014,12(12):1671-1680.
[4]Chinese Society of Endocrinology,Chinese Society of Surgery endocrinology team,Chinese anti-cancer association head and neck tumor professional committee,et al.Clinical management guidlines for throid nodules and differentiated thyroid carcinoma[J].Chinese Journal of Neuclear Medicine and Molecular Imaging,2013,33(2):96-115.[中华医学会内分泌学分会,中华医学会外科学分会内分泌学组,中国抗癌协会头颈肿瘤专业委员会,等.甲状腺结节和分化型甲状腺癌诊治指南[J].中华核医学与分子影像杂志,2013,33 (2):96-115.]
[5]Liu YQ,Zhang SQ,Chen WQ,et al.Trend of incidence and mortality on thyroid cancer in China during 2003-2007[J].Chinese Journal of Epidemiology,2012,33(10):1044-1048.[刘玉琴,张书全,陈万青,等.中国2003-2007年甲状腺癌发病死亡现状及流行趋势分析[J].中华流行病学杂志,2012,33(10):1044-1048.]
[6]Chen WQ,Zhang SW,Zheng RS,et al.Report of cancer incidence and mortality in China,2009[J].China Cancer,2013,22(1):2-12.[陈万青,张思维,郑荣寿,等.中国2009年恶性肿瘤发病和死亡分析[J].中国肿瘤,2013,22(1):2-12.]
[7]Xing MZ.Molecular pathogenesis and mechanisms of thyroid cancer[J].Nat Rev Cancer,2013,13(3):184-199.
[8]De Biase D,Gandolfi G,Ragazzi M,et al.TERT promoter mutations in papillary thyroid microcarcinomas[J].Thyroid,2015,25(9):1013-1019.
[9]Ito Y,Miyauchi A,Inoue H,et al.An observational trial for papillary thyroid microcarcinoma in Japanese patients[J].World J Surg,2010,34(1):28-35.
[10]Ito Y,Uruno T,Nakano K,et al.An observation trial without surgical treatment in patients with papillary microcarcinoma of the thyroid [J].Thyroid,2003,13(4):381-387.
[11]Xing M,Alzahrani AS,Carson KA,et al.Association between BRAF V600E mutation and recurrence of papillary thyroid cancer[J].J Clin Oncol,2015,33(1):42-50.
[12]Jiang LH,Chen C,Tan Z,et al.Clinical characteristics related to central lymph node metastasis in cN0 papillary thyroid carcinoma:a retrospective study of 916 patients[J].Int J Endocrinol,2014,2014:385787.
[13]Ito Y,Fukushima M,Higashiyama T,et al.Tumor size is the strongest predictor of microscopic lymph node metastasis and lymph node recurrence of N0 papillary thyroid carcinoma[J].Endocr J,2013,60 (1):113-117.
[14]Glenn JA,Yen TW,Fareau GG,et al.Institutional experience with lateral neck dissections for thyroid cancer[J].Surgery,2015,158(4):972-978.
[15]Zheng X,Wei S,Han Y,et al.Papillary microcarcinoma of the thyroid:clinical characteristics and BRAF(V600E)mutational status of 977 cases[J].Ann Surg Oncol,2013,20(7):2266-2273.
[16]Zhang L,Wei WJ,Ji QH,et al.Risk factors for neck nodal metastasis in papillary thyroid microcarcinoma:a study of 1066 patients[J].J Clin Endocrinol Metab,2012,97(4):1250-1257.
[17]Soares P,Celestino R,Gaspar Da Rocha A,et al.Papillary thyroid microcarcinoma:how to diagnose and manage this epidemic[J]?Int J Surg Pathol,2014,22(2):113-119.
[18]Peng C,Wei SF,Zheng XQ,et al.Clinicopathological features and risk factors for central compartment nodal metastasis in papillary thyroid microcarcinoma:a study of 1 401 patients[J].Chinese Journal of Clinical Oncology,2016,43(3):95-99.[彭琛,魏松锋,郑向前,等.1401例甲状腺微小乳头状癌临床病理特征及中央区淋巴结转移危险因素分析[J].中国肿瘤临床,2016,43(3):95-99.]
[19]Torre LA,Siegel RL,Ward EM,et al.Global cancer incidence and mortality rates and Trends-An update[J].Cancer Epidemiol Biomarkers Prev,2016,25(1):16-27.
[20]Howlader N,Noone AM,Krapcho M,et al.2015 SEER Cancer Statistics Review 1975-2012[DB/OL]Bethesda,MD:National Cancer Institute.
[21]Yu Y,Dong L,Li D,et al.Targeted DNA sequencing detects mutations related to susceptibility among familial non-medullary thyroid cancer[J].Sci Rep,2015,5:16129.
[22]Li D,Gao M,Li X,et al.Molecular aberrance in papillary thyroid microcarcinoma bearing high aggressiveness:identifying a "tibetan mastiff dog" frompuppies[J].J Cell Biochem,2016,117(7):1491-1496.
[23]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[24]Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
[25]Leenhardt L,Erdogan MF,Hegedus L,et al.2013 European thyroid association guidelines for cervical ultrasound scan and ultrasoundguided techniques in the postoperative management of patients with thyroid cancer[J].Eur Thyroid J,2013,2(3):147-159.
[26]Moses W,Weng J,Kebebew E.Prevalence,clinicopathologic features,and somatic genetic mutation profile in familial versus sporadic nonmedullary thyroid cancer[J].Thyroid,2011,21(4):367-371.
[27]Moon HJ,Sung JM,Kim EK,et al.Diagnostic performance of grayscale US and elastography in solid thyroid nodules[J].Radiology,2012,262(3):1002-1013.
[28]Horvath E,Majlis S,Rossi R,et al.An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management[J].J Clin Endocrinol Metab,2009,94(5):1748-1751.
[29]Russ G,Royer B,Bigorgne C,et al.Prospective evaluation of thyroid imaging reporting and data system on 4550 nodules with and without elastography[J].Eur J Endocrinol,2013,168(5):649-655.
[30]Crippa S,Mazzucchelli L,Cibas ES,et al.The bethesda system for reporting thyroid fine-needle aspiration specimens[J].Am J Clin Pathol,2010,134(2):343-344.
[31]Bongiovanni M,Spitale A,Faquin WC,et al.The bethesda system for reporting thyroid cytopathology:a meta-analysis[J].Acta Cytol,2012,56(4):333-339.
[32]Wu HH,Rose C,Elsheikh TM.The bethesda system for reportingthyroid cytopathology:an experience of 1,382 cases in a community practice setting with the implication for risk of neoplasm and risk of malignancy[J].Diagn Cytopathol,2012,40(5):399-403.
[33]Hay ID,Hutchinson ME,Gonzalez-Losada T,et al.Papillary thyroid microcarcinoma:a study of 900 cases observed in a 60-year period [J].Surgery,2008,144(6):980-987.
[34]Niemeier LA,Kuffner Akatsu H,Song C,et al.A combined molecularpathologic score improves risk stratification of thyroid papillary microcarcinoma[J].Cancer,2012,118(8):2069-2077.
[35]Xing M,Liu R,Liu X,et al.BRAF V600E and TERT promoter mutations cooperatively identify the most aggressive papillary thyroid cancer with highest recurrence[J].J Clin Oncol,2014,32(25):2718-2726.
[36]Nikiforov YE,Steward DL,Robinson-Smith TM,et al.Molecular testing for mutations in improving the Fine-Needle aspiration diagnosis of thyroid nodules[J].J Clin Endocrinol Metab,2009,94(6):2092-2098.
[37]Kim E,Park JS,Son KR,et al.Preoperative diagnosis of cervical metastatic lymph nodes in papillary thyroid carcinoma:comparison of ultrasound,computed tomography,and combined ultrasound with computed tomography[J].Thyroid,2008,18(4):411-418.
[38]Adam MA,Pura J,Gu L,et al.Extent of surgery for papillary thyroid cancer is not associated with survival:an analysis of 61,775 patients[J].Ann Surg,2014,260(4):601-605.
[39]Randolph GW,Duh QY,Heller KS,et al.The prognostic significance of nodal metastases from papillary thyroid carcinoma can be stratified based on the size and number of metastatic lymph nodes,as well as the presence of extranodal extension[J].Thyroid,2012,22 (11):1144-1152.
[40]Adam MA,Pura J,Goffredo P,et al.Presence and number of lymph node metastases are associated with compromised survival for patients younger than age 45 years with papillary thyroid cancer[J].J Clin Oncol,2015,33(21):2370-2375.
[41]Raffaelli M,De Crea C,Sessa L,et al.Prospective evaluation of total thyroidectomy versus ipsilateral versus bilateral central neck dissection in patients with clinically node-negative papillary thyroid carcinoma[J].Surgery,2012,152(6):957-964.
[42]Barbesino G,Goldfarb M,Parangi S,et al.Thyroid lobe ablation with radioactive Iodine as an alternative to completion thyroidectomy after hemithyroidectomy in patients with follicular thyroid carcinoma:long-term follow-up[J].Thyroid,2012,22(4):369-376.
[43]Nascimento C,Borget I,Al Ghuzlan A,et al.Persistent disease and recurrence in differentiated thyroid cancer patients with undetectable postoperative stimulated thyroglobulin level[J].Endocr Relat Cancer,2011,18(2):R29-R40.
[44]Al-Saif O,Farrar WB,Bloomston M,et al.Long-term efficacy of lymph node reoperation for persistent papillary thyroid cancer[J].J Clin Endocrinol Metab,2010,95(5):2187-2194.
[45]Lamartina L,Durante C,Filetti S,et al.Low-risk differentiated thyroid cancer and radioiodine remnant ablation:a systematic review of the literature[J].J Clin Endocrinol Metab,2015,100(5):1748-1761.
[46]Han JM,Kim WG,Kim TY,et al.Effects of low-dose and high-dose postoperative radioiodine therapy on the clinical outcome in patients with small differentiated thyroid cancer having microscopic extrathyroidal extension[J].Thyroid,2014,24(5):820-825.
[47]Sugitani I,Fujimoto Y.Does postoperative thyrotropin suppression therapy truly decrease recurrence in papillary thyroid carcinoma?A randomized controlled trial[J].J Clin Endocrinol Metab,2010,95 (10):4576-4583.
[48]Goetz MP,Callstrom MR,Charboneau JW,et al.Percutaneous image-guided radiofrequency ablation of painful metastases involving bone:a multicenter study[J].J Clin Oncol,2004,22(2):300-306.
[49]Ito Y,Tomoda C,Uruno T,et al.Clinical significance of metastasis to the central compartment from papillary microcarcinoma of the thyroid[J].World J Surg,2006,30(1):91-99.
[50]Haymart MR,Banerjee M,Stewart AK,et al.Use of radioactive Iodine for thyroid cancer[J].JAMA,2011,306(7):721-728.
[51]Untch BR,Palmer FL,Ganly I,et al.Oncologic outcomes after completion thyroidectomy for patients with well-differentiated thyroid carcinoma[J].Ann Surg Oncol,2014,21(4):1374-1378.
(2016-04-02收稿)
(2016-04-20修回)
(编辑:郑莉校对:邢颖)
·专家论坛·

张频教授 主任医师、硕士研究生导师。担任北京乳腺病防治学会内科专业委员会副主任委员,中国老年学会老年肿瘤专业委员会乳腺癌分会副主任委员,中国女医师协会临床肿瘤学专家委员会常委,中国医师协会乳腺疾病培训专家委员会常委。主要从事乳腺癌的药物治疗、综合治疗及抗肿瘤新药临床研究。参与《临床肿瘤学》、《乳腺癌》、《实用肿瘤内科治疗》等多部肿瘤学专著及《临床肿瘤内科手册》编写。
