贺兰山东麓荒漠微生物结皮发育过程研究
2016-06-05陈青赵辉徐春燕苏建宇
陈青, 赵辉, 徐春燕, 苏建宇
宁夏大学生命科学学院, 西部特色生物资源保护与利用教育部重点实验室, 银川 750021
贺兰山东麓荒漠微生物结皮发育过程研究
陈青, 赵辉, 徐春燕, 苏建宇*
宁夏大学生命科学学院, 西部特色生物资源保护与利用教育部重点实验室, 银川 750021
陈青, 赵辉, 徐春燕, 等. 贺兰山东麓荒漠微生物结皮发育过程研究[J]. 生态科学, 2016, 35(2): 8-12.
CHEN Qing, ZHAO Hui, XU Chunyan, et al. Development of desertification microbial crust in east side of Helan Mountain[J]. Ecological Science, 2016, 35(2): 8-12.
通过测定采集于贺兰山东麓微生物结皮样品的厚度、微生物生物量和叶绿素a含量、有机质含量、全氮含量、持水性和渗水性等指标, 并对测定结果进行统计分析, 对不同发育程度的微生物结皮样品进行归类, 阐明荒漠微生物结皮的“个体发育”过程。结果表明, 微生物结皮厚度与结皮层微生物量和叶绿素 a含量呈显著正相关; 随着微生物结皮的发育, 结皮层土壤有机质含量、全氮含量及持水量增加, 水分入渗速率减小; 微生物结皮发育具有较明显的阶段性, 可将其发育过程划分为形成期、初期、中期和成熟期4个阶段。
微生物结皮; 荒漠化; 贺兰山东麓
1 前言
土壤生物结皮的形成是荒漠化土壤生态改良过程中的重要环节。生物结皮的形成使荒漠化土壤表面结构和理化性质发生明显的改变, 一方面可以稳定表土、固定流沙, 提高土壤的抗侵蚀能力, 另一方面, 可以改良土壤结构、提高土壤肥力、增加土表湿度, 具有遏制土壤荒漠化以及促进荒漠地区生态系统恢复的重要作用[1-4]。生物结皮的相关研究成果为荒漠化地区的生态修复提供了一条新的途径[5-6]。
目前对于生物结皮的发育过程多为根据结皮中优势生物类群, 将生物结皮划分成为微生物结皮(藻结皮)、地衣结皮和苔藓结皮三个不同阶段, 或根据生物结皮生长地植被生长年限等对生物结皮发育程度进行界定, 而基于生物结皮自身性质和特征的生物结皮发育过程的研究尚较为缺乏。因此, 有必要依据一些与生物结皮发育过程密切相关、并在发育过程中具有特征性变化规律的结皮形态和理化指标,对生物结皮的发育过程进行综合性描述, 以明晰荒漠化土壤中生物结皮的发育规律。本文以生物结皮发育的初始阶段-微生物结皮为研究对象, 建立微生物结皮发育过程描述和发育阶段判断的依据标准,以期从“个体发育”的角度, 对荒漠化土壤中微生物结皮的发育规律进行研究和探讨。
2 材料与方法
2.1 研究区概况
贺兰山位于北纬38°21′—39°22′, 东经105°49′—106°42′, 海拔1100 m—3565 m, 是我国西北干旱地区著名山地之一。贺兰山东麓处于银川平原西部边缘, 为海拔1500 m以下的低山丘陵及洪积扇, 平均海拔1230 m。贺兰山东麓为典型大陆性气候, 年平均温度8.5 ℃, 1月份平均气温~8.4 ℃, 7月份平均气温23.1 ℃。年均降雨量200 mm左右, 年均蒸发量1800 mm左右, 土壤贫瘠, 为荒漠草原生境。
2.2 样品采集与预处理
样品采集于贺兰山东麓拜寺口至苏峪口自然保护区荒漠草原地区。选择3个相距约1km的采样区(38°40′N, 105°58′E; 38°41′N, 105°58′E; 38°42′N, 105°59′E),每个采样区选取无植被覆盖的裸露地表随机采集约10 cm×10 cm大小的微生物结皮样品60份连同结皮下层约 1 cm的土层一起铲下置于无菌样品袋中带回实验室。实验室中将样品及其连带土置于垫有滤纸的瓷盘中, 向盘中加水至没过结皮样品, 24 h后铲下结皮层, 得到供试结皮样品。
2.3 测定方法
2.3.1 结皮层厚度测定
数显游标卡尺(精度 0.02 mm)测量结皮层厚度,测定结果以毫米为单位, 保留一位小数。
2.3.2 结皮叶绿素a含量测定
采用丙酮萃取分光光度法测定叶绿素a的含量[7]。以样品663 nm下吸光度值(A663)表示叶绿素a含量。
结皮微生物生物量测定: 总核酸法测定微生物生物量[8]。以260 nm下吸光度值(A260)表示微生物生物量。2.3.3 结皮持水性测定
以结皮持水量反映结皮持水性。切取约2 cm×2 cm室温自然干燥的结皮样品, 置于垫有 2层滤纸的120 mm培养皿中, 向培养皿中滴加蒸馏水至滤纸完全吸水, 盖上皿盖, 放置24 h, 其间视滤纸水分含量变化进行补水, 使之保持完全吸水状态。取结皮样品置于已知重量的铝盒中称重, 得到最大持水量时的结皮质量W1, 然后将铝盒置于烘箱中105 ℃烘干至恒重, 得到结皮干重W2。

2.3.4 结皮渗水性测定
以结皮水分入渗速率反映结皮渗水性。切取约2 cm×2 cm结皮样品, 在结皮表面滴50 μL蒸馏水,开始计时至水分全部渗入结皮结束, 得时间t。结皮水分入渗速率(μL·s-1)=50 μL/t。
2.3.5 结皮有机质、全氮含量测定
按照土壤生态学实验方法[9]测定结皮层有机质和全氮含量。
2.4 统计分析
采用 SPSS19.0进行统计分析。使用邓肯氏新复极差测验(Duncan's Multiple Range Test)进行各组样品间差异显著性检验。
3 结果
3.1 不同厚度微生物结皮样品数量统计结果
供试的 180个微生物结皮样品, 其结皮层厚度分布为0.2 mm—1.8 mm。以0.1 mm为划分区间, 不同厚度结皮样品数量分布如图1所示。结果表明, 荒漠微生物结皮厚度主要分布在0.3—1.4 mm范围内,厚度为0.3 mm以下和1.4 mm以上的微生物结皮在采样地仅零星存在。将厚度为0.3 mm及以下的结皮样品分为一组, 厚度为 0.4—1.3 mm的结皮样品按0.1 mm的划分区间分成10组, 厚度1.4 mm及以上的结皮样品分为一组, 根据结皮厚度将微生物结皮样品共分为12组, 进行后续研究。
3.2 微生物结皮发育阶段的初步划分
3.2.1 不同厚度微生物结皮叶绿素a含量和微生物生物量
叶绿素a的含量可以反映微生物结皮中微藻的生物量。12组不同厚度微生物结皮样品中叶绿素a含量和微生物生物量测定结果如图2和图3 所示。结果表明, 随着结皮厚度的增加, 结皮中叶绿素a的含量(A663)和微生物生物量(A260)均显著增加, 且微生物结皮层厚度、微生物生物量和叶绿素a的含量之间有极显著的相关性(表1)。

图1 不同厚度微生物结皮数量分布统计Fig. 1 Distribution statistics for different thickness of microbial crusts
3.2.2 微生物结皮发育程度的初步划分

图2 微生物结皮叶绿素a含量Fig. 2 Chlorophyll a content of microbial crusts 注: 不同小写字母表示0.05水平差异显著。

图3 微生物结皮微生物量Fig. 3 Microbial biomass of microbial crusts 注: 不同小写字母表示0.05水平差异显著。
由图2和图3可知, 12组不同厚度结皮样品中, 1、2组样品间叶绿素a含量和微生物生物量均无显著差异, 将其归并为同一发育阶段; 3组样品叶绿素a含量与1、2组样品间无显著差异, 但显著低于4组样品, 而其微生物生物量显著高于 1、2组样品,故将其单独定为一个发育阶段; 4、5、6组样品间叶绿素 a含量和微生物生物量均无显著性差异, 将其归并为同一发育阶段; 7组样品叶绿素a含量显著低于8组样品, 而微生物生物量显著高于4、5、6组样品, 故将其单独定为一个发育阶段; 8、9组样品间及10、11组样品间叶绿素a含量和微生物生物量均无显著差异, 分别归并为同一发育阶段; 12组样品叶绿素a含量与10、11组样品无显著差异, 但微生物生物量显著高于10、11组样品, 故将其单独定为一个发育阶段。
因此, 根据微生物结皮中叶绿素 a含量和微生物生物量的差异, 将12组不同厚度微生物结皮样品初步划分为7个发育阶段。合并同一发育阶段的微生物结皮样品, 进一步进行结皮理化性质的测定。

表1 微生物结皮厚度、叶绿素a含量、微生物生物量相关性分析Tab. 1 Correlation analysis of thickness, chlorophyll a content and microbial biomass of microbial crusts
3.3 微生物结皮发育阶段的进一步划分
3.3.1 结皮样品持水性和渗水性
7组不同发育阶段的微生物结皮样品的持水量和水分入渗速率测定结果如图4所示。由图可知, 第4、5、6、7组样品持水量显著高于第1、2、3组样品, 说明随着结皮层中微生物(包括微藻)的大量繁殖及胞外分泌物的产生, 使结皮层土壤的持水性显著增加; 第5、6组样品的水分入渗速率显著低于第1、2组样品, 说明随着结皮层中微生物(包括微藻)生物量的增加, 强化了对土壤颗粒的黏结作用, 导致结皮的致密性增加, 渗水性明显降低, 土壤抗侵蚀能力得以增强。

图4 微生物结皮样品持水性和渗水性Fig. 4 Water holding capacity and infiltration capacity of microbial crusts注: 不同小写字母表示0.05水平差异显著。
7组不同发育阶段的样品中, 第6组样品持水量测定值最大而水分入渗速率测定值最小。这一发育阶段的微生物结皮尽管微生物生物量低于第7组样品, 但微藻生物量最大, 说明结皮层中微藻数量是决定微生物结皮持水性和渗水性的重要因素。
3.3.2 结皮样品有机质含量和全氮含量
7组不同发育阶段的微生物结皮样品有机质和全氮含量测定结果如图5和图6所示。由图可知, 随着微生物结皮的逐步发育, 其有机质和全氮含量均随之增加, 其中第 7组样品有机质和全氮含量均显著高于其余6个发育阶段的样品。荒漠地区土壤有机质含量普遍较低, 而第 1组样品有机质含量已超过1%, 第7组样品达到1.8%以上, 说明微生物结皮的生长发育能够有效促进荒漠化土壤的改良。

图5 微生物结皮有机质含量Fig. 5 Organic content of microbial crusts注: 不同小写字母表示0.05水平差异显著。
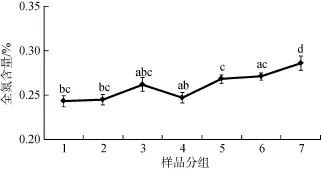
图6 微生物结皮全氮含量Fig. 6 Total nitrogen content of microbial crusts注: 不同小写字母表示0.05水平差异显著。
3.3.3 微生物结皮发育阶段划分
以上7组不同发育程度微生物结皮样品理化性质测定值间的差异显著性统计结果表明, 第1、2、3组样品间及第5、6组样品间在理化性质方面并无显著差异, 故将其分别归并为同一发育阶段。
基于以上研究结果, 以结皮层厚度、结皮微生物生物量和叶绿素 a含量及结皮理化性质为依据,将微生物结皮的发育过程划分为 4个阶段, 依次为形成期、发育初期、发育中期和成熟期。各发育阶段微生物结皮性质如表2。
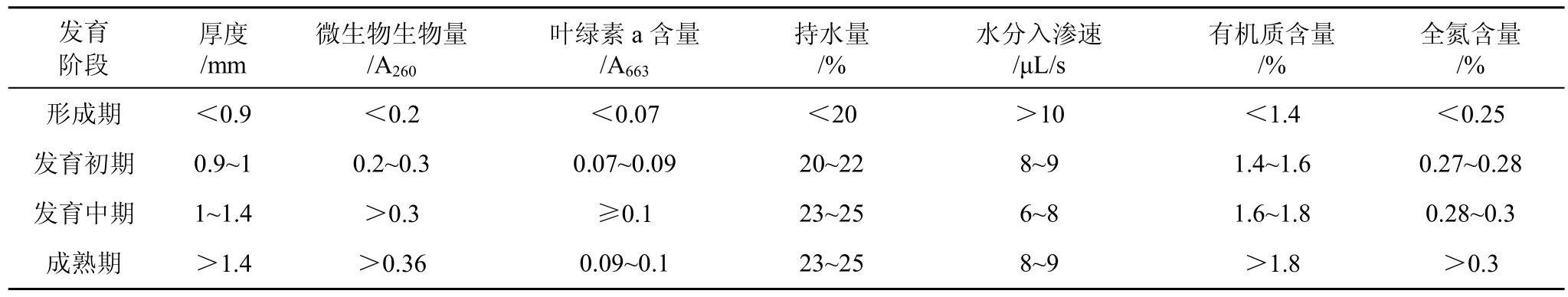
表2 不同发育阶段微生物结皮性质Tab. 2 Characters of microbial crusts at different development stages
4 讨论
微生物结皮中, 微生物的生命活动决定了结皮的形态结构及理化性质, 并因此而影响着结皮的发育进程。可以将微生物结皮看做为荒漠化土壤中一种由多种微生物构成的、具有一定形态结构及生物学功能的“复合生物有机体”, 其在发育过程中, 通过微生物的生命活动与外界环境进行着活跃的物质交换,同时其自身的形态、结构和理化性质也发生着动态演变, 结皮层厚度、微生物数量和种类组成以及结皮的理化性质反映了结皮的发育程度。刘丽燕等[10]将微生物结皮的形成过程描述为: 灰白色薄层、易破碎、抗腐蚀性差的初始阶段的结皮随着时间的推移, 结皮厚度增大, 同时一些微小生物滋生繁衍, 逐渐发育为灰黑色的微小生物聚合体; 饶本强等[11]研究发现, 荒漠土壤中藻类的生物量在受到环境影响的同时, 时间尺度对荒漠藻的次级演替也有重要影响; 张元明等[12]认为无机结皮经物理作用和土壤微生物的活动的共同作用, 演变成以藻类为优势种的生物土壤结皮; 张丙昌等[13]研究发现藻类生物量在生物结皮不同演替阶段存在极显著的差异; 陈小红等[14]认为土壤结皮的形成过程是养分和有机质不断富积的过程。
本研究首先根据结皮厚度这一生物结皮发育最直接的指标对微生物结皮样品进行分组, 然后以结皮中微藻及微生物生物量为依据, 对微生物结皮样品的发育阶段进行初步划分, 在此基础上, 通过进一步测定分析结皮样品有机质含量、全氮含量以及结皮层持水性和渗水性的差异性, 最终将微生物结皮的发育过程划分为4个阶段。
微生物结皮在发育过程中, 微藻的光合作用和固氮微生物(主要是蓝细菌)的生物固氮作用使结皮层有机质和全氮含量逐渐增加, 从而促进了结皮层中异养微生物的生长。结皮微生物的大量繁殖, 菌体自身的吸水作用加之其胞外分泌物对沙土的胶结作用, 导致结皮持水性增强, 渗水性也相应发生改变。Li等[15]研究表明, 生物结皮能够阻止水分入渗。本研究发现, 随着微生物结皮的发育, 结皮层的渗水性有所下降, 但这种渗水性的变化不像持水性那样显著, 这有利于降水时荒漠化土壤有效吸收水分,避免由于水分入渗阻力过大而形成地表径流, 造成水分利用率降低、土壤侵蚀等不良后果。
微生物结皮的发育受温度、降雨量、土壤矿物质含量、土壤pH值等诸多因素的影响, 当微生物结皮发育至成熟阶段后, 其进一步的发育取决于其所处的环境条件, 尤其是水分条件。如果长时间处于干旱、低温等环境条件, 结皮层中的微生物菌体(藻体)会逐渐解体, 与土壤胶结, 形成颜色较下层土壤深的腐殖质层, 结皮自身依然处于微生物结皮阶段; 在水分较为充足的环境条件下, 则结皮层表面可见地衣形成, 微生物结皮进一步发育为地衣结皮。胡春香等[16]研究发现, 在植被覆盖度高的人工灌溉区, 微生物结皮甚至可以跨越地衣结皮阶段, 直接发育为苔藓结皮。因此,结皮层微生物的生长繁殖、结皮层土壤养分的积累以及环境条件的变化, 决定着荒漠生物结皮的演替过程。
[1] 刘利霞, 张宇清, 吴斌. 生物结皮对荒漠地区土壤及植物的影响研究述评[J]. 中国水土保持科学, 2007, 5(6): 106–112
[2] BAMFORTH S S. Water film fauna of microbiotic crusts of a warm desert[J]. Journal of Arid Environments, 2004, 56 (3): 413–423
[3] BELNAP J, LANGER O L. Biological soil crusts : structure, function and management[M]. Springer Verlag, Berlin Heidelberg, Hardbound, 2001
[4] 吴楠, 潘伯荣, 张元明, 等. 古尔班通古特沙漠生物结皮中土壤微生物垂直分布特征[J]. 应用与环境生物学报, 2005, 11(3): 349–353
[5] 饶本强, 刘永定, 胡春香, 等. 人工藻结皮技术及其在沙漠治理中的应用[J]. 水生生物学报, 2009, 33(4): 756–761
[6] 兰书斌, 胡春香, 饶本强, 等. 人工藻结皮形成过程中表土非降雨型水分吸收的变化情况[J]. 中国科学: 生命科学, 2010, 40 (8): 751–757
[7] 李振国, 卢军, 王国祥, 等. 分光光度法测定浮游植物叶绿素a的比较研究[J]. 中国环境监测, 2006, 22(2): 21–23
[8] 李树瑞,谢幸珠,胡章助,等.复合培养基中菌体浓度的测定研究—总核酸测定法[J]. 华东理工大学学报, 1982, 8 (2): 177–187
[9] 章家恩.生态学常用实验研究方法与技术[M]. 北京, 化学工业出版社, 2006
[10] 刘丽燕, 吾尔妮莎·沙衣丁, 阿不都拉·阿巴斯.荒漠化地区生物结皮的研究进展[J]. 菌物研究, 2005, 3(4): 26–29
[11] 饶本强, 刘永定. 荒漠生态系统中的先行者-荒漠藻类[J].生物学通报, 2011, 46(5): 7–10
[12] 张元明, 王雪芹. 荒漠地表生物土壤结皮形成与演替特征概述[J]. 生态学报, 2010, 30 (16): 4484–4492
[13] 张丙昌, 张元明, 赵建成. 古尔班通古特沙漠生物结皮不同发育阶段中藻类的变化[J]. 生态学报, 2009, 29(1): 29–37
[14] 陈小红, 段争虎. 我国干旱沙漠地区不同类型土壤结皮的理化性质研究[J]. 干旱区资源与环境, 2008, 22 (9): 124–138
[15] LI X R, ZHOU H Y, WANG X R, et al. The effects of sand stabilination and revegetation on crypmgam species diversity and soil fertility in Tengger desert noritrem China[J]. Plant and Soil, 2003, 251(2): 237–245
[16] 胡春香, 张德禄, 刘永定.干旱区微小生物结皮中藻类研究的新进展[J]. 自然科学进展, 2003, 13(8): 791–795
Development of desertification microbial crust in east side of Helan Mountain
CHEN Qing, ZHAO Hui, XU Chunyan, SU Jianyu*
School of Life Science,Key Laboratory of Ministry of Education for Conservation and Utilization of Special Biological Resources in the Western,Ningxia University,Yinchuan750021,China
By analyzing thickness, microorganism biomass, chlorophyll a content, organic matter content, total nitrogen content, water holding capacity and water permeability of microbial crust samples which were collected from east side of Helan Mountain, microbial crust samples with different development degree were classified. Subsequently, “individual development”process of desertification microbial crust was clarified. Microbial crust thickness was positively correlated to microorganism biomass and chlorophyll a content of crust. Organic matter, total nitrogen content and water holding capacity of crust increased while water permeability of crust decreased with the crust development. Microbial crust developed with a significant stage characteristic. The development of microbial crust can be divided into four stages, which are formation stage, initial stage, intermediate stage and maturity stage.
microbial crusts; desertification; east side of Helan Mountain
10.14108/j.cnki.1008-8873.2016.02.002
Q89
A
1008-8873(2016)02-008-05
2015-08-04;
2015-09-22
国家自然科学基金项目(31260023)
陈青(1988—), 女, 硕士研究生, 研究方向为环境微生物, E-mail: pomoxiangyu@163.com
*通信作者:苏建宇, 男, 博士, 教授, 主要从事微生物资源开发与利用研究, E-mail: su_jy@nxu.edu.cn
