精氨酸改性壳聚糖纳米纤维膜的制备及其BSA亲和吸附性能研究
2016-06-05王良安庄旭品晁贵群徐先林
王良安,庄旭品,2,晁贵群,徐先林,2,董 锋
(1.天津工业大学,天津 300387;2.天津工业大学先进复合材料教育部重点实验室,天津 300387)
精氨酸改性壳聚糖纳米纤维膜的制备及其BSA亲和吸附性能研究
王良安1,庄旭品1,2,晁贵群1,徐先林1,2,董 锋1
(1.天津工业大学,天津 300387;2.天津工业大学先进复合材料教育部重点实验室,天津 300387)
文章通过改变反应物的摩尔比,合成不同取代度的壳聚糖精氨酸(CS-Arg)产物,应用FTIR、TG及元素分析对其结构及取代度进行表征。进一步将其和聚乳酸混合溶解,利用溶液喷射纺丝法制备CS-Arg纳米纤维(CANFs),以牛血清蛋白为模型蛋白,研究了CANFs对BSA的吸附性能,结果表明:A4(CANFs-4)亲和膜对BSA的吸附能力最好,吸附量达445.19 mg/g。
纳米纤维亲和膜;蛋白质吸附;溶液喷射纺丝;壳聚糖;精氨酸
1 引言
蛋白质是生命有机体的主要成分,其产品在医药、催化、医学诊断及疾病治疗等领域有着广泛的应用[1]。近年来,随着生命科学、药学及医疗技术的不断发展,对蛋白质、酶、抗体等生物大分子的分析、分离纯化的要求越来越高。如何有效地分离提纯不同蛋白质成为现在药物分析和生物科学的研究热点之一。
壳聚糖(Chitosan, CS)是甲壳素脱乙酰基的产物,是一类生物相容性好、可降解、天然无毒的线性多糖生物高分子。壳聚糖分子中含有自由的氨基和多个羟基,易进行羟基化、醚化、酰基化、烷基化及季铵化改性[2]。通过接枝改性的方法,在壳聚糖大分子骨架上选择性地接枝易于加工、强度高的、亲水性的、具有特殊功能的小分子,可有效改善壳聚糖的性能。Xu等[3]利用溶胶凝胶反应制备负载二氧化硅壳聚糖多孔有机质,其能快速吸附BSA,吸附量达到980 mg/L。Chen等[4]利用壳聚糖/羧甲基纤维膜、壳聚糖/羧甲基壳聚糖层析、吸附、分离卵白蛋白、溶解酵素。Jayakumar等[5]通过EDC做引发剂成功地将2-羟乙基膦酸接枝到CS上,得到的磷酸化壳聚糖衍生物具有良好的水溶性,也为本论文的壳聚糖衍生物合成方法提供了重要的依据。EDC是一种小分子交联剂,广泛用于羧基与氨基的交联。本实验方法就是利用接枝聚合反应,使壳聚糖与精氨酸发生酰化反应,将壳聚糖的氨基与精氨酸的羧基耦合在一起,形成共聚物。反应所得精氨酸修饰的壳聚糖具有更好的亲和吸附性能。
亲和膜分离技术是以膜作为基质,并对其表面进行改性,在膜的内外表面固定特定的配基,再对生物大分子进行分离纯化的技术。与传统亲和色谱相比,亲和膜分离技术具有高选择性、快速分离、操作条件温和、无污染和易放大的特点。纳米纤维内部贯通的孔洞和非常大的比表面积是人们将其应用于亲和膜的关键原因[6]。通过合成高分子材料与天然高分子材料混纺成膜,所得的材料具有机械性能好、化学稳定性高、可反应官能团丰富等优点,非常适合做蛋白质分离纯化的亲和膜基材。
2 实验
2.1 主要试剂与仪器
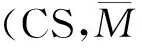
酶标分析仪:北京普朗新技术有限公司;气浴恒温振荡器:金坛市科杰仪器厂;真空冷冻干燥机:北京博医实验仪器有限公司。
2.2 精氨酸壳聚糖(CS-Arg)的制备
将上述1 g壳聚糖溶于100 mL 1%的冰醋酸中,用磁力搅拌器搅拌至壳聚糖完全溶解。称取0.71 g NHS加入壳聚糖溶液搅拌半小时,再称取0.96 g EDC加入到上述溶液继续搅拌至溶解[7]。后将精氨酸加入溶液中,继续搅拌24 h使反应充分完全。精氨酸与壳聚糖的摩尔比分别为1∶3、1∶2、1∶1、2∶1、3∶1五组,依次编号为1、2、3、4、5。精氨酸改性壳聚糖合成路线如图1所示。
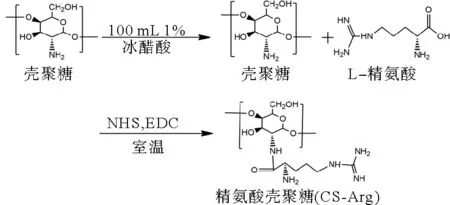
图1 精氨酸改性壳聚糖合成路线
将透析袋侵入蒸馏水中10 min使其充分吸水,将已反应好的五组溶液装入透析袋中用蒸馏水透析1~2天,期间每隔6 h换一次蒸馏水。然后换用聚乙二醇(PEG)作透析液,把透析袋再放入18%的PEG溶液中浓缩,浓缩一天,更换一次透析液。最后将溶液倒入培养皿中,放入冰箱中冷藏预冷冻30 min,转入冷冻干燥机中冷冻12 h,得到改性好的壳聚糖。
2.3 CS-Arg/PLA纳米纤维膜的制备
称取相同质量的CS-Arg固体和PLA颗粒溶解在三氟乙酸溶液中,配制成总浓度为4 wt%的CS-Arg/PLA溶液,先用玻璃棒搅拌均匀,再在磁力搅拌器上搅拌过夜备用。
采用溶液喷射纺丝技术制备CS-Arg/PLA纳米纤维(CANFs)[8~12](如图2所示),其基本纺丝流程如下:将配制好的混合溶液装入到一个容积为10 mL的注射器中,用胶皮管连接注射器和针头,针头直径为0.3 mm,进液速度为10 mL/h,压力为0.05 MPa。纺丝完成后,将得到纤网放入60℃的热鼓风干燥箱中烘燥3 h,去除残留的三氟乙酸。然后把干燥好的纤网用热压机热压,温度设为100℃,压力为5 MPa,得到平整和有一定机械强度的纳米纤维亲和膜。CANFs不同取代度的纤维膜CANFs-(1,2,3,4,5),依次编号为A1、A2、A3、A4、A5。
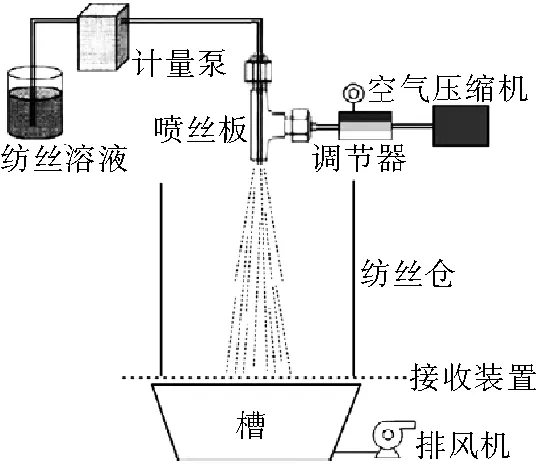
图2 溶液喷射纺丝实验装置示意图
2.4 CS-Arg样品的结构与性能表征
采用TENSOR37型红外光谱仪对CS-Arg样品试样进行红外测试,粉末测试方法采用KBr压片法;用热分析仪测定样品的热稳定性能,在固定氮气气氛下以10℃/min的加热速率从环境温度加热到800℃;使用VARI0EL3型元素分析仪测定样品(确定样品已烘干至恒重)的碳、氮、氢三种元素的含量,并计算精氨酸的接枝率。
2.5 CANFs纳米纤维膜的测试
2.5.1 扫描电镜(SEM)测试
取少许纳米纤维样品喷金后在扫描电镜(SEM)下观察其微观形貌,采用随机抽样的方法。
2.5.2 BSA的吸附量测试
利用酶标分析仪测定562 nm处每个试样的吸光度值,并根据标准曲线计算剩余蛋白浓度,由式(1)得到BSA 的吸附量。
q=[(Ci-Ct)V]/m
(1)
试中:q—BSA的吸附量(mg/g);
V—蛋白质溶液体积,取10mL;
Ci—BSA溶液的初始浓度(mg/mL);
Ct—BSA溶液的平衡浓度(mg/mL);
m—膜的干重(g)。
3 结果与讨论
3.1 CS-Arg的结构表征
CS-Arg的进行红外光谱图如图3所示。在壳聚糖的红外光谱中,2867 cm-1的弱吸收峰对应着-CH-的伸缩振动,伯氨(-NH2)弯曲特征振动峰和吡喃环上C-O-C的非对称伸缩振动分别在1590 cm-1、1151 cm-1。对于精氨酸:1614 cm-1对应精氨酸特有基团胍基(-CH4N2)的吸收峰[13],1419 cm-1和1130 cm-1的吸收峰分别是由于COO-的对称弯曲、C-C-N 的不对称弯曲。
与精氨酸和壳聚糖的红外图谱对比,新合成的精氨酸改性壳聚糖衍生物的红外图谱有明显的变化。胍基基团的吸收峰在1636 cm-1和C-C-N 的不对称弯曲的吸收峰在1150 cm-1,也可以看到壳聚糖吡喃环C-O骨架伸缩振动带出现在1068 cm-1~1027 cm-1,另外在1557 cm-1附近为仲氨弯曲振动特征吸收峰,伯氨(-NH2)弯曲特征振动峰在精氨酸改性壳聚糖之后消失,是由于壳聚糖分子的中的氨基与精氨酸的α-羧基脱水形成肽键,生成仲胺[14],初步说明了壳聚糖精氨酸改性成功。

图3 精氨酸、壳聚糖以及CS-Arg产物的红外图谱
CS-Arg的TG曲线如图4所示,可以看出CS-Arg的热分析图分为三个失重阶段:第一个阶段温度在20℃~150℃之间,是由于附属和结合水的蒸发;第二个阶段温度在150℃~375℃之间,是失重最大的阶段。当温度达到270℃时失重达到最大,是由于CA中的酰胺键断裂,碳链断裂,CA逐步降解;第三个阶段温度在375℃~800℃之间,在这个阶段,小分子基团继续断裂,进一步降解直至重量稳定。曲线(A5)不同于曲线(A1)、(A2)、(A3)、(A4)所变现出来的规律,是由于精氨酸是过量的,精氨酸发生了自交联。从表1中可以看出,这五个不同摩尔比CS-Arg的失重率大致相当。
表1 CS-Arg三个阶段的失重率
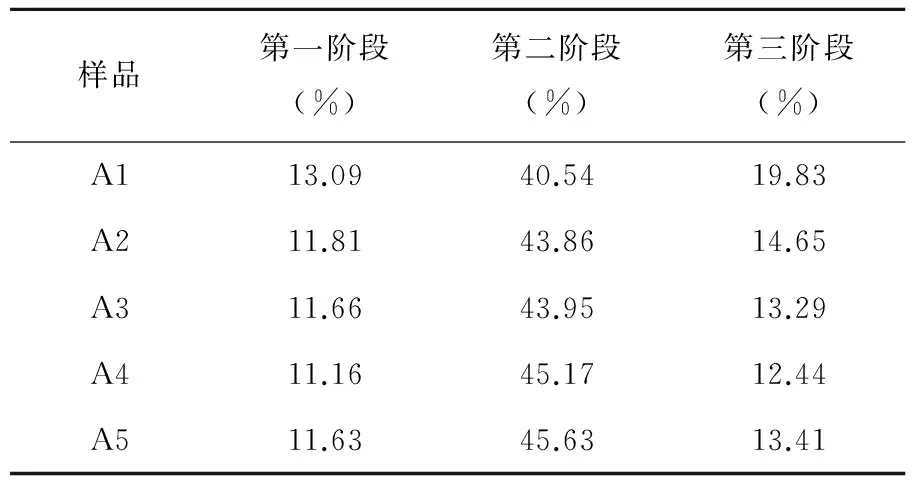
样品第一阶段(%)第二阶段(%)第三阶段(%)A113.0940.5419.83A211.8143.8614.65A311.6643.9513.29A411.1645.1712.44A511.6345.6313.41
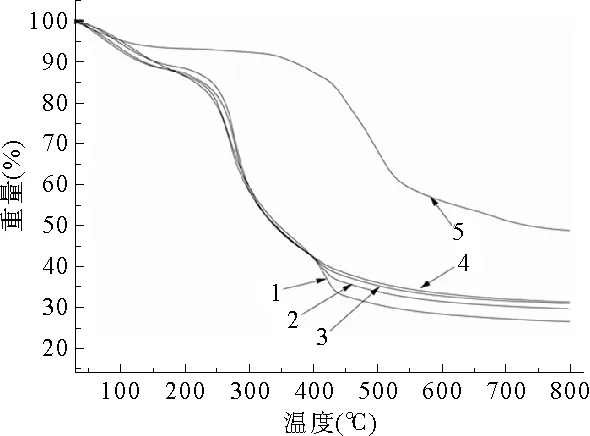
图4 不同摩尔比CS-Arg的TG曲线
根据碳氮的比例来计算产物CS-Arg的取代度。假设原料壳聚糖中,脱乙酰度为DD,取代度为DS,则CS-Arg中碳和氮的百分比C%/N%为:
其中DD为壳聚糖的脱乙酰度(DD=0.92),DS为取代度。
不同摩尔比的CS-Arg的元素分析结果见表2。由表2可见,壳聚糖的接枝率在16%~44%之间,有较高的接枝率。由表中数据可以看出,随着精氨酸的量增加,精氨酸壳聚糖的取代度也随之增大,这是因为精氨酸的量增加,则壳聚糖单元的氨基被接枝的几率增加,从而产物的取代度增大,但当精氨酸增加一定程度(精氨酸与壳聚糖的摩尔比为3∶1)时,接枝率不再增加,这是因为精氨酸过量了,没有多余的壳聚糖与之结合,造成部分精氨酸与精氨酸之间的自组合。
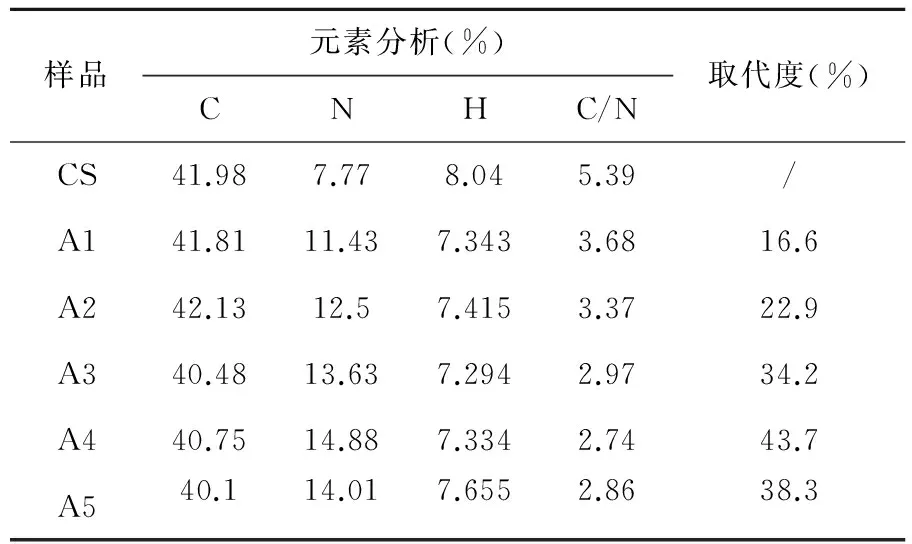
表2 壳聚糖以及CS-Arg产物的C、N、H元素含量
3.2 CANFs纳米纤维膜的测试
3.2.1 CANFs纳米纤维膜的形貌分析
图5(A1-A5)为不同取代度CANFs电镜形貌图,其中A1、A2、A3、A 4、A5依次为精氨酸取代度为16.6 %、22.9 %、34.2 %、43.7 %和8.3 %的纤维形貌图。

图5 不同取代度的CANFs电镜图及直径分布
由图可以看出,纤维整体形态良好,蓬松多孔,呈现三维卷曲形态;纤维平均直径分布在100 nm~200 nm之间,但随着取代度的不同纤维直径稍微发生细微的变化,随着取代度的增加,纤维直径稍微变大。从图(A5)中明显看出有少许液滴,图(A1、A2、A3、A4)中则基本没有出现液滴的情况,这是因为图(A5)中含过量的小分子精氨酸再加上本身CS-Arg材料不易成纤维,聚乳酸的辅助成纤作用削弱,导致表面张力过大不易拉伸成纤,出现液滴的情况,而其他四个则相反,无小分子干扰,CS-Arg和聚乳酸混合溶液具有可纺条件所具备的粘度和分子量,在纺丝拉伸过程中完全呈纤维状,则会形成无液滴形貌良好的纤维。由纤维形貌可以看出,这种杂乱无章平铺形成的三维卷曲结构有较大的比表面积和更高的孔隙率,这种结构会降低液体的流动阻力,同时其卷曲微孔延长了流体穿行路径,增加与纤维表面接触碰撞的几率,提高了截留效率,也提高了纤维表面亲和配基的利用率,以上都会增加对蛋白质的吸附能力。
3.2.2 CANFs亲和膜对蛋白质吸附的影响
配基数量是影响吸附研究的重要因素之一,精氨酸作为配基接枝到壳聚糖上由于其取代度的不同,最终吸附量也会不同,一般是取代度越大其吸附量越大呈正相关关系。取代度不同的CANFs亲和膜对蛋白质吸附的影响见图6。

图6 取代度不同的CANFs亲和膜对蛋白质吸附的影响
由图6可知,吸附量随着取代度的增加而增加。配基存在的情况下,最低吸附量达到了295.36 mg/g,也具备良好的吸附性能;A4试样制备的CANFs-4亲和膜精氨酸的取代度最高,蛋白质的吸附量最大,吸附量达到445.19 mg/g。由此可以得出,CANFs亲和膜具有良好的吸附性能,且与精氨酸的取代度存在正相关关系,壳聚糖本身对蛋白质就有良好的亲和吸附性,再加上配基的固载使吸附性能得到进一步提高。精氨酸的存在提供了胍基基团,胍基上氮原子和氢原子很多,对肽有高度的亲和性,容易形成氢键作用,胍基含有正电荷基团能与蛋白质形成静电作用,所以制备的CANFs亲和膜的吸附性能比较好,具有很好的应用前景。
4 结语
纳米纤维亲和膜对蛋白质吸附性能的研究越来越受关注,纳米纤维内部贯通的孔洞和大的比表面积是其应用于亲和膜的关键。本文基于溶液喷射纺丝技术,制备CANFs亲和膜进行蛋白质吸附性能测试。五种CANFs亲和膜(A1、A2、A3、A4、A5)中A4(CANFs-4)亲和膜对BSA的吸附能力最好,吸附量达445.19 mg/g。随着生物工程和生命科学的迅速发展,生物大分子的分离纯化越来越重要,该研究具有广阔的应用前景。
[1] 王子佳,李红梅,弓爱君,等.蛋白质分离纯化方法研究进展[J].化学与生物工程. 2009,26(8):8—11.
[2] 张峰. 壳聚糖基多孔膜材料的研究[D].上海:复旦大学,2012.
[3] Xu XY,Dong PJ,Feng Y,et al. A Simple Strategy for Preparation of Spherical Silica-supported Porous Chitosan Matrix Based on Sol-gel Reaction and Simple Treatment with Ammonia Solution[J].Analytical Methods,2010,2(5):546—551.
[4] Liu YZ,Feng ZC,Shao ZZ,et al. Chitosan-Based Membrane Chromatography for Protein Adsorption and Separation[J].Materials Science and Engineering,2012,32(6):1669—1673.
[5] Jayakumar R,Reis RL,Mano JF. Phosphorous Containing Chitosan Beads for Controlled Oral Drug Delivery[J].Journal of Bioactive & Compatible Polymers,2006,21(4):327—340.
[6] 闵明华,石建高,马海有,等.纳米纤维亲和膜应用研究进展[J].合成纤维,2013,42(3):20—23.
[7] Yin L,Su T,Chang J,et al. Arginine and Acrylonitrile Modified Chitosan Nanoparticles for Anticancer Drug Delivery[J].Nano Brief Reports & Reviews,2014,09(07):1450075.
[8] 杨小灿,庄旭品,史少俊,等.溶液喷射法制备聚丙烯腈基纳米碳纤维的研究[J].高科技纤维与应用, 2013, 38(2):14—19.
[9] Jia K,Zhuang X,Cheng B,et al. Solution Blown Aligned Carbon Nanofiber Yarn as Supercapacitor Electrode[J].Journal of Materials Science: Materials in Electronics,2013,24(12):4769—4773.
[10] Yan G,Zhuang X,Tao X,et al. Solution Blowing of Silicon Carbide Nanofiber and its Thermal Stability[J].Science of Advanced Materials,2013,5(3):209—215.
[11] Zhuang X,Jia K,Cheng B,et al. Solution Blowing of Continuous Carbon Nanofiber Yarn and its Electrochemical Performance for Supercapacitors[J].Chemical Engineering Journal,2014,237(1):308—311.
[12] Liu R,Xu X,Zhuang X,et al. Chitosan/PVA Hydrogel Nanofiber Mats[J].Carbohydrate Polymers, 2014,101(30):1116—1121.
[13] Zhou C,Ye H,Wang H,et al. Coordination of L-Arginine and Iron Cation Improves Stability of Hemoglobin Concentrates[J].European Food Research and Technology,2015,240(4):743—751.
[14] 王召占.氨基和羧基改性磁性壳聚糖的制备及其吸附性能研究[D].青岛:青岛科技大学,2014.
Preparation of Chitosan Modified L-arginine Nanofibers Membrane and its Application in Affinity Sorption for BSA
WangLiangan1,ZhuangXupin1,2,ChaoGuiqun1,XuXianlin1,2,DongFeng1
(1.Tianjin Polytechnic University, Tianjin 300387, China;2.Key Laboratory of Advanced Textile Composite Materials of Ministry of Education of Tianjin Polytechnic University,Tianjin 300387,China)
In this paper, a series of chitosan-arginine(CS-Arg) with different substitution degrees were prepared by changing the molar ratio of arginine to chitosan. Chemical structure and morphology of CS-Arg were characterized through FTIR, TG and elemental analysis. CS-Arg nanofibers(CANFs) were successfully fabricated via solution blowing of CS-Arg and polylactic acid mixed. It was evaluated the adsorption characteristic of CANFs for bovine serum albumin(BSA). The adsorption capacity of A4(CANFs-4)affinity membrane for BSA was the best, which reached to 379.43 mg/g.
nanofiber affinity membrane; protein adsorption; solution blowing; chitosan; arginine
2016-11-06
国家自然科学基金资助项目(51473121)
王良安(1990—),男,山东菏泽人,硕士研究生。
TQ342+.86
B
1009-3028(2016)06-0001-05
