青藤碱结构修饰研究进展
2016-06-05赵子剑
赵子剑
(怀化学院化学与材料工程学院,湖南怀化418008)
青藤碱结构修饰研究进展
赵子剑
(怀化学院化学与材料工程学院,湖南怀化418008)
青藤碱属于异喹啉类生物碱,具有抗炎、镇痛、免疫抑制等多种生物活性.主要对青藤碱近年来的结构修饰及其衍生物生物活性研究进展进行综述,其中一些青藤碱衍生物具有优良的活性.
青藤碱;结构修饰;生物活性
青藤碱(Sinomenine)的化学名为(9α,13α,14α)-7,8-二脱氢-4-羟基-3,7-二甲氧基-17-甲基吗啡喃-6-酮,其分子式为C19H23NO4,分子量为329.38(结构式如下).

从化学结构分析可知,青藤碱母核结构的四个环是由部分饱和的菲核和乙胺桥构成的,属于吗啡烷类生物碱.纯净的青藤碱为长丝状晶体,熔点为161℃,在氯仿、丙酮、乙醇和稀碱液中可溶,在水、乙醚和苯中微溶.青藤碱的旋光度为:[α]20D-710,(c=2.1,乙醇),最大吸收波长为UVmaxEtOH=263 nm(1ogε=3.79).青藤碱的盐酸盐则为针状晶体,熔点为233℃,易溶于水.青藤碱是一个具有吗啡烷结构特征的选择性COX-2抑制剂,是一个具有确切临床疗效的风湿性关节炎治疗药物.过去的数十年的研究表明:青藤碱具有抗炎、镇痛[1,2],免疫抑制[3,4]和抗癌[5,6]等多种生理功能,但青藤碱也存在半衰期短,用药量大,口服和注射给药均具有导致白细胞减少,促进组胺释放致皮疹、过敏性休克及胃肠道反应等副作用,而且其外用透皮吸收性能很差.因此,青藤碱的结构修饰与优化越来越引人关注.下面就近年来国内外学者对其的结构修饰与优化及修饰物的生物活性研究现状作一综述.
1 A环的结构修饰与生物活性
对青藤碱A环的结构修饰多集中在1、4位.1、4位各有14种修饰物报道;2位修饰仅见一未成功修饰报道,3位甲醚有3种修饰报道.
罗烈将青藤碱A环4位的酚羟基定向设计成一些极性较小的基团,合成得到了多个青藤碱衍生物1a-1g.通过醋酸诱导的小鼠扭体反应和角叉菜胶诱导的大鼠足拓肿实验分别考察了这些衍生物的镇痛和抗炎作用,并用logti法计算了它们的半数有效量,结果证实1a-1g都具有一定的镇痛和抗炎活性,其中以取代基极性最小的1g活性(镇痛和抗炎)最强,从而得出了在青藤碱4位酚羟基上引入极性较小的基团,有利于增强镇痛和抗炎活性[7]的结论.

吴飞驰、冯孝章、吴克美等于2006年在专利公开号为CN 1876634 A[8]中公开了一种将青藤碱A环改造的方法,合成了多个青藤碱衍生物2~5.
通过对合成的青藤碱衍生物进行小鼠耳部巴豆油炎症抑制实验、大鼠角叉菜胶足拓肿实验和醋酸诱导小鼠扭体实验,分别考察了所合成衍生物的抗炎和镇痛活性,实验结果证明:1,5二溴代的青藤碱衍生物物4及1位醛基取代的青藤碱衍生物2具有较好的镇痛抗炎活性,衍生物3及衍生物5的活性则不及青藤碱.

李建新、邓张双[9]通过化学和生物的方式合成了三个具有光学异构的双青藤碱6、7、8,衍生物6为(R)-双青藤碱,衍生物7为(S)-双青藤碱,两个青藤碱的连接位置为A环1位.

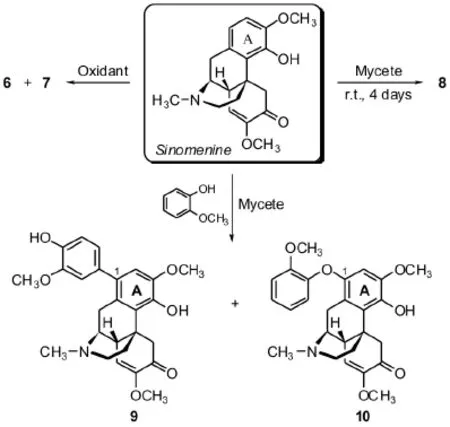
通过对所合成的青藤碱衍生物进行炎症因子1L-1β和肺肿瘤细胞BGC、肝肿瘤细胞7721抑制率实验证实:合成的化合物6、7、8具有比青藤碱更好的炎症因子和肿瘤细胞抑制作用.
罗娟等[10]基于Mannich碱化合物大多具有良好的生物活性的事实,以青藤碱、甲醛及胺为原料,在超声波辐射条件下合成了2个1-位取代的胺甲基化合物11(产率为85.5%~90.3%)和12(产率为80.6%~85.7%).再由11与芳胺及吗啉的胺交换反应合成了13(产率为50.6%~60.7%)及8个取代胺甲基化合物14 a~14 g(产率为29.5%~50.3%).他们用小鼠耳部二甲苯炎症抑制实验对这些衍生物进行了抗炎活性测试,结果证实:大部分衍生物具有一定程度的抗炎药效,并且衍生物14 a和14 b在较小的给药剂量(60 mg/kg)情况下还表现出比青藤碱较大的给药剂量(80 mg/kg)相当或更强的药效.


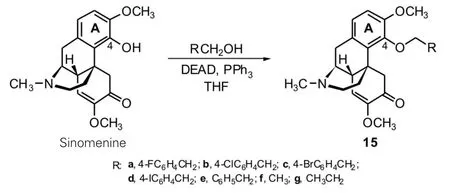
郑兴良等[11]在文献调研的基础上认为,青藤碱A环4-位酚羟基可能是其引起过敏反应的因素之一,且游离酚羟基易氧化,人服用后容易被代谢氧化分解,从而会增大用药量,而大剂量用药又会引发较多或更重的副作用.为达到降低青藤碱的过敏反应发生率和减少用药剂量的目的,他们以青藤碱和芳香醇(或脂肪醇)为原料,在三苯基磷(PPh3)和偶氮二甲酸二乙酯(DEAD)的催化促进下,以温和地反应条件,对A环4-位上的酚羟基进行了醚化,高效地合成了7个青藤碱衍生物15 a~15 g(收率78%~94%),他们报道的这种合成方法简单且温和、选择性好,能够广泛地应用于多官能团天然产物的成醚修饰.遗憾的是,他们并没有报道这些衍生物的药理活性测试结果.
林红卫等[12]以青藤碱和对甲苯胺为原料,依次通过芳胺重氮化和偶合反应以较高的产率制得了1个青藤碱衍生物16(青藤碱偶氮甲苯,纯度96%),并考察了反应温度、原料配比、反应时间和pH对产物收率的影响.遗憾的是,他们仅考察了合成工艺,但未对这种衍生物进行相关的药理活性考察.

Zhang[13]等在进行荧光探针设计与合成的研究过程中,得到了3个青藤碱A环衍生物17~19.化合物19具有荧光效应,在生物医学上具有作为分子探针的潜在应用前景.他们开发的合成路线具有操作简单、选择性好和原料廉价,产率高(如从青藤碱反应生成17的产率高达85%,从17反应生成18的产率可达到81%,而从18反应生成19的产率也可达到64%)的特点,但未对衍生物17~19进行药理活性考察.


2 B环的结构修饰
对青藤碱B环的结构修饰大多集中在青藤碱骨架10-位上,且与A环的修饰同时进行.目前已知的10-位修饰衍生物有20余种.

姚祝军等利用青藤碱结构中存在易被氧化的酚羟基,通过氧化、氧化去芳香化、共轭加成芳构化引入C-10取代基等方法对B环进行了结构修饰,获得了一系列结构多样的青藤碱衍生物(产率10%~100%)[14~16].通过体外TNF-α抑制试验,发现其中一些衍生物表现出一定程度的抗炎活性,特别是化合物20(抑制率32%)、21(抑制率48%)、22(抑制率30%)、28(抑制率31%)、36(抑制率30%)表现出了明显的抑制TNF-α基因表达的效果.而化合物29(抑制率-10%)、30(抑制率-12%)、31(抑制率-15%)表现出有促进TNF-α基因表达的作用,抗炎活性较青藤碱差.


3 C环的结构修饰
对青藤碱C环的结构修饰多集中在6-位、7-位及7,8-位双健上.目前有30余种修饰物的报道.另外,在C环的5-位也有数种修饰物报道.
上海有机所的姚祝军等对C环的结构修饰体现在7,8-位双健和6-位羰基碳上.例如:他们首先将青藤碱转化为具有(+)吗啡结构的化合物41,并进一步将其衍生出带有取代基或不带取代基的吡嗪环、咪唑环或咪唑啉(硫)酮环化合物,获得了一系列结构新颖的青藤碱衍生物(产率46%~85%)[14-16].该方法反应条件温和,适用于工业生产.他们还通过T细胞和B细胞增殖实验,发现青藤碱C环链接有吡嗪环的衍生物具有比青藤碱更强的免疫抑制活性,它们对T淋巴细胞增殖反应的抑制百分比可由-40%提高到-87%,对B淋巴细胞增殖反应的抑制百分比可由-18%提高到-89%,这些衍生物可用于制备免疫调节方面的药物.


吴飞驰等根据青藤碱结构中的6-位羰基、7-位烯甲醚和7,8-位双键等官能团较活泼的特性对青藤碱C环进行了结构修饰,他们分别通过烯醚水解、羰基还原(NaBH4)以及碳碳双键的催化加氢等方法,获得了多种青藤碱衍生物[17],并进一步用抗炎实验(巴豆油致小鼠耳肿胀法、角叉菜胶致大鼠足跖肿法)和镇痛实验(小鼠醋酸扭体法)对这些衍生物进行药理活性考察.结果显示,与青藤碱相比,化合物50,51的抗炎药效基本保持,化合物52的抗炎药效略高于青藤碱.化合物51的镇痛作用较青藤碱好.


对青藤碱C环进行改造和修饰研究中的另一亮点,就是可将C环上羰基可转化为具有C=N结构的腙或希夫碱.此外,C环还可以通过酸性条件下的水解转化为邻二酮结构,从而可进一步的进行修饰.例如,唐强等[18]分别通过这一策略对青藤碱C环的5-、6-、7-和8-位进行结构修饰,合成了多种衍生物61~66(如将青藤碱水解衍生物与伯胺、肼的反应获得了青藤碱腙或希夫碱衍生物61~63;利用邻二酮将C环6-和7-改造成相应的缩酮结构的衍生物64;利用己酮稀醇化的特点实现了羰基位置改变的衍生物65,66).小鼠耳肿胀抗炎实验显示,大多数衍生物具有一定的抗炎活性,某些衍生物的抗炎活性与青藤碱相当,而化合物65a、65c和66b具有较青藤碱好的抗炎镇痛作用.

特别值得提及的是,一些研究者还开展了一些同时改造(或修饰)C环与其它环的工作.例如,日本化学家Itokawa等[19]运用有机硒亚砜催化下的羰基换位反应及稀醇钾催化的氧化反应,同时对青藤碱C环和D环17-位上的N取代基进行结构改造,高产率的合成了4个青藤碱衍生物67~70(产率:67为95%,68为90%,69为89%,70为98%).他们通过P-388小鼠淋巴细胞白血病实验对这些衍生物的抗癌活性进行了观察,结果表明,具有(6S,7S)乙二醇结构的衍生物67有显著的抗肿瘤活性(T/C=166%),其他差向异构体68~70则没有显现出抗肿瘤细胞的活性(T/C=105%,101%,108%).
王菲等[20]也以青藤碱为先导化合物,对其结构中的A环和C环进行了一系列的结构改造的尝试,其中通过卤素取代和格氏反应等方法,成功获得了一个未见报道的青藤碱衍生物71.虽然他们没有对其生物活性作进一步的观察,但他们发现青藤碱4-位酚羟基具有化学惰性,从而推测其可能不会与病灶处的靶细胞产生稳定的共价结合,进而认为4-位酚羟基不是青藤碱治疗风湿性关节炎的药物活性点.

秦国伟等[21]以青藤碱为先导化合物,对其A、C、D环进行了结构改造,设计合成了一类青藤碱衍生物72(注R3:OH或OR,R4和R5:H或共同双键,或氧代,或N-ORs(Rs为H或R);R7:OH,RO,RCOO;R4和R6:形成双键或氧代,或者为N-OR或N-NRR;R9和R10:相同或相异的烷基,Z-为卤素离子;X为卤原子),经过小鼠Morris水迷宫实验证实,该系列中某些化合物具有抵制东莨菪碱诱导的记忆损伤作用;大鼠认知和物体识别实验也显示,该系列青藤碱衍生物中部分化合物具有极大的增强大鼠记忆力的能力.通过NaNO2诱导的小鼠缺氧实验证实,该系列中一些化合物在小鼠抗缺氧实验中具有明显的抗缺氧和神经保护作用.
李玉峰等使用Mitsunobu甲基化反应首先对青藤碱A环进行结构改造,得到了4-位O-甲基青藤碱中间体73,73经过酸水解得到C环二酮衍生物74、74经硼氢化反应制得75,最后经高碘酸钠氧化开环后得到了O-甲基青藤碱二醛衍生物76,在哌啶存在下二醛76发生羟醛缩合反应,合成了具有(+)-C-normorphinan骨架的青藤碱衍生物77和78,最后通过对78进行衍生化,合成了一系列青藤碱衍生物79~83(产率66%~95%),相关药理活性测试结果表明该类化合物具有一定的抗炎、镇痛活性[22].


4 D环的结构修饰
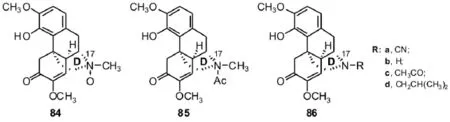
一般而言,对青藤碱D环的结构修饰通常是指对D环19-位上的N的修饰.例如,吴飞驰等[8]合成了多个青藤碱衍生物84~86.他们通过小鼠醋酸扭体实验、小鼠耳部巴豆油炎症抑制实验、大鼠角叉菜胶足拓肿胀实验、大鼠腹腔肥大细胞脱颗粒作用实验、致敏大鼠腹腔肥大细胞释放组胺的影响实验以及大鼠脾细胞释放IL-2实验进一步观察了这些衍生物的抗炎、镇痛和免疫调节活性.结果发现:大部分化合物具有一定的镇痛抗炎活性,其中化合物86a和86b具有比青藤碱及青藤碱盐酸盐有更好的免疫抑制活性.
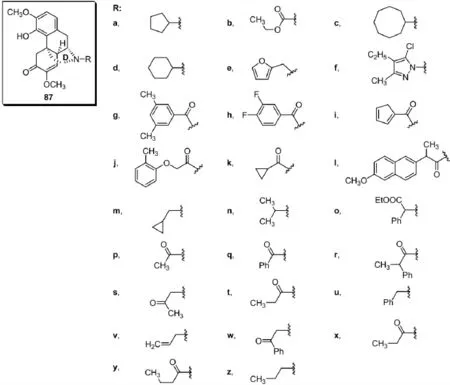
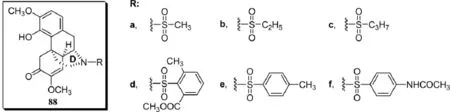
潘毅等先用苄氧苄基保护酚羟基,将青藤碱17-(N)进行去甲基化后再链接不同烃基、酰基和磺酰基,然后用三氟乙酸在室温条件下脱去苄氧苄基的方法合成了系列青藤碱D环17-位N原子上链接不同官能团的17-烃基青藤碱、17-酰基青藤碱衍生物87和17-磺酰基青藤碱衍生物88[23~25].他们开发的合成方法具有副反应少,条件温和(室温反应),反应速度快(2~10 min),产率高(产率均在90%以上),与苄基保护方法相比不产生双键氢化现象的优点.遗憾的是,相关文献并未对衍生物进行药理活性测试.
5 前景与展望
青藤碱具有镇痛、抗炎、抗肿瘤等多种生物活性,在临床上用于治疗风湿、类风湿性关节炎,取得了较好的药效,具有巨大的临床应用价值.通过结构修饰提高其活性越来越受到药学研究者的重视,其结构修饰主要在A环1、4位,B环10位,C环6、7、8位和D环N原子,通过结构修饰获得了数个活性优良的化合物,得出了一定的构效关系,为设计出活性更佳的衍生物提供了思路.风湿、类风湿性关节炎缺乏特殊有效的根治方法,在风湿、类风湿性关节炎发作期间,患者需服药缓解症状,由于风湿、类风湿性关节炎可反复发作及老年人口数目的增加,抗风湿、类风湿性关节炎药有十分广阔的市场需求.因此,青藤碱的结构修饰成为抗风湿、类风湿性关节炎药学研究的热点,通过对青藤碱结构修饰的探索来寻找活性高效低毒的衍生物是一项非常有价值、有前景的研究工作.
[1]胡屹屹,何孔旺,温立斌.6种中药生物碱对内毒素诱导内皮细胞分泌白介素-1α、NO和6-酮-前列腺素F1α的影响[J].华南农业大学学报,2012(3):407-410.
[2]张美玉,李鹏,王丹巧,等.青藤碱对SSNI模型大鼠镇痛效应和纹状体细胞外液单胺类递质的影响[J].中国中药杂志,2013(4):597-604.
[3]Ling-Chen Yan,En-Guang Bi,Yang-Tong Lou,et al.Novel sinomenine derivative 1032 improves immune suppressionin experimental autoimmune encephalomyelitis[J].Biochemical and Biophysical Research Communications,2010(391):1093-1098.
[4]Yue Cheng,JingboZhang,WeipingHou,et al.Immunoregulatory effectsofsinomenineontheT-bet/GATA-3ratioand Th1/Th2cytokinebalanceinthetreatmentofmesangial proliferative nephritis[J].International Immunopharmacology,2009(9):894-899.
[5]王晓洁,牛剑明,徐丽丹,等.青藤碱抑制肺癌细胞株Calu-1增殖、凋亡影响的实验研究[J].现代肿瘤医学,2013(2):267 -270.
[6]LiQian,ZongliX,WeiZhang,etal.Sinomenine,anatural dextrorotatorymorphinananalog,isanti-inflammatoryand neuroprotective through inhibition ofmicroglial NADPH oxidase [J].Journal ofNeuroinflammation,2007(4):1-14,23.
[7]罗烈.青藤碱衍生物的合成及镇痛抗炎作用的定量构效关系研究[D].武汉:武汉大学,2005.
[8]吴飞驰,冯孝章,吴克美,等.一种青藤碱结构改造化合物及其制备方法[P].CN1876634-A,ZL2006 10086423.5.
[9]李建新,邓张双.碳碳方式连接的双青藤碱衍生物、制备方法及其应用[P].CN1785976-A,ZL2007 10134648.8.
[10]罗娟.青藤碱的结构修饰及其抗炎活性研究[D].成都:四川大学,2007.
[11]郑兴良,张宏志,蒋宁飞,等.青藤碱A环衍生物的合成[J].湖南师范大学自然科学学报,2011(4):59-63.
[12]李勇,林红卫,朱士龙,等.青藤碱偶氮甲苯的合成与表征[J].化学试剂,2012(1):31-34.
[13]Zhang Y H,Gao Z X,Zhong C L,et a1.An inexpensive fluorescent labeling protocol for bioactive natural products utilizing Cu(I)-catalyzed Huisgen reaction[J].Tetrahedron, 2007(29):6813-6821.
[14]Yang-Tong Lou,Hai-Bin Zhou,JiaZou,et al.Modification of poorlybioactivesinomenineintomorepotent immunosuppressiveagentsbyembeddingofdrug-like fragments[J].Tetrahedron Letters,2010(3):485-488.
[15]姚祝军,孙兵,楼杨通,等.一种青藤碱衍生物、合成方法及其用途[P].CN101798285-A,ZL2010 10108675.X.
[16]姚祝军,周海滨.C环连接有吡嗪环的青藤碱衍生物、合成方法及其用途[P].CN1687065-A,ZL2005 10024479.3.
[17]叶仙蓉,颜克序,吴克美,等.青藤碱衍生物的合成及其抗炎镇痛活性[J].药学学报,2004(3):180-183.
[18]Tang Q,Luo J,Li Y,et a1.Synthesis and anti—inflammatory activities investigationof sinomenine derivatives on ring C.Natural Product Research,2006(11):1015-1023.
[19]Yukio Hitotsuyanagi,Kunihiko Nishimura,Hiroshi Ikuta,et al. Syntheses ofAntitumor Morphinane Alkaloids,Sinococuline and 6-epi-,7-epi-,and6-epi-7-epi-Sinococuline,from Sinomenine[J].J.Org.Chem.,1995(60):4549-4558.
[20]王菲.风湿性关节炎药物青藤碱的结构修饰[D].天津:天津大学,2007.
[21]秦国伟,唐希灿,王蕊,等.汉防己碱和汉防己碱化合物,合成和应用[P].CN 02153819.0,CN 1328280C,ZL 2002 02153819.0.
[22]李玉峰,卜清明,潘毅,等.从青藤碱制备具有(+)-CNormorphinan骨架的化合物[J].有机化学,2009(2):259-264.
[23]潘毅,李玉峰,卜清明,等.一类N-烃基青藤碱及其制备方法[P].CN1785976-A,ZL2005 10123089.1.
[24]潘毅,李玉峰,卜清明,等.一类17-磺酰基青藤碱及其制备方法[P].CN1785977-A,ZL2005 10123090.4.
[25]潘毅,李玉峰,卜清明,等.一类17-酰基青藤碱及其制备方法[P].CN1821244-A,ZL2006 10038662.9.
Advances in the Study of Structural Modification of Sinomenine
ZHAO Zi-jian
(College of Chemical and Material Engineering,Huaihua University,Huaihua,Hunan 418008)
Sinomenine is a kind of isoquinoline type alkaloid and has various biological activities.In this paper,the author explores the progress made in structural modification of sinomenine and anti-inflammation,analgesia,immunodepression in recent years are reviewed,and some derivatives with excellent biological activity are obtained.
sinomenine;structural modification;biological activity
O69
A
1671-9743(2016)11-0044-12
2016-06-16
民族药用植物资源研究与利用湖南省重点实验室资助项目(YYZW2015-7).
赵子剑,1972年生,男,湖南南县人,教授,博士,研究方向:药学.
