荧光光谱法研究20(S)-原人参三醇与牛血清白蛋白的相互作用
2016-06-05张钊华迟绍明盘振杰李志文李亚娟胡天凤陈艳梅
张钊华、迟绍明、盘振杰、李志文、李亚娟、胡天凤、陈艳梅、赵 焱
云南师范大学化学化工学院、云南 昆明 650500
荧光光谱法研究20(S)-原人参三醇与牛血清白蛋白的相互作用
张钊华、迟绍明、盘振杰、李志文、李亚娟、胡天凤、陈艳梅、赵 焱*
云南师范大学化学化工学院、云南 昆明 650500
用荧光光谱和紫外-可见吸收光谱研究了20(S)-原人参三醇(PPT)与牛血清白蛋白(BSA)的相互作用、结果表明:PPT对BSA荧光的猝灭类型为静态猝灭。在温度为298、308、318 K时的结合常数分别是0.926 3×103、0.618 2×103、0.414 4×103L·mol-1、结合位点均接近于1。PPT与BSA结合过程中主要的驱动力为氢键和范德华力。与PPT结合后、BSA分子中色氨酸残基部位的结构变得更加紧密。依据Föster的荧光共振能量转移理论得出PPT与BSA的结合距离r为2.62 nm、能量转移效率E为0.32。
20(S)-原人参三醇; 牛血清白蛋白; 荧光光谱法; 相互作用
引 言
20(S)-原人参三醇(PPT)是一种从三七、西洋参或人参等植物中分离出来人参皂苷元、为达玛烷型四环三萜类天然产物[1]。研究表明、PPT在抗疲劳、抗氧化延缓衰老、调节血糖、改善心脑血管供血不足和调节中枢神经系统等方面均具有广泛的生物活性[2]。尤其在抑制肿瘤方面、PPT具有抑制肿瘤细胞增殖、促进肿瘤细胞凋亡、诱导肿瘤细胞分化等抗肿瘤活性[3]。由于PPT显著的抗肿瘤细胞活性、且毒副作用小、其作为一种前景看好的抗肿瘤候选药物引起了国内外学者的广泛关注[2-3]。
血清白蛋白是生命体内含量最丰富且最重要的蛋白质之一、它主要用于贮藏及运输内源代谢产物和外源药物小分子[4]。研究有机小分子与蛋白质相互作用的特征、有助于从分子水平了解它们之间的作用机理、这在促进蛋白质组学、药理学以及毒理学的研究等方面有重要意义[5-6]。牛血清白蛋白(BSA)由于价廉且易得、所以常将其用于与药物作用机制的研究。遗憾的是、目前尚未见PPT与BSA相互作用的研究报道。因此本文运用荧光光谱法对PPT与BSA相互作用进行研究、探究了它们之间的猝灭类型、结合常数、结合位点数、作用力类型以及结合距离。这将有助于了解PPT的药理作用、PPT和BSA间的结合方式以及PPT对BSA构象的影响。
1 实验部分
1.1 仪器及试剂
Hitachi F-4600荧光光谱仪、UV-1901紫外-可见光谱仪、DNP-9022型电热恒温箱、AL204分析天平、pHS-29A pH计。
2×10-4mol·L-1的PPT溶液(购买于中国科学院昆明植物所、纯度>98%); 1×10-4mol·L-1的BSA溶液(购买于Sigma试剂公司、分子量:68 000); 9%的NaCl溶液; 0.05 mol·L-1pH(7.40±0.01)的Tris-HCl缓冲液; PPT与BSA摩尔比为1∶1、浓度cPPT=cBSA=2×10-5mol·L-1的混合溶液。
1.2 方法
在10 mL容量瓶中依次加入9%的NaCl溶液、Tris-HCl缓冲液各1 mL、BSA溶液2 mL以及一定量的PPT溶液、定容至刻度、定容后PPT浓度分别是0 、0.6×10-5、1.2×10-5、1.8×10-5、2.4×10-5、3.0×10-5mol·L-1。取3 mL上述溶液置于石英比色皿中、在激发波长为280 nm、狭缝宽度均为5 nm、扫描速度为1 200 r·min-1的条件下、分别扫描T=298、308、318 K时、BSA在285~500 nm之间的荧光光谱。同时测定Δλ为15和60 nm时BSA的同步荧光光谱。另外、运用紫外-可见光谱仪测定PPT与BSA摩尔比为1∶1的混合液在200~500 nm之间的吸光度值。
2 结果与讨论
2.1 PPT与BSA的荧光猝灭光谱
因为BSA分子中含有酪氨酸、色氨酸残基、因而具有比较强的内源荧光[7]。由图1可看出、298 K、激发波长280 nm时、在340 nm处出现了BSA的最强荧光发射峰。实验表明、在相同的实验温度下、随着PPT浓度的增大、BSA的荧光强度逐渐减弱、且最强荧光发射峰的峰位发生微小的蓝移、但其峰型保持不变、这表明PPT与BSA之间发生了相互作用。
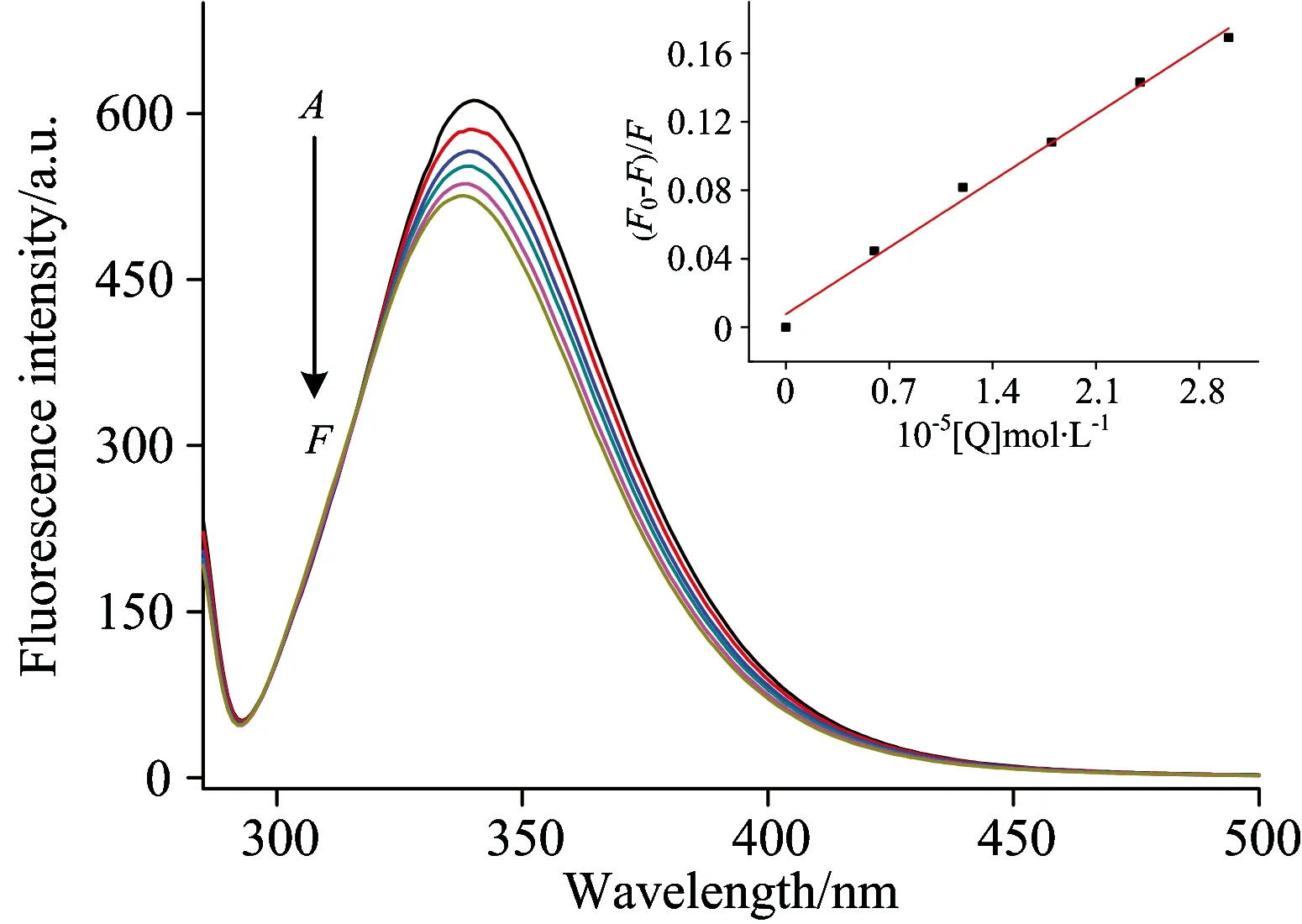
图1 不同浓度PPT对BSA荧光强度的影响(298 K)
Fig.1 Emission spectra of BSA in the presence of various concentrations of PPT (cBSA=2.0×10-5mol·L-1,cPPT/10-5mol·L-1From 0 to 3.0: 0,0.6,1.2,1.8,2.4,3.0)
2.2 PPT与BSA的荧光猝灭类型
荧光猝灭类型一般分为静态猝灭与动态猝灭。动态猝灭是指随着温度的升高、离子的有效碰撞次数增加、能量的转移也随之加剧、导致猝灭常数增大; 而静态猝灭是随着温度的升高、降低了复合物的稳定性、进而导致猝灭常数减小。
假设PPT与BSA的相互作用是动态猝灭过程、则满足Stern-Volmer方程[8-10]:
(1)
F0与F分别表示加入猝灭剂前后BSA的荧光强度值、[Q]是猝灭剂PPT的浓度、KSV表示猝灭常数、Kq表示双分子猝灭速率常数、τ0表示没有猝灭剂存在时荧光分子的平均寿命。由式(1)可知、荧光强度之比F0/F与猝灭剂浓度[Q]之间为线性关系。以F0/F对[Q]作图可得T=298、308、318 K时的Stern-Volmer图、如图2、曲线呈现良好线性关系、而直线斜率即猝灭常数KSV。该猝灭过程在不同温度时的Kq和KSV见表1。
由表1可知、随着温度的升高猝灭常数KSV逐渐减小、且Kq均大于各种猝灭剂的最大动态猝灭常数(2.0×1010L·mol-1·s-1)、结果说明PPT与BSA的猝灭过程为静态猝灭过程。
2.3 PPT与BSA的结合常数和结合位点数
静态猝灭过程的结合常数(Kb)与结合位点数(n)、可根据双对数方程式(2)计算[11-12]
(2)
以lg[(F0-F)/F]对lg[Q]作图、如图3所示、根据直线的斜率与截距可相应的求出结合位点数n与结合常数Kb、具体数据见表2。
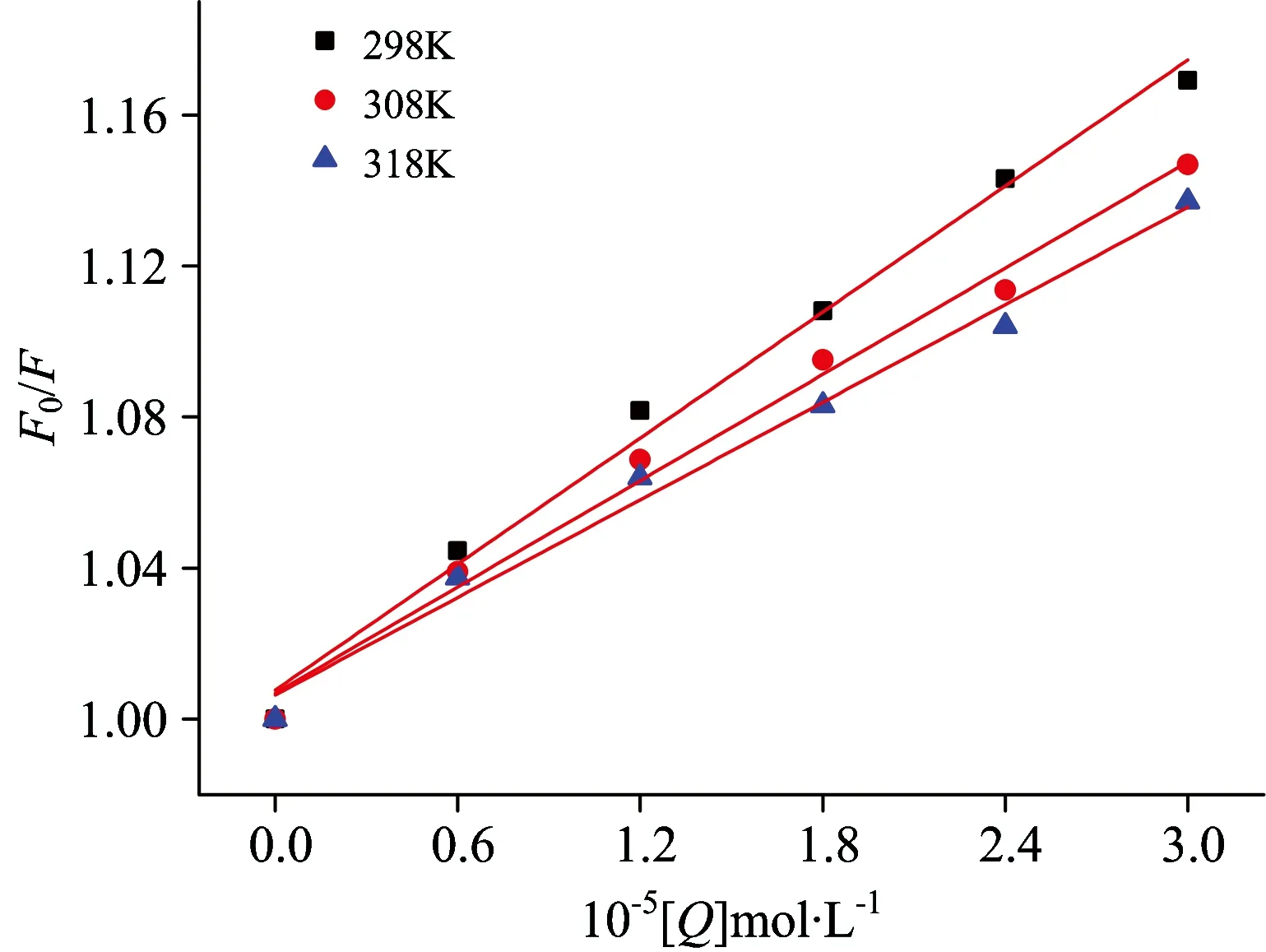
图2 不同温度下PPT对BSA猝灭的Stern-Volmer曲线
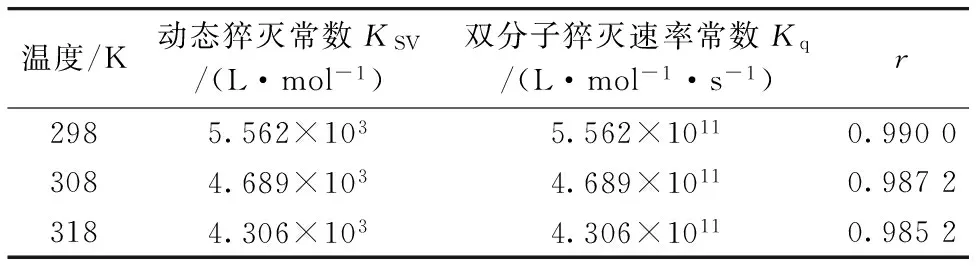
表1 不同温度下PPT对BSA荧光猝灭的Stern-Volmer方程及猝灭常数
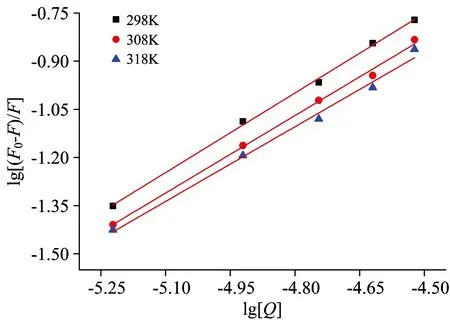
图3 不同温度下PPT对BSA双对数曲线
Fig.3 Plot of lg[(F0-F)/F] against lg[Q] at different temperatures
由图3及表2可得、PPT对BSA的双对数方程呈现良好的线性关系、并且结合常数Kb随温度的升高而减小、说明形成的复合物热稳定性不好、随温度的升高而发生解离。由表2可知结合位点数n都接近于1、说明PPT与BSA形成了1∶1的复合物。
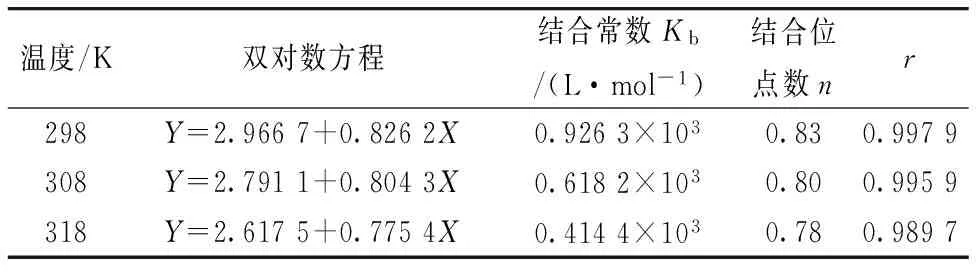
表2 不同温度下PPT对BSA结合常数和结合位点数
2.4 PPT与BSA的作用力类型
BSA与药物小分子间的作用力主要包括氢键、静电引力、范德华力及疏水作用力等。一般根据热力学参数中的焓变(ΔH)和熵变(ΔS)可以判断其作用力类型[13]、具体判断依据如表3所示。
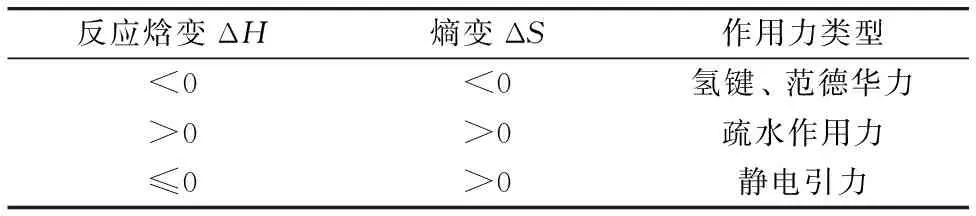
表3 作用力类型与热力学参数关系
当反应温度变化不大时、焓变(ΔH)可认为是一常数。热力学公式如下
(3)
由式(3)可知lnK与1/T是线性关系、以1/T为横坐标lnK为纵坐标作图、由斜率及截距求出ΔH及ΔS、如图4所示。表4列出了PPT和BSA结合过程中的相关热力学参数。结合表3和表4可知、PPT和BSA结合过程以氢键及范德华力为主要的驱动力。
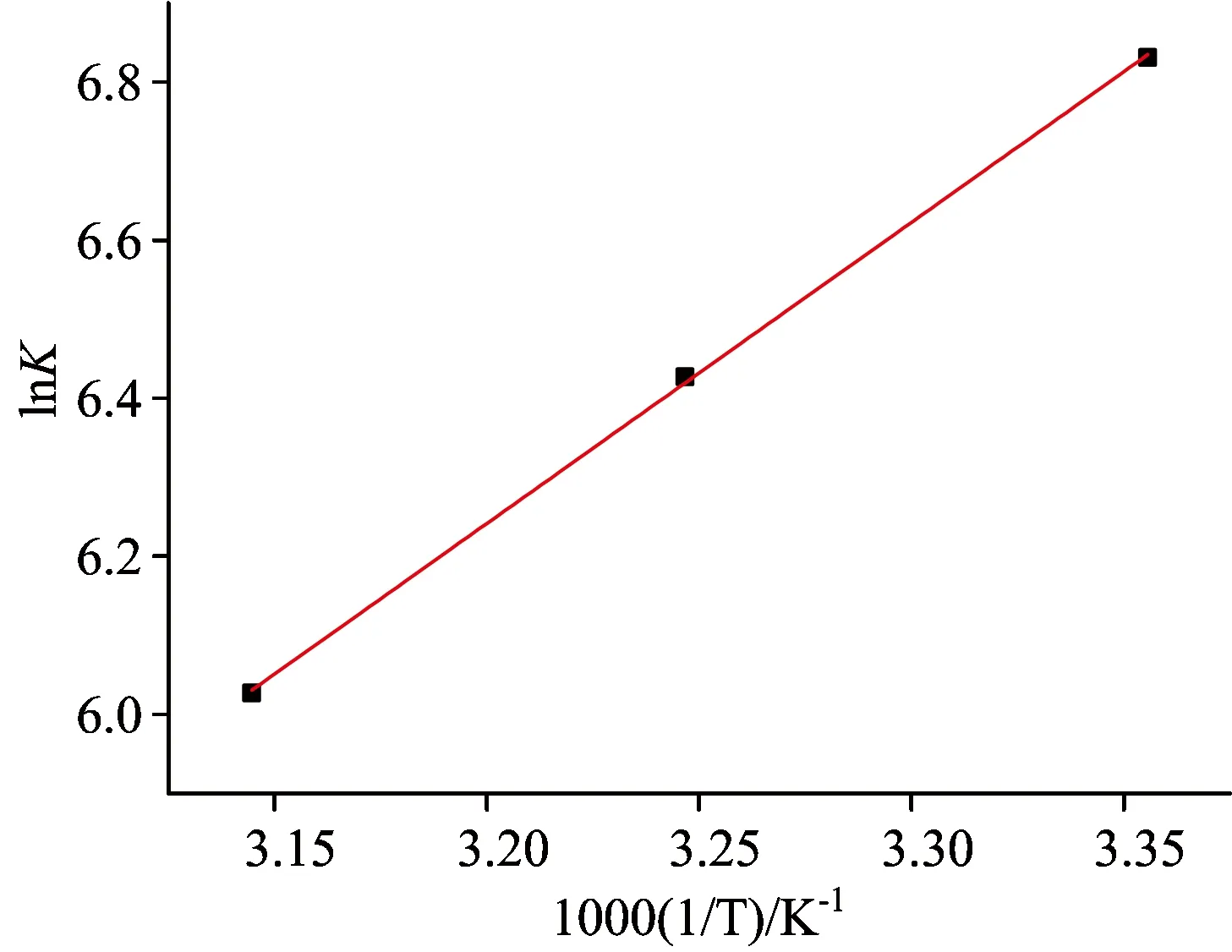
图4 不同温度下lnK对1/T曲线
2.5 PPT对BSA构象的影响
在BSA的结构中、色氨酸及酪氨酸残基能够产生一定荧光、因此可利用同步荧光光谱法研究PPT对BSA构象产生的影响。根据Miller等提出理论、当激发波长与发射波长的间距Δλ=15 nm时、同步荧光表现出的是酪氨酸残基的光谱特征、而Δλ=60 nm时展现的是色氨酸残基的光谱特征。如图5所示、当A→F逐渐增加PPT浓度时无论是酪氨酸还是色氨酸残基的同步荧光强度、均随PPT浓度的增加而降低。同时由图5(a)可知、Δλ=15 nm时、酪氨酸光谱的最大发射峰波长未见发生位移、说明PPT对BSA酪氨酸部位的结构无影响。而由图5(b)可知、Δλ=60 nm时、色氨酸光谱的最大发射峰波发生了明显的蓝移、说明PPT的加入、使BSA分子中色氨酸残基部位的结构变得更加紧密。

表4 不同温度下PPT与BSA结合过程的热力学参数
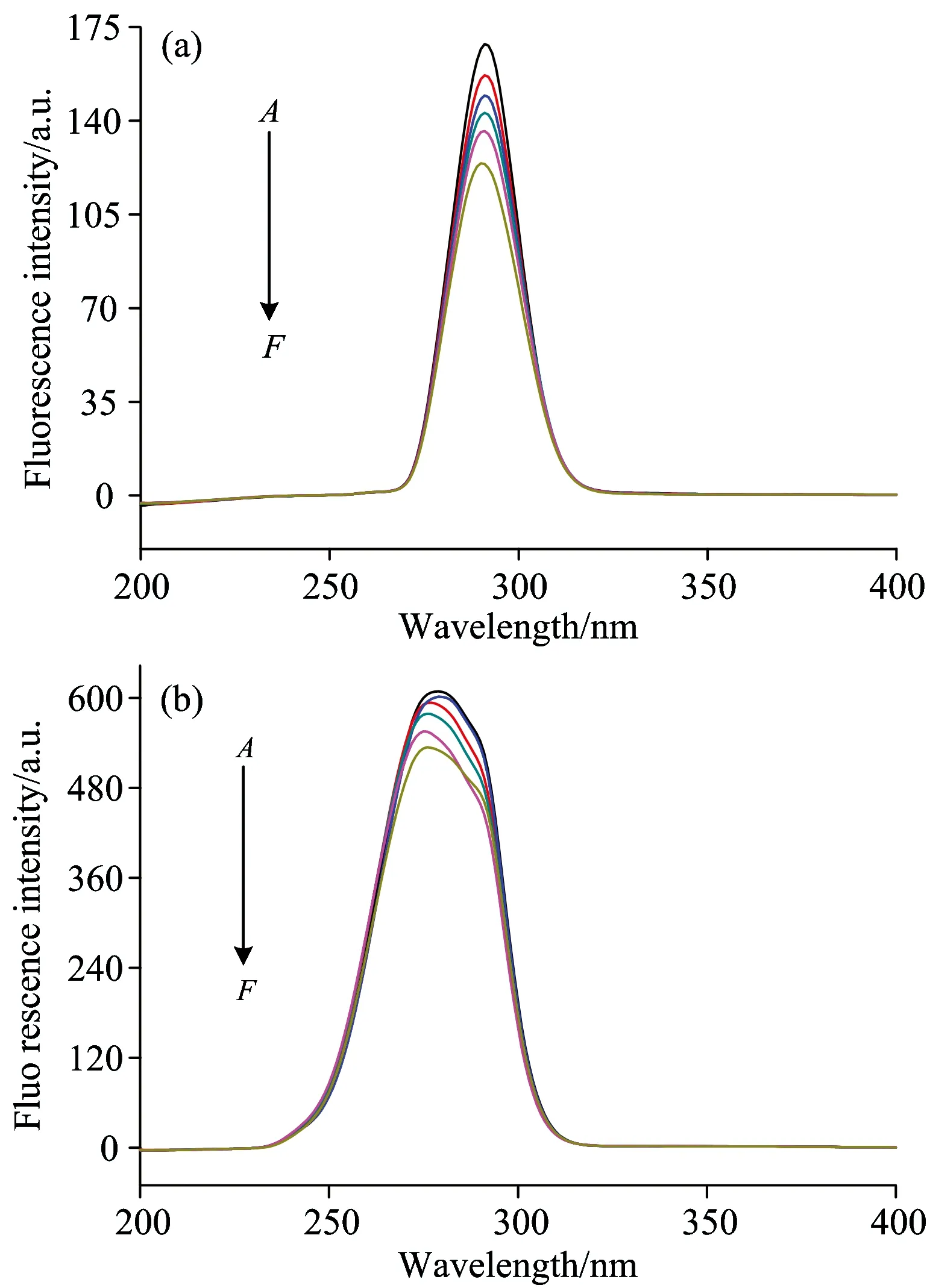
图5 同步荧光光谱(a):Δλ=15 nm,(b):Δλ=60 nm (T=298 K,cBSA=2.0×10-5mol·L-1,cPPT/10-5mol·L-1,A→F: 0,0.6,1.2,1.8,2.4,3.0)
Fig.5 Synchronous fluorescence spectra of BSA (a) Δλ=15 nm,(b):Δλ=60 nm (T=298 K,cBSA=2.0×10-5mol·L-1,cPPT/10-5mol·L-1、A→F: 0,0.6,1.2,1.8,2.4,3.0)
2.6 PPT与BSA的结合距离
药物小分子与BSA相互作用的结合距离可根据Föster 1948年提出的荧光共振能量转移理论计算得到[15-16]、该理论的能量转移效率满足式(4)
(4)
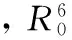
(5)
式(5)中F(λ)是受体在波长等于λ时的荧光强度、ε(λ)是受体在波长等于λ时的摩尔吸光系数。绘制PPT与BSA摩尔比为1∶1时的荧光光谱与吸收光谱的重叠光谱图、如图6所示。
通过计算可得J=5.61×10-15cm3·L·mol-1、E=0.32、R0=2.31 nm、r=2.62 nm。PPT与BSA的结合距离r<7 nm、表明偶极-偶极非辐射能量转移是引起BSA发生荧光猝灭的另外一个原因。
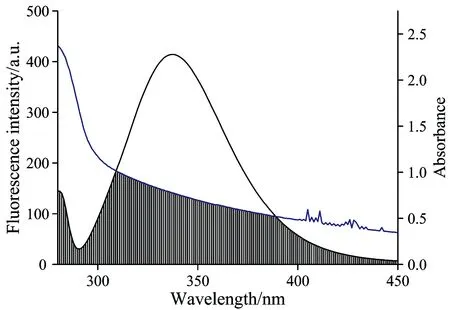
图6 吸收光谱和荧光光谱的重叠图(T=298 K、cBSA=cPPT=2.0×105mol·L-1
Fig.6 The overlap of BSA fluorescence and PPT absorbance spectra (T=298 K、cBSA=cPPT=2.0×10-5mol·L-1)
[1] TANG Wei-zhuo,ZHAO Yu-qing(唐伟卓、赵余庆). Ginseng Research(人参研究),2010,22(3): 20.
[2] DOU De-qiang,JIN Ling,CHEN Ying-jie(窦德强、靳 玲、陈英杰). Journal of Shenyang Pharmaceutical University(沈阳药科大学学报),1999,16(2): 151.
[3] DENG Jing,JIANG Yong-xin(邓 晶、蒋永新). Modern Oncolog(现代肿瘤医学),2009,17(11): 2234.
[4] LIU Jian-bo,ZHANG Jun-cai,WANG Xiao-ling,et al(刘建波、张君才、王晓玲、等). Chinese Journal of Spectroscopy Laboratory(光谱实验室),2013,30(3): 1157.
[5] YAN Cheng-nong,LIU Jing,LIU Yi(颜承农、刘 晶、刘 义). Journal of Yangtze University (Nat. Sci. Edit)(长江大学学报·自然科学版),2010,7(3): 41.
[6] YAN Cheng-nong,TONG Jin-qiang,XIONG Dan,et al(颜承农、童金强、熊 丹、等). Chinese J. Anal. Chem.(分析化学),2006,34(6): 796.
[7] XIE Xian-chuan,WANG Xiao-rong,ZHANG You-kuan,et al(谢显传、王晓蓉、张幼宽、等). Chinese J. Anal. Chem.(分析化学),2010,10(10): 1479.
[8] LIN Hai-bin,ZHENG Lin,LIN Yu-qin,et al(林海彬、郑 琳、林玉琴、等). Chem. J. Chinese Universities(高等学校化学学报),2013,34: 1818.
[9] CHEN Ning-sheng,FANG Rui-ping,ZHANG Ying,et al(陈宁生、方瑞萍、张 颖、等). Chinese Journal of Spectroscopy Laboratory(光谱实验室),2013,30(1): 367.
[10] WU Chun-hui,YE Hong-de,WU De-hong,et al(吴春惠、叶红德、吴德洪、等). Spectroscopy and Spectral Analysis(光谱学与光谱分析),2013,33(1) : 120.
[11] FU Cai-xia,RONG Xian-guo,LI Feng(付彩霞、荣先国、李 凤). Chinese Journal of Spectroscopy Laboratory(光谱实验室),2013,30(4): 1610.
[12] YAO Xiao-jing,ZHAO Wei,KAN Hong,et al. Chinese Journal of Biochemistry and Molecular Biology,2012,28(7): 666.
[13] NI Yong-nian,LIU Qiu-hong(倪永年、刘秋红). Journal of Nanchang University(Natural Science)(南昌大学学报·理科版),2009,33(3): 244.
[14] WU Xin,ZHAO Jin-zhong,ZHANG Jian-gang,et al(武 鑫、赵晋忠、张建刚、等). Chinese Journal of Analysis Laboratory(分析试验室),2013,32(4): 20.
*Corresponding author
Fluorescence Spectroscopic Studies on Binding of 20(S)-Protopanaxatriol with Bovine Serum Albumin
ZHANG Zhao-hua,CHI Shao-ming,PAN Zhen-jie,LI Zhi-wen,LI Ya-juan,HU Tian-feng,CHEN Yan-mei,ZHAO Yan*
College of Chemistry and Chemical Engineering,Yunnan Normal University,Kunming 650500,China
The interaction between 20(S)-protopanaxatriol (PPT) and bovine serum albumin ( BSA) was studied with fluorescence quenching technique and ultra-violet absorption spectroscopy. The results indicated that PPT led to the intrinsic fluorescence quenching of BSA through a static quenching process .The binding constants of PPT with BSA obtained with fluorescence quenching method were calculated as 0.926 3×103(298 K),0.618 2×103(308 K),0.414 4×103L·mol-1(318 K),respectively; while the number binding sitesnwere close to unity. The results showed that the driving force of the interaction between PPT and BSA was hydrogen bond and Van der Waals force. The result of synchronous fluorescence spectra showed that binding of PPT with BSA could induce conformational changes in BSA,that the part of tryptophan became more closely. According to Föster fluorescence resonance energy transfer theory,the binding distancerand energy-transfer efficiencyEwere respectively 26.2 nm and 0.32.
20(S)-Protopanaxatriol; Bovine serum albumin; Fluorescence spectroscopic; Interaction
Nov. 12,2015; accepted Mar. 5,2016)
2015-11-12、
2016-03-05
国家自然科学基金项目(21062030、21362046)资助
张钊华、女、1988年生、云南师范大学化学化工学院硕士研究生 e-mail: ZZH6210@163.com *通讯联系人 e-mail: zhaooyann@163.com
R446
A
10.3964/j.issn.1000-0593(2016)12-3991-05
