利用新型荧光银纳米团簇实现谷胱甘肽的快速精确检测
2016-06-05黄科翰秦翠芳曹潇丹杨太群陈瑜婷张三军潘海峰徐建华
黄科翰、秦翠芳、曹潇丹、杨太群、陈瑜婷、张三军、潘海峰、徐建华
精密光谱科学与技术国家重点实验室、华东师范大学、上海 200062
利用新型荧光银纳米团簇实现谷胱甘肽的快速精确检测
黄科翰、秦翠芳、曹潇丹、杨太群、陈瑜婷、张三军、潘海峰*、徐建华
精密光谱科学与技术国家重点实验室、华东师范大学、上海 200062
谷胱甘肽(GSH) 是一种含有巯基的三肽分子、参与许多细胞内生化过程、具有抗氧化和整合解毒功能、在生物体内以及医学、食品等领域有着极为重要的作用。GSH参与细胞内、体液中的许多重要生化反应、其在人体内含量的变化、相应地提示了人体的健康问题。目前对GSH的检测手段有表面增强拉曼光谱(SERS)、电化学分析、高效液相色谱(HPLC)等、这些方法大都操作复杂、耗时较长或者需要昂贵的仪器。利用一种新型荧光银纳米团簇(Ag NCs)作为探针、通过同时分析银纳米团簇的荧光强度变化以及荧光峰位置移动实现了GSH的高精度快速检测。在检测过程中、GSH分子与荧光探针发生化学反应、改变了荧光探针的光化学特性、其荧光强度因发生猝灭而减弱、且其荧光峰位置因配体的改变也发生移动。通过对照组实验、我们进一步证明了所发展的检测方法对GSH目标具有很好的特异性,综合考察荧光强度和波长的变化数据可以很好地区分GSH以及其他结构类似的分子、同时探针对于多种盐离子及氨基酸等不敏感、能够很好地保证检测的准确性。我们报导的荧光探针合成步骤简单、过程绿色环保、GSH检测的响应速度快、光谱波动较小、相对误差小。进一步的研究有望实现细胞内的GSH高精度检测及成像。
荧光光谱分析; 谷胱甘肽检测; 荧光探针; 银纳米团簇
引 言
谷胱甘肽(GSH)是一种重要的三肽、它由L-半胱氨酸、甘氨酸、L-谷氨酸三种常见氨基酸缩合而成、分布于人和动物的组织液和体液中[1]。尤其重要的是、体内谷胱甘肽含量水平异常、可提示身体患有疾病、例如HIV、帕金森综合征、肝损伤、炎症等都会引发体内谷胱甘肽含量的异常[2]。因此快速、高效、准确的检测谷胱甘肽、在对探明GSH在生理、病理上的功能以及揭示与之相关的含硫蛋白的生理、病理过程、疾病诊断领域的潜在应用上具有重大的意义。近年来、许多检测手段纷纷出现、比如MnO2量子点荧光探测[3]、SERS[4]、电化学分析、高效液相色谱HPLC[5]、毛细管电泳[6]等。
荧光探针是一种新型的GSH检测手段、具有灵敏、准确、高选择性以及合成技术相对简单优点[7-8]。量子点(QDs)、金银纳米颗粒、纳米粒子上转换(UCNPs) 等都已经作为荧光探针被成功地用于GSH的检测[3]、这些方法通常都是基于荧光探针的荧光峰强度的变化而达到检测目标的目的。荧光峰的强度变化通常不易观察、检测相对误差大、同时也需要昂贵精密的仪器、复杂的技术操作、很难达到快速检测的要求。
尺寸极小(<2 nm)的贵金属纳米团簇(NCs)、通常由几个到几百个金属原子组成、具有介于单个原子和纳米晶体(>2 nm)之间的物理化学特性[9-10]。由于其受到强的尺寸限制、纳米团簇(NCs)具有分离的、大小可调的电子能级、并具有类分子特性、例如量子化充电[10-11]。最新的研究已表明、发光的金(Au)银(Ag)团簇(NCs)在生物成像与生物探测的光学探针领域极具前景。与Au NCs相比、Ag NCs具有较低的生物毒性、较高的量子产率[12]。
本文报道一种基于荧光峰波长移动与荧光强度共同作用的新型荧光银纳米团簇快速探测谷胱甘肽的方法、比传统的依靠荧光峰强度变化探测的方法可以实现更精确、更快速的GSH检测。作为荧光探针的银纳米团簇利用聚(乙烯基甲醚-alt-马来酸)(PMVEM)作为模板剂制备、合成步骤简单制备方便。由于Ag NCs具有很好的生物兼容性、因此本方法还有望应用于细胞内GSH探测或成像、这为荧光探针方法检测GSH拓展了新思路。
1 实验部分
1.1 试剂与仪器
还原型谷胱甘肽(L-GSH、≥98.0%)、聚(乙烯基甲醚-alt-马来酸)(PMVEM、Mw ~216000)、硝酸银(AgNO3、>99%)、巯基琥珀酸(MSA、>97%)购自Sigma-Aldrich; 氢氧化钠(NaOH)、硫酸镁(MgSO4)、硝酸钠(NaNO3)、缬氨酸(Val)、组氨酸(His)、亮氨酸(Leu)、异亮氨酸(Ile)、丝氨酸(Ser)、谷氨酸(Glu)、丙氨酸(Ala)、苏氨酸(Thr)、精氨酸(Arg)、脯氨酸(Pro)均为分析纯、购于国药集团化学试剂有限公司; 所有试剂均未经过进一步纯化。实验所用水均为18.2 MΩ去离子水。
暗箱式紫外分析仪(ZF-20D、上海越众) 、稳态荧光光谱仪(FluoroMax-4、Horiba)、紫外-可见分光光度计(TU1901、北京普析通用)。
1.2 光催化合成原始荧光银纳米团簇(PMVEM-Ag NCs)
合成Ag NCs的方法如参考文献[13]所述。简要的过程如下、称取204 mg AgNO3加入到10 mL去离子水中搅拌溶解; 417.92 mg PMVEM加入到15 mL去离子水中搅拌溶解、同时加入~2 mL 2 mol·L-1的NaOH溶液使溶液pH 9。将配置成的PMVEM溶液倒入AgNO3溶液中并遮光不断搅拌10 min。将混合液在365 nm紫外灯下照射30 min。制得原始PMVEM-Ag NCs。
1.3 谷胱甘肽(GSH)检测
取合成的PMVEM-Ag NCs溶液0.6 mL、加入到2.4 mL去离子水中、混匀、再加入0.6 mL不同浓度的GSH溶液混合均匀、静置10 分钟。对照组与此类似、加入不同的氨基酸与盐溶液。
2 结果和讨论
2.1 GSH检测
AgNO3与PMVEM在365 nm紫外光照射下一步光还原形成PMVEM-Ag NCs。合成的Ag NCs在350 nm处有一个吸收峰、这是由PMVEM带有的羧基(—COOH) 产生的、团簇的荧光激发峰在355 nm、与羧基(—COOH) 吸收峰十分接近、团簇荧光是由羧基吸收紫外线与Ag核产生的配体—金属(L—M) 电荷转移形成的辐射跃迁所致[13]、PMVEM中羧基(—COOH)与Ag的L—M效应产生的发光峰位于约530 nm处、我们测得其量子产率约为1%左右。
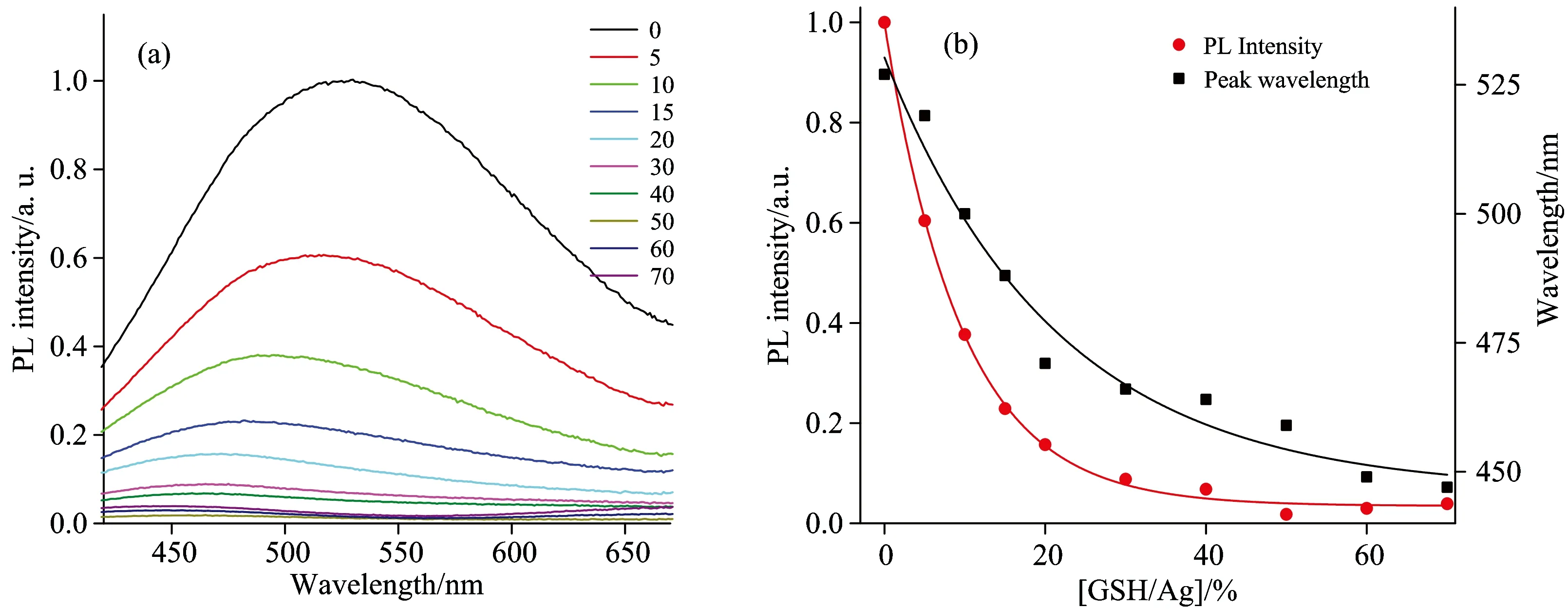
图1 (a)PMVEM-Ag NCs在加入不同摩尔百分比[GSH/Ag]后的荧光光谱; (b) PMVEM-Ag NCs水溶液中的荧光强度和峰值位置随不同摩尔百分比[GSH/Ag]的变化; 激发波长为355 nm
Fig.1 (a)Fluorescent spectra of PMVEM-Ag NCs at different percentages of molar concentration ratio[GSH/Ag]; (b) the photoluminescence intensity (PL) of PMVEM-Ag NCs and fluorescence peak position change with different [GSH/Ag] in aqueous solution. The excitation wavelength was fixed at 355 nm
固定溶液中PMVEM-Ag NCs的浓度、并逐渐增加GSH的浓度、图1(a)表明随着摩尔浓度比值[GSH/Ag]的百分数增加、PMVEM-Ag NCs的荧光峰位置逐渐蓝移、同时荧光强度也不断减弱。图1(b)显示随着[GSH/Ag]的摩尔比百分比从0~70 、团簇荧光峰从530 nm蓝移到447 nm、同时荧光峰强度也逐渐猝灭、强度降低到原始Ag NCs强度的3.88%。团簇荧光峰位置及荧光峰值强度与[GSH/Ag]摩尔浓度比值的关系大致满足关系式
λPL=Ae-R/b+k
IPL=Ce-R/d+l
其中:λPL表示纳米团簇的荧光峰波长、IPL表示纳米团簇的荧光峰值强度、R表示GSH与Ag的摩尔百分比、A、b、k、C、d、l为常数。
至此、通过同时检测银纳米团簇的荧光峰波长移动和强度变化、我们就可以得知GSH与AgNCs的摩尔百分比、在已知PMVEM-AgNCs浓度的条件下、实现GSH的有效检测。探针探测GSH的检测限为0.1mmol·L-1级别。进一步稀释探针溶液的浓度、提高荧光探测器的灵敏度、可以将检测限降至更低的浓度。
2.2 检测机理
荧光峰的移动是由于GSH上带有的巯基(—SH)刻蚀银PMVEM-AgNCs形成新的团簇所致。由于GSH上巯基(—SH)与Ag结合能力强过PMVEM上羧基(—COOH)与Ag的结合能力、团簇上的PMVEM被GSH取代、原始PMVEM-AgNCs结构被破坏、并重新与GSH形成新的团簇(GSH-AgNCs)、这些团簇也能发出荧光、但其发光波长与原始的PMVEM-AgNCs不同。GSH与Ag形成的新纳米团簇中、由于巯基(—SH)与Ag具有较强的络合能力、使GSH分子能与Ag络合在一起、GSH上羧基、N原子同时也与Ag靠近并产生相互作用。GSH中羧基(—COOH)与Ag的络合发出的荧光与PMVEM中羧基(—COOH)络合发出的荧光一致、具有增强荧光的作用;N原子与Ag络合产生了新的辐射性LUMO-HUMO能级、产生的荧光位置大约在420nm左右[13]。整体荧光减弱是由于新形成的荧光团簇结构很少、且过量巯基(—SH)同样会过度刻蚀新形成的发光团簇。
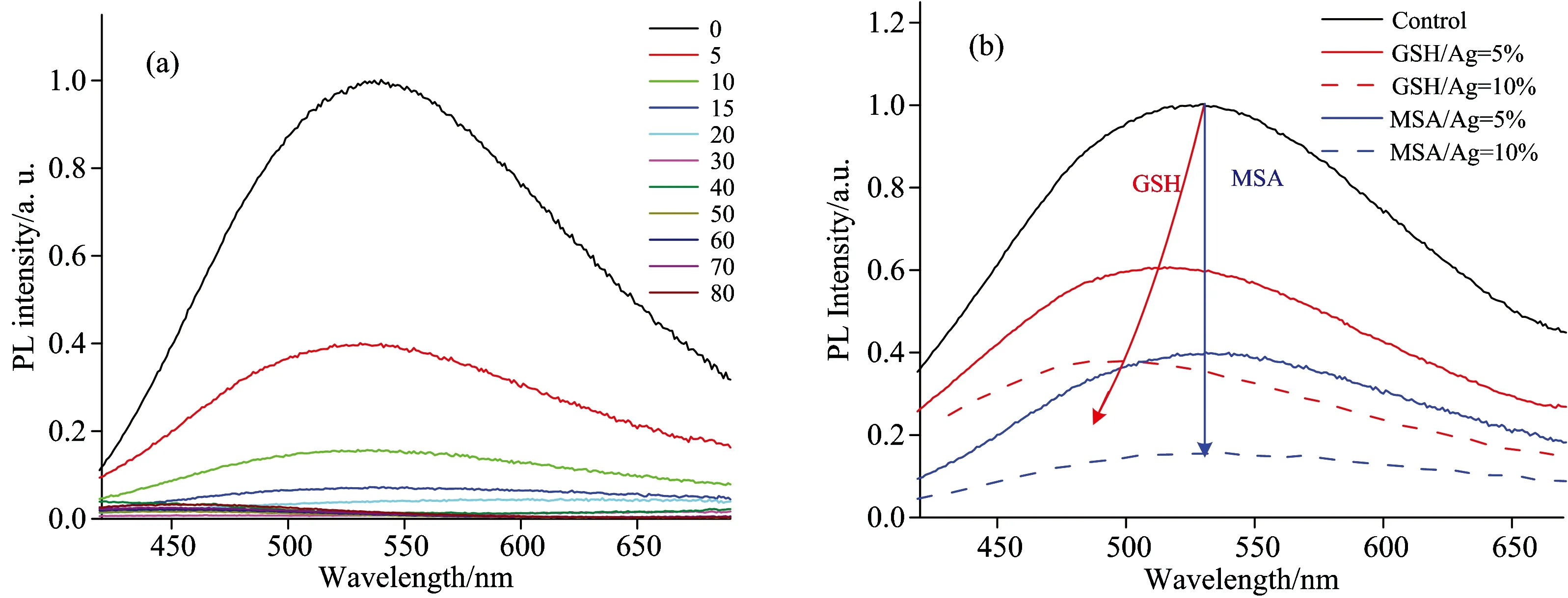
图2 (a) PMVEM-Ag NCs在加入不同摩尔百分比[MSA/Ag]后的荧光光谱; (b) PMVEM-Ag NCs水溶液中加入不同摩尔百分比的GSH(红线)和MSA(蓝线)后的荧光光谱; 对照组为原始的PMVEM-Ag NCs; 激发波长为355 nm
Fig.2 (a) Fluorescent spectra of PMVEM-Ag NCs with different percentage of molar concentration ratio[MSA/Ag]; (b) fluorescent spectra of PMVEM-Ag NCs with different concentration of GSH (red curve) and MSA (blue curve) in aqueous solution; compared with the fluorescent spectra of original PMVEM-Ag NCs. The excitation wavelength was fixed at 355 nm
深入研究探针的机理对于改进探针的性能以及开发新型的探针等都具有重要的意义。发光金属纳米团簇的发光机理曾被认为是金属核的量子局限效应(quantum confinement)、不同的发光波长是由于金属核大小差异引起的。所以对于基于金属纳米团簇探针的机理解释中、也采用量子局限效应的概念。例如、Mrudula[14]解释是由于S对于Ag核的刻蚀作用引起的。
但是近期的研究结果更倾向于发光金属纳米团簇的发光机理是由于配体到金属的电荷转移引起的。我们对于PMVEM-Ag NCs检测GSH的机理也进行了研究。PMVEM-Ag NCs对于一种与GSH类似的分子巯基琥珀酸(MSA)的响应如图2(a)所示。MSA分子与GSH分子有着相同数目的羧基(—COOH)、巯基(—SH)、但不含N原子。由图2(a)可见、随着MSA分子浓度的增加、PMVEM-Ag NCs的荧光强度逐渐减弱、但是荧光峰位置一直位于530 nm处。由于MSA的巯基(—SH)与Ag络合作用很强、MSA分子可以刻蚀Ag NCs使团簇的尺寸减小。在MSA加入之后、PMVEM-Ag NCs的荧光只是强度减弱而荧光峰位置不变的实验现象再次证明了Ag NCs的发光机理为配体到金属的电荷转移、而不是量子限域效应。所以PMVEM-Ag NCs的发光机理是由于羧基到银原子的电荷转移。加入MSA之后、MSA的巯基(—SH)与Ag的强络合作用破坏了羧基到银原子的电荷转移通道以及原始的团簇结构、使得PMVEM-Ag NCs荧光强度不断减弱直至消失、而MSA上中羧基(—COOH)与Ag的络合发出的荧光与PMVEM中羧基(—COOH)络合发出的荧光一致、所以荧光一直处于530 nm处不变。
PMVEM-Ag NCs对于GSH和MSA分子响应的对比关系如图2(b)所示。GSH除了带有与MSA相同数目的巯基(—SH)与羧基(—COOH)之外、还带有氮(N)。GSH与PMVEM-Ag NCs相互作用过程中、巯基(—SH)与Ag的强络合能力使GSH分子能与团簇结合在一起、GSH上羧基、N原子同时也与Ag靠近并产生相互作用。GSH中羧基(—COOH)与Ag的络合发出的荧光与PMVEM中羧基(—COOH)络合发出的荧光一致。但是、GSH中的N原子与Ag络合产生了新的电子跃迁通道、产生的荧光位置大约在420 nm左右。所以、随着GSH浓度的增加、体系的荧光峰逐渐蓝移。比较Fig.2(b)中相同检测物浓度(GSH/Ag=5%与MSA/Ag=5%、GSH/Ag=10%与MSA/Ag=10%)的曲线、可见相同检测物浓度下的GSH比MSA体系的发光更强、这是因为GSH中的N与Ag配合后提供了比MSA更多的电子跃迁通道。所以PMVEM-Ag NCs的荧光特性对于检测物分子含有巯基(—SH)、羧基(—COOH)、和N原子的官能团及数目均有响应。值得注意的是、虽然凡是含有巯基(—SH)的分子都会对荧光探针具有刻蚀作用、从而导致荧光猝灭; 但是水溶性很弱的分子或者与Ag络合后水溶性不强的分子、尽管含有N原子、也难以在水相中观测到荧光峰有规律稳定移动的现象、检测结果表现为快速猝灭荧光或者荧光峰移动现象不明显。这决定了PMVEM-Ag NCs的光谱响应特性对于检测物GSH分子具有很好的识别性。
2.3 检测的特异性
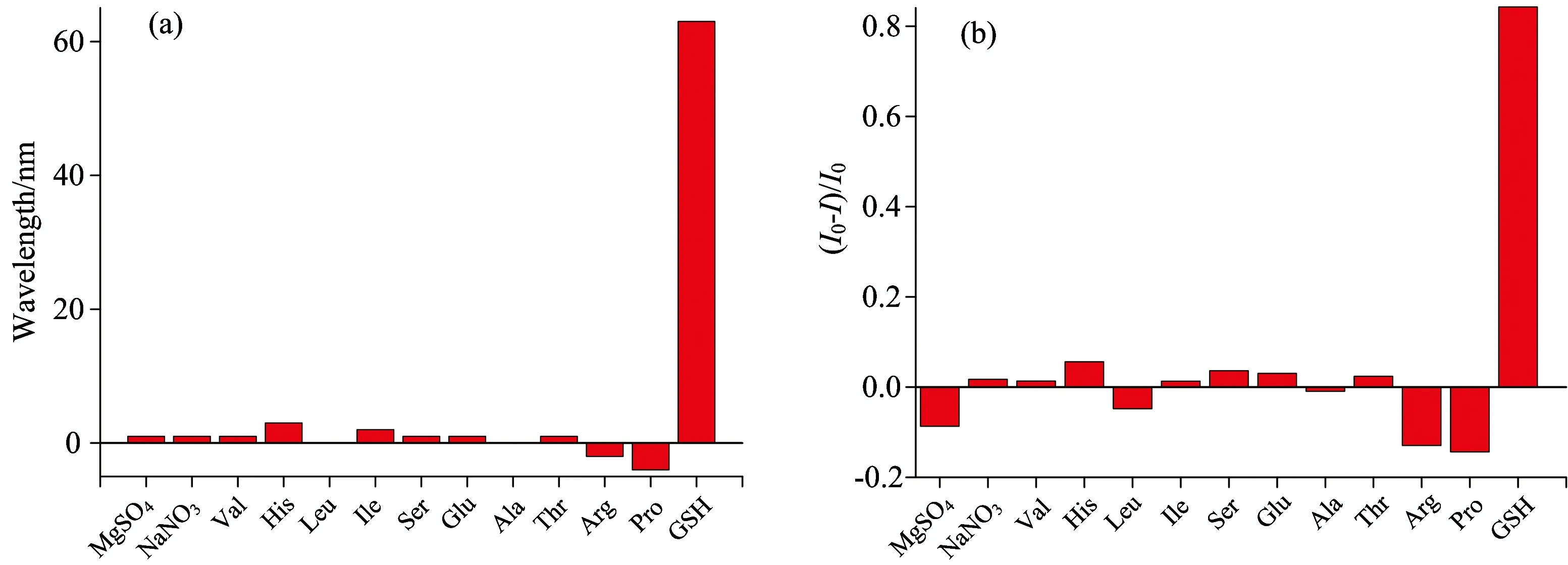
图3 对照实验。加入不同对照分子引起的PMVEM-Ag NCs的荧光峰值位置变化(a)和荧光强度变化(b)。(目标分子摩尔百分比为20%、激发波长为355 nm)I和I0分别表示加入不同对照分子后和未加入的荧光强度
Fig.3 The control group experiments. The variations of fluorescence peak positions(a)and fluorescence intensities (b)of PMVEM-Ag NCs corresponding to different detection target. (The molar concentration ratio is 20%,and the excitation wavelength was fixed at 355 nm)IandI0represent the fluorescence intensities with and without target samples,respectively
3 结 论
通过一种简单的合成步骤、我们制备了一种银纳米团簇作为检测GSH的荧光探针。通过观测银纳米团簇的荧光峰位置移动以及荧光强度变化、发展了一种对GSH探测的新方法。这种检测方法对GSH具有非常好的特异性、浓度检测更精确、响应非常快。对照实验表明、该探针对GSH具有较高的选择性、对于多种盐离子及氨基酸等不敏感。此外、我们还讨论了该探针的探测机理。该研究为有针对性的开发新型探针具有重要的指导作用。由于Ag NCs具有很好的生物兼容性的优点、进一步的研究有望实现细胞内的GSH检测及成像、并拓展更多的应用。
[1] Monostori P,Wittmann G,Karg E,et al. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences,2009; 877(28): 3331.
[2] Samiec P S,Drews-Botsch C,Flagg E W,et al. Free Radical Biology and Medicine,1998,24(5): 699.
[3] Cai Q Y,Li J,Ge J,et al. Biosensors & Bioelectronics、2015; 72: 31.
[4] Saha A,Jana N R. Analytical Chemistry、2013; 85(19): 9221.
[5] Patterson A D,Li H,Eichler G S,et al. Analytical Chemistry、2008; 80(3): 665.
[6] Kubalczyk P,Bald E. Electrophoresis,2009、30(13): 2280.
[7] Niu L Y,Chen Y Z,Zheng H R,et al. Chemical Society Reviews,2015; 44(17): 6143.
[8] Schaferling M,Angewandte Chemie-International Edition、2012、51(15): 3532.
[9] Jin R C,Qian H F,Wu Z K,et al. Journal of Physical Chemistry Letters,2010; 1(19): 2903.
[10] Diez I,Ras R H A. Nanoscale,2011; 3(5): 1963.
[11] Yeh H C,Sharma J,Han J J. Nano Letters,2010,10(8): 3106.
[12] Zhang Q B,Xie J P,Yu Y,et al. Nanoscale,2010,2(10): 1962.
[13] Chen Y T,Yang T Q,Pan H F,et al. Journal of the American Chemical Society,2014,136(5): 1686.
[14] Mrudula K V,Bhaskara Rao T U,Pradeep T. Journal of Materials Chemistry,2009,19(25): 4335.
*Corresponding author
Precise and Rapid Detection of Glutathione by Using Novel Fluorescent Ag Nanoclusters
HUANG Ke-han,QIN Cui-fang,CAO Xiao-dan,YANG Tai-qun,CHEN Yu-ting,ZHANG San-jun,PAN Hai-feng*,XU Jian-hua
State Key Laboratory of Precision Spectroscopy、East China Normal University、Shanghai 200062、China
Glutathione (GSH) is an important three-peptide molecule,which has the functions of antioxidation and detoxification,and plays a crucial role in the fields of biology,medicine and food science. It is involved in many important biochemical reactions in cells and body fluid,and the changes of GSH content reflect the specific health problems of human body. Current methods of GSH detection are always complicated,time-consuming and expensive instrument depended,such as surface enhanced Raman spectroscopy (SERS),electrochemical analysis,high performance liquid chromatography (HPLC) and so on. The probe’s photochemical properties can be modified by the reaction between GSH and nanoclusters,which will result in the changes of fluorescence intensity and wavelength. In this paper,a new method to realize precise and rapid GSH detection is developed by using silver na-noclusters as a fluorescent probe,and simultaneously measures the probe’s fluorescence intensity and wavelength. The synthesis of the fluorescence probe reported in this paper possesses the advantages of steps-simple and pollution free,and the GSH detection method has faster response,more accurate measurement and smaller relative error over the traditional methods. The good specificity of GSH detection among other molecules with the similar structure is further proved in control group experiments by comparing the differences of their fluorescence intensities and wavelength. The measurement accuracy is fully assured due to the insensitivity of the probe to a variety of salt ions and amino acids. This technique can be further employed in the intracellular detection and imaging of GSH.
Fluorescence spectral analysis; Glutathione detection; Fluorescent probe; Silver nanoclusters
Oct. 27,2015; accepted Feb. 10,2016)
2015-10-27、
2016-02-10
国家自然科学基金项目(61178085)和上海市自然科学基金项目(15ZR1410100)资助
黄科翰、1987年生、华东师范大学精密光谱科学与技术国家重点实验室硕士研究生 e-mail: 271550179@qq.com *通讯联系人 e-mail:hfpan@phy.ecnu.edu.cn
O641; O649
A
10.3964/j.issn.1000-0593(2016)12-3973-05
