纳米金催化剂的制备及其对肉桂醛选择性加氢的催化性能
2016-06-01伊秀娟曾利辉郝郑平
伊秀娟,曾利辉,2*,郝郑平,3
(1.应用表面与胶体化学教育部重点实验室,陕西师范大学化学化工学院,陕西 西安 710119;2.西安凯立新材料股份有限公司,陕西 西安 710201; 3.中国科学院生态环境研究中心,北京 100085)
纳米金催化剂的制备及其对肉桂醛选择性加氢的催化性能
伊秀娟1,曾利辉1,2*,郝郑平1,3
(1.应用表面与胶体化学教育部重点实验室,陕西师范大学化学化工学院,陕西 西安 710119;2.西安凯立新材料股份有限公司,陕西 西安 710201; 3.中国科学院生态环境研究中心,北京 100085)
摘要:以多壁碳纳米管和椰壳活性炭为载体,分别采用溶胶固载法和等体积浸渍法制备负载型纳米金催化剂。采用N2吸附-脱附、XRD、TEM和XPS等对碳载体和纳米金催化剂样品进行表征,并研究纳米金催化剂在肉桂醛选择性加氢反应中的催化性能。结果表明,HNO3-H2SO4预处理可以增加碳载体表面的含氧基团和含氮基团,在肉桂醛加氢反应中,溶胶固载法得到的更小尺寸的纳米金催化剂对双键加氢选择性高,等体积浸渍法制备的纳米金催化剂对双键加氢选择性高,椰壳活性炭为载体催化剂的加氢催化活性优于多壁碳纳米管。
关键词:催化化学;多壁碳纳米管;椰壳活性炭;纳米金;肉桂醛;加氢

本文采用溶胶固载法和等体积浸渍法制备多壁碳纳米管(MWCNTs)和椰壳活性炭(CAC)负载纳米金催化剂,通过N2吸附-脱附、XRD、TEM和XPS等对碳载体和纳米金催化剂进行表征,并研究纳米金催化剂在肉桂醛选择性加氢反应中的催化性能。
1实验部分
1.1试剂
甲醇,分析纯,国药集团化学试剂有限公司;肉桂醛、肉桂醇、苯丙醛、苯丙醇,98%,阿拉丁试剂;氯金酸,分析纯,上海化学试剂有限公司;聚乙烯吡咯烷酮K30,生化试剂,上海生物科技发展有限公司;硼氢化钠、浓H2SO4、浓HNO3、氨水、盐酸、氢氧化钠,分析纯,国药集团化学试剂有限公司;多壁碳纳米管[外径(10~20) nm],中国科学院成都有机所;椰壳活性炭(JCV2000,过200目筛网),南京吉仓纳米科技有限公司。
1.2催化剂制备
1.2.1载体预处理
通过强氧化性酸作用,可以在碳材料表面缺陷处引入—COOH、—OH和—NOx 等含氧基团[8-9],此外,酸作用还可以除去载体表面的无定形碳和可溶性杂质等,减小载体中的灰分含量,降低灰分元素对催化剂的影响。
称取1.50 g的MWCNTs置于250 mL圆底烧瓶,分别加入60 mL浓HNO3和20 mL浓H2SO4,110 ℃油浴下搅拌回流3 h。反应完成后冷却至室温,用去离子水对经过HNO3-H2SO4预处理的MWCNTs进行抽滤和洗涤,直至滤液的pH值达到中性,80 ℃干燥12 h,备用。
CAC的预处理方法与MWCNTs相同。
1.2.2纳米Au/MWCNTs催化剂制备
溶胶固载法(SIT):移取0.29 mL的HAuCl4溶液(13.80 mg·mL-1),加入141.50 mL超纯水稀释,再加入质量分数2%聚乙烯吡咯烷酮水溶液1.22 mL,搅拌30 min,逐滴加入0.10 mol·L-1硼氢化钠溶液1.33 mL,继续搅拌30 min,得到纳米金溶胶,加入0.50 g的MWCNTs,室温搅拌2 h,抽滤,检至滤液无氯离子,干燥得到催化剂。
等体积浸渍法(IMP):移取0.59 mL的HAuCl4溶液(13.80 mg·mL-1)于25 mL烧杯中,加入1.61 mL超纯水,用氢氧化钠溶液调节pH=7,加入1.00 g的MWCNTs,玻璃棒搅拌5 min,室温超声15 min,室温陈化12 h,100 ℃干燥12 h,冷却后,氨水浸泡12 h,减压抽滤,检至滤液无氯离子后,100 ℃干燥12 h,150 ℃氩气气氛焙烧还原1 h得到催化剂。
1.3催化剂活性评价
采用100 mL间歇式不锈钢高压反应釜进行肉桂醛选择性加氢反应,图1为催化剂活性评价装置。
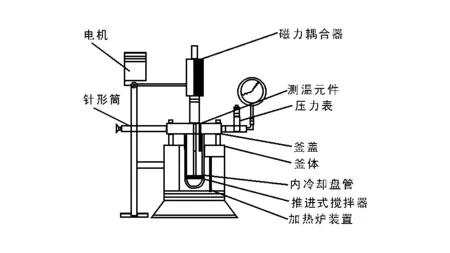
图 1 催化剂活性评价装置Figure 1 Evaluation apparatus of the catalyst activity
依次向反应釜加入2.00 mL肉桂醛、6.00 mL甲醇和0.10 g 的Au/MWCNTs催化剂。密闭反应釜,用氮气置换釜内空气3次,再用氢气置换3次,升温至30 ℃,釜内充氢气至压力4.00 MPa,启动搅拌反应2 h,搅拌速率为1 200 r·min-1。反应结束,过滤并回收催化剂,取滤液2滴,稀释后进气相色谱。过滤后得到的反应液经Agilent-7820A型气相色谱仪分析,色谱条件:柱温180 ℃,气化室温度250 ℃,检测器温度250 ℃,氢气压力0.04 MPa,柱前压力0.06 MPa,HP-5毛细管柱,FID检测器。
式中,fi表示组分i的校正因子,Ai表示组分i的色谱流出峰面积。
表1为以异丙醇作内标物测定各组分的相对质量校正因子,其余产物相对校正因子按异丙醇为单位1计算。

表 1 各组分的相对质量校正因子
1.4载体和催化剂表征
样品比表面积和多孔性结构参数采用日本Bel Sorp-max型物理吸附仪进行,称取一定量样品置于样品管,150 ℃真空处理12 h,液氮温度下测定,根据BET法计算样品的比表面积,BJH法得到样品的孔径分布。
样品的晶体结构参数采用X′pert PRO型粉末衍射仪获取,Cu靶,λ=0.154 056 0 nm,工作电压40 kV,工作电流40 mA,扫描角度0.3°~90°,由谢乐方程计算得到样品的晶粒度。
采用JEOL JEM-2100型高分辨透射电子显微镜(TEM)观测载体表面金颗粒大小及分散情况,工作电压200 kV,选取TEM照片中50个颗粒量取其粒径,用于绘制粒径分布图。样品前处理采用研磨悬浮法,先将样品研磨成较细粉末,取适量粉末放入盛有乙醇的样品管中,超声分散35 min。吸取分散好的悬浮液,滴在覆有碳膜的铜网上,空气中自然干燥,使试样粉末自然沉积在碳膜上。将载有样品的铜网装入样品室,即可对样品进行观察。
利用Thermo Scientific K-Alpha X射线光电子能谱仪测定催化剂的Au 4f7/2的XPS谱图。样品在150 ℃和10-6Pa条件下真空处理12 h,用单色化Al-K 射线(1 486 eV)激发,分析室真空度为10-9Pa,电子结合能以污染碳C1s(284.8 eV)为对照进行校正。
2结果与讨论
2.1IR
图2为HNO3-H2SO4处理后MWCNTs和CAC的IR谱图。
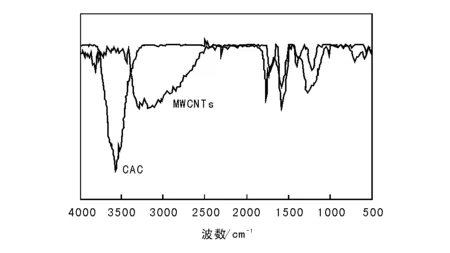
图 2 HNO3-H2SO4处理后MWCNTs和CAC的IR谱图Figure 2 IR spectra of MWCNTs and CAC pretreated with HNO3-H2SO4
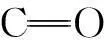
2.2N2吸附-脱附
对比HNO3-H2SO4处理前后的MWCNTs,经HNO3-H2SO4处理的CAC增加了较多的醇或酚—OH基团,含氮基团浓度更高,浸渍过程中提供了大量的活性相的负载位,有利于活性相金的高分散与牢固锚定。表2为HNO3-H2SO4处理前后的MWCNTs和CAC的比表面积、孔容和平均孔径。由表2可以看出,经HNO3-H2SO4处理后的MWCNTs和CAC的比表面积、孔容和平均孔径均有所增加。主要原因是HNO3-H2SO4具有强氧化性,能与MWCNTs和CAC的本体碳元素发生氧化还原反应,使MWCNTs管壁和CAC管壁受到强氧化性“腐蚀”,甚至部分原本很薄的封闭孔道壁被“腐蚀”打开,形成新的孔道,另外,MWCNTs和CAC中包夹的部分酸溶性杂质被HNO3-H2SO4强酸溶解,形成水溶性盐被洗脱去除,形成空腔,使孔径变大,孔容和BET比表面积增大。
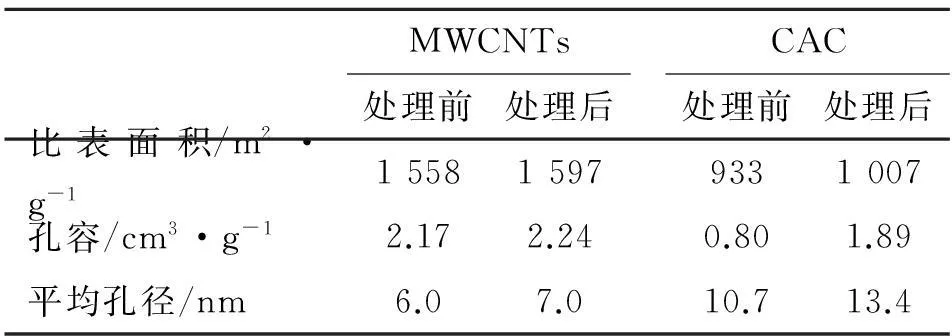
表 2 HNO3-H2SO4处理前后的MWCNTs和CAC的
2.3TEM
图3为采用不同方法经HNO3-H2SO4处理前后MWCNTs和CAC的TEM照片。

图 3 采用不同方法经HNO3-H2SO4处理前后MWCNTs和CAC的TEM照片Figure 3 TEM images of MWCNTs and CAC before and after being pretreated with HNO3-H2SO4 by different methods(a) 处理前MWCNTs;(b) 处理后MWCNTs;(c) 处理前CAC;(d) Au/MWCNTs-SIT; (e) Au/MWCNTs-IMP;(f) Au/CAC-IMP
由图3可以看出,处理前MWCNTs堆叠,卷曲,相互缠绕,端口封闭,里边含有部分杂质,经过HNO3-H2SO4处理后,管与管之间的缠绕度降低,相对分散,管长变短,排布较规整,且部分管的端口打开。表明经HNO3-H2SO4处理后,MWCNTs上的杂质被氧化除去,弯曲处的五元碳环和七元碳环断裂,而且管的两端端口打开,与表2结果吻合。这样既增加了MWCNTs的比表面积,也为MWCNTs的孔道内壁负载金属提供可能。
由图3还可以看出,图3(d)中小黑点为金纳米粒子,纳米金分散较均匀,颗粒尺寸约5 nm;图3(e)为采用等体积浸渍法制备的催化剂,颗粒尺寸相对较大,纳米粒子明显聚集,堆叠,平均粒径约25 nm,分散不均匀。表明制备方法对载体上负载的活性组分金粒径尺寸控制有较大影响,与等体积浸渍法相比,溶胶固载法可以得到粒径更小的金催化剂。图3(f)中多数金粒子约为21 nm,分布较均匀,主要是酸处理的CAC提供了金负载活性位,提高了金属分散度。图中还有小部分金粒子约为50 nm,主要由于酸处理后的CAC表面的含氧基团和含氮基团浓度大以及金极易团聚的特性导致纳米Au/CAC-IMP催化剂有大颗粒金团聚。但金粒子在活性炭表面的分布整体较均匀,多位于活性炭的边、角和棱等部位负载。对比等体积浸渍法制备的纳米Au/MWCNTs催化剂,纳米Au/CAC催化剂粒子略小,分布相对更分散。
2.4XRD
图4为MWCNTs、CAC、Au/MWCNTs-SIT、Au/MWCNTs-IMP和纳米Au/CAC-IMP催化剂的XRD图。
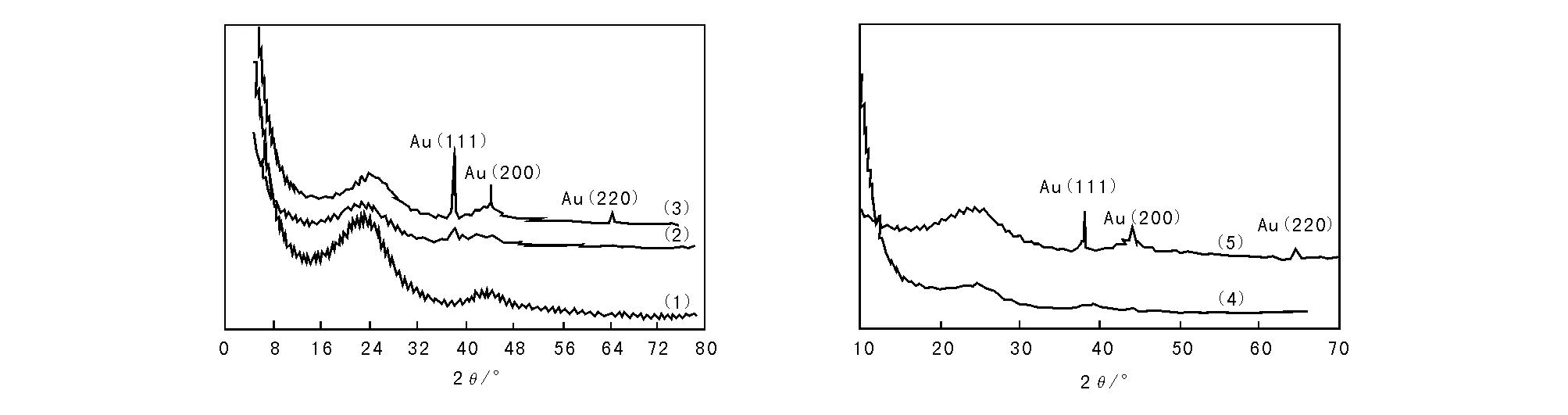
图 4 MWCNTs、CAC、Au/MWCNTs-SIT、Au/MWCNTs-IMP和纳米Au/CAC-IMP催化剂的XRD图Figure 4 XRD patterns of MWCNTs,CAC,Au/MWCNTs-SIT,Au/MWCNTs-IMP and Au/CAC-IMP catalysts (1) MWCNTs, (2) Au/MWCNTs-SIT;(3) Au/MWCNTs-IMP;(4) CAC;(5) Au/CAC-IMP
由图4可以看出,38.2°、44.4°和65.0°出现的特征峰分别归属为活性相金的(111)、(200)和(220)衍射晶面[10],曲线(1)为处理前MWCNTs的无定形特征包峰,在24°和44°处有较宽泛的吸收峰,曲线(2)为溶胶固载法制备的金催化剂,其特征吸收峰相对较弱,在44.4°处金的特征峰和MWCNTs的有重叠,38.2°处出现的Au(111)特征峰,通过谢乐公式计算得出,纳米金平均粒径约5 nm。曲线(3)为等体积浸渍法制备的金催化剂,具有明显的特征吸收峰,在38.2°、44.4°和65.0°处均出现金的3个明显特征峰,其特征峰尖锐,表明纳米金结晶
度较高,颗粒尺寸较大,通过谢乐公式计算,平均粒径约为25 nm,与TEM表征结果吻合。曲线(4)为无定形的CAC,在24°和38°处有较宽泛的吸收峰,曲线(5)为纳米Au/CAC-IMP催化剂,具有明显的特征吸收峰,与纳米Au/MWCNTs-IMP类似,在38.2°、44.4°和65.0°处均出现金的明显特征峰,其特征峰较尖锐,表明纳米金结晶度较高,通过谢乐公式计算,平均粒径约为23 nm,与TEM表征结果吻合。
2.5XPS
图5为Au/MWCNTs-SIT、Au/MWCNTs-IMP和 Au/CAC-IMP纳米金催化剂的XPS谱图。
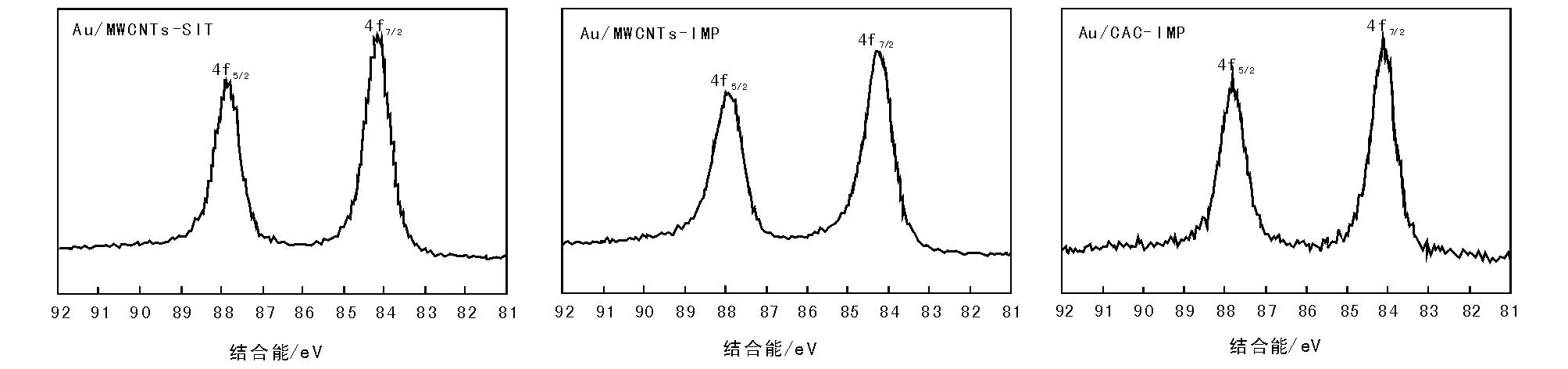
图 5 Au/MWCNTs-SIT、Au/MWCNTs-IMP和 Au/CAC-IMP催化剂的XPS谱图Figure 5 XPS spectra of Au/MWCNTs-SIT,Au/MWCNTs-IMP and Au/CAC-IMP catalysts
Au0的Au4f7/2结合能为83.8 eV,图5显示的XPS吸收峰位置与趋势基本相近。Au/MWCNTs-SIT催化剂的Au 4f7/2的结合能向高能位移,表明金是带有部分正电荷的Auδ+粒子。除了金和碳元素外,催化剂表面还检测到氧元素和氮元素,表明MWCNTs和CAC在HNO3-H2SO4预处理表面修饰时引入含氧和含氮基团,与IR结果吻合。
2.6纳米金催化剂的催化加氢性能
纳米金催化剂在肉桂醛加氢反应中的催化加氢性能见表3。
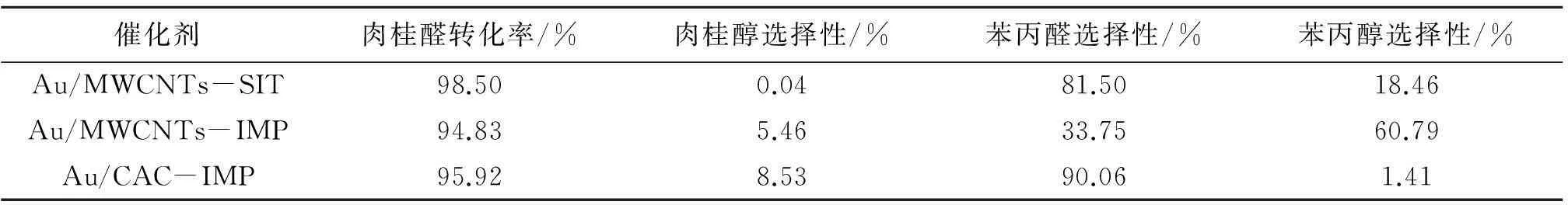
表 3 纳米金催化剂的催化加氢性能

采用等体积浸渍法制备的Au/CAC-IMP催化剂对肉桂醛的催化加氢活性与Au/MWCNTs-IMP催化剂接近,苯丙醛选择性达90.06%,表明载体种类影响纳米金催化剂对肉桂醛的催化加氢选择性。MWCNTs具有特殊的狭长孔道,苯丙醛分子在其中扩散,与孔道壁表面金粒子进一步接触,造成深度加氢形成苯丙醇,而CAC中大孔道短,避免了苯丙醛深度加氢。
3结论
(1) HNO3-H2SO4预处理在碳载体表面形成大量的含氧基团和含氮基团,增大了碳载体的孔径、比表面积和孔容。

(3) 以椰壳活性炭为载体,采用等体积浸渍法制备的Au/CAC-IMP催化剂催化肉桂醛加氢转化率和苯丙醛选择性均高于多壁碳纳米管。
参考文献:
[1]Galvagno S,Donato A,Neri G,et al.Selective hydrogenation of cinnamaldehyde over Ru-Sn catalysts[J].Journal of Molecular Catalysis A,1993,78(2):227-236.
[2]Poltarzewski Z,Galvagno S,Pietropaolo R,et al.Hydrogenation of α,β-unsaturated aldehydes over Pt Sn/nylon[J].Journal of Catalysis,1986,102(1):190-198.
[3]Coq B,Kumbhar P S,Moreau C,et al.Liquid phase hydrogenation of cinnamaldehyde over supported ruthenium catalysts:influence of particle size,bimetallics and nature of support[J].Journal of Molecular Catalysis,1993,85(2):215-228.
[4]Cordier G,Colleuille Y,Fouilloux P,et al.Catalyst parles Métaux[M].Paris:Editions du CNRS,1984.
[5]Milone C,Trapni M C,Galvagno S.Synthesis of cinnamyl ethyl ether in the hydrogenation of cinnamaldehyde on Au/TiO2catalyst[J]. Applied Catalysis A:General,2008,337(2):163-167.
[6]Milone C,Risafulli C,Ingoglia R,et al.A comparative study on the selective hydrogenation of alpha,beta unsaturated aldehyde and ketone to unsaturated alcohols on Au supported catalyst[J].Catalysis Today,2007,122(3/4):341-351.
[7]Bus E,Prinsm R,Bokhoven J.Origin of the cluster-size effect in the hydrogenation of cinnamaldehyde over supported Au catalyst[J].Catalysis Communications,2007,8(9):1397-1402.
[8]Auer E,Freund A,Pietsch J,et al.Carbons as supports for industrial precious metal catalysts[J].Applied Catalysis A:General,1998,173(2):259-271.
[9]Nalini K,Li J,Albert V M.The effect of Pd precursor and pretreatment on the adsorption and adsorption behavior of supported Pd catalysts[J].Applied Catalysis A:General,1998,173(2):137-144.
[10]Tanaka S,Nishiyama N,Egashira Y,et al.Enhancement of structural stability of mesoporous silica thin films prepared by spin-coating[J].Chemistry of Materials,2002,14(10):4229-4234.
[11]李哲.金催化氢化丙烯醛及载体效应的理论研究[D]. 南京:南京大学,2010.
Li Zhe.Theoretical study on acrolein hydrogenation by gold catalysis and the support effect[D].Nanjing:Nanjing University,2010.
CLC number:O643.36;TQ426.6Document code: AArticle ID: 1008-1143(2016)03-0048-06
Preparation of nano Au-supported carbon catalysts and their catalytic performance for selective hydrogenation of cinnamicaldehyde
YiXiujuan1,ZengLihui1,2*,HaoZhengping1,3
(1.Key Laboratory of Applied Surface and Colloid Chemistry of Ministry of Education,School of Chemistry & Chemical Engineering, Shaanxi Normal University, Xi’an 710119, Shaanxi, China;2.Xi’an Catalysis & New Materials Co., Ltd, Xi’an 710201, Shaanxi, China;.Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China)
Abstract:Nano Au catalysts supported on multi-wall carbon nanotubes(MWCNTs) and coconut activated carbon(CAC) were prepared by the sol-gel immobilization technology(SIT) and the impregnation method(IMP), respectively. Carbon supports and nano Au catalysts were characterized by N2 adsorption-desorption, XRD, TEM and XPS techniques. The catalytic performance of the catalysts for the selective hydrogenation of cinnamaldehyde was evaluated. The results showed that the concentrations of the oxygen-containing groups and nitrogen-containing groups on the surface of carbon supports were increased after pretreating with HNO3-H2SO4 mixed acids. The selectivity of the and/or bonds hydrogenated products in the selective hydrogenation of cinnamaldehyde was significantly affected by the carbon materials and the catalyst preparation methods. The catalyst prepared by the SIT method favored the selectivehydrogenation of bonds while the catalyst synthesized by the IMP method tended to the selective hydrogenation of bonds. Moreover, Au/CAC catalyst exhibited clearly better catalytic performance than Au/MWCNTs catalyst for the selective hydrogenation of bonds in the selective hydrogenation of cinnamaldehyde.
Key words:catalytic chemistry; multi-wall carbon nanotubes; coconut activated carbon; nano gold; cinnamicaldehyde; hydrogenation
中图分类号:O643.36;TQ426.6
文献标识码:A
文章编号:1008-1143(2016)03-0048-06
doi:10.3969/j.issn.1008-1143.2016.03.007 10.3969/j.issn.1008-1143.2016.03.007
作者简介:伊秀娟,1988年生,女,山西省朔州市人,在读硕士研究生,研究方向为多相催化。
收稿日期:2015-12-015;修回日期:2016-01-25
催化剂制备与研究
通讯联系人:曾利辉,1981年生,男,博士,高级工程师,研究方向为多相催化及催化剂、负载型贵金属催化剂及应用。
