Cu-Mn氧化物催化N2O直接分解性能
2016-06-01胡晓波王勇宁王永钊赵永祥
石 晶,胡晓波,李 潇,王勇宁,王永钊,赵永祥
(山西大学化学化工学院 精细化学品教育部工程研究中心,山西 太原 030006)
Cu-Mn氧化物催化N2O直接分解性能
石晶,胡晓波,李潇,王勇宁,王永钊*,赵永祥*
(山西大学化学化工学院 精细化学品教育部工程研究中心,山西 太原 030006)
摘要:分别以Cu(NO3)2·3H2O和50%Mn(NO3)2水溶液为铜源和锰源,K2CO3为沉淀剂,采用沉淀法和共沉淀法制备单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂,用于催化N2O直接分解反应,并利用N2物理吸附-脱附、XRD、FT-IR和TPR等进行表征。结果表明,单一Cu和Mn氧化物分别以体相CuO和Mn2O3物相形式存在,Cu-Mn-O复合氧化物中除形成CuMn2O4尖晶石物相外,还有一定量小晶粒CuO,较单一氧化物具有更加优异的还原性能,表现出较高的催化N2O直接分解活性。在空速10 000 h-1和N2O体积分数0.1%条件下,Cu-Mn-O复合氧化物催化剂可在440 ℃催化N2O完全分解,分别较单一Cu和Mn氧化物催化剂降低了40 ℃和60 ℃。
关键词:催化化学;CuO;Mn2O3;CuMn2O4;Cu-Mn 氧化物;N2O催化分解
N2O广泛应用于工业及医学领域,N2O不仅可破坏臭氧层[1],同时还是一种温室气体,其全球升温潜能值分别是CO2的310倍和CH4的21倍[2],已明确提出限制CO2、CH4、N2O、O3、氢氟氯碳化物类和全氟碳化物等6种重要温室气体的排放[3],N2O的排放控制和消除受到关注。
N2O主要来源于工业己二酸、硝酸及化肥生产[4-5]、使用硝酸为氧化剂的化工过程、流化床中煤的燃烧[6]以及汽车尾气中NOx的消除过程[7]等。目前,N2O催化消除的方法主要有直接催化分解法和选择性催化还原法。直接催化分解是一种经济有效的方法,对其催化体系的研究集中在金属催化剂[8-9]、分子筛催化剂[10-11]和金属氧化物催化剂[12-15],其中,金属氧化物催化剂因制备方法简单、组成结构多样和活性中心易于调变以及具有较高的催化活性,受到研究者青睐。
Yamashita T等[13]从动力学和热力学方面研究了Mn系列氧化物催化分解N2O性能,发现不同价态Mn氧化物催化活性存在较大差异,Mn3O4和Mn2O3表现出较其他Mn氧化物更高的活性。Bennici S等[14]研究了改性Si载体上高分散CuO对氮氧化物(N2O、NO、NO2)的催化分解活性,结果表明,偏酸性载体负载的CuO对氮氧化物催化活性显著提高,复合氧化物比单一氧化物具有更高的催化活性。薛莉等[15]通过共沉淀法制备了系列Co-M(M=La,Ce,Fe,Mn,Cu,Cr)及Co3O4催化剂,考察N2O催化分解活性,研究发现,Co-Ce复合氧化物较单一Co3O4及其他复合氧化物催化剂具有更高的活性,且掺杂不同过渡金属的复合氧化物催化剂上N2O分解反应速控步骤不同。Cu-Mn复合氧化物催化剂不仅具有较高的催化活性,而且廉价易得,对环境友好,广泛应用于CO氧化消除、VOCs催化燃烧和精细化学品催化合成等。
张燕等[16]考察了共沉淀法制备的Cu-Mn-O催化剂对甲苯燃烧的催化性能,研究发现,醇洗后制备的纳米Cu-Mn-O催化剂颗粒分散度好,晶粒大小直接影响其催化活性。Li X Q等[17]研究发现,共沉淀法制备的Cu-Mn催化剂在无溶剂条件下,对甲苯液相氧化反应有较好的催化活性,并指出其催化活性相为Cu1.5Mn1.5O4。
本文分别以Cu(NO3)2·3H2O和50%Mn(NO3)2水溶液为铜源和锰源,K2CO3为沉淀剂制备催化剂,用于催化N2O直接分解反应,考察单一Cu和Mn氧化物催化剂及Cu-Mn-O复合氧化物催化剂对N2O催化分解性能,并利用N2物理吸附-脱附、XRD、FT-IR和TPR等进行表征。
1实验部分
1.1试剂
Cu(NO3)2·3H2O,分析纯,天津市大茂化学试剂厂;50%Mn(NO3)2水溶液,分析纯,北京化工厂;K2CO3,分析纯,天津市凯通化学试剂有限公司。
1.2催化剂制备
采用共沉淀法制备Cu-Mn-O复合氧化物催化剂,分别称取一定量的Cu(NO3)2·3H2O和50%Mn(NO3)2水溶液于室温下混合均匀,其中,Cu2+和Mn2+物质的量比为2∶1,不断搅拌均匀滴入2 mol·L-1的K2CO3溶液,至体系pH=8,继续搅拌2 h,静置老化3 h,再经抽滤和水洗,至滤液pH=7,110 ℃干燥10 h,将干燥后的样品在500 ℃焙烧4 h,制得催化剂样品,单一Cu和Mn氧化物制备方法与以上催化剂样品制备方法相同。催化剂经压片筛分,取粒径(40~60)目用于活性评价。
1.3催化剂表征
低温N2物理吸附-脱附测定使用美国麦克仪器公司ASAP-2020型物理吸附仪,催化剂预先在150 ℃真空条件下脱气预处理5 h,液氮浴条件下进行N2吸附-脱附测定,分别通过BET公式和BJH模型计算样品的比表面积和孔径分布。
使用德国布鲁克公司D8-Advance型X射线粉末衍射仪室温下进行催化剂XRD表征,CuKα,λ=0.154 18 nm,Ni滤波,工作电压40 kV,工作电流40 mA,扫描范围10°~80°,步长0.02°,扫描速率2.4°·min-1,万特探测器检测。
采用德国布鲁克公司Tensor27傅里叶变换红外光谱仪对催化剂进行红外光谱测定,样品与溴化钾以质量比1∶100混合,研磨制片,室温下对催化剂进行测定,分辨率4 cm-1,扫描范围(400~1 300) cm-1。
使用美国麦克仪器公司AutochemⅡ 2920型化学吸附分析仪进行催化剂的H2-TPR表征,将30 mg[(40~60)目]催化剂置于反应管,通入5%H2-N2混合气,流量20 mL·min-1,待基线平稳后,以10 ℃·min-1升温速率程序升温至700 ℃,采用热导池检测器(TCD)检测耗氢量。
1.4催化剂评价
N2O催化分解活性评价在连续流动微反装置上进行,原料气中N2O体积分数0.1%,Ar为平衡气,原料气总流量50 mL·min-1,空速10 000 h-1。反应物和产物采用装有Propark Q填充柱的GC-930型气相色谱仪在线检测,热导池检测器(TCD),载气为He。催化活性用N2O转化率评价,按下式计算:

2结果与讨论
2.1催化活性评价结果
单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂N2O催化分解活性如图1所示。
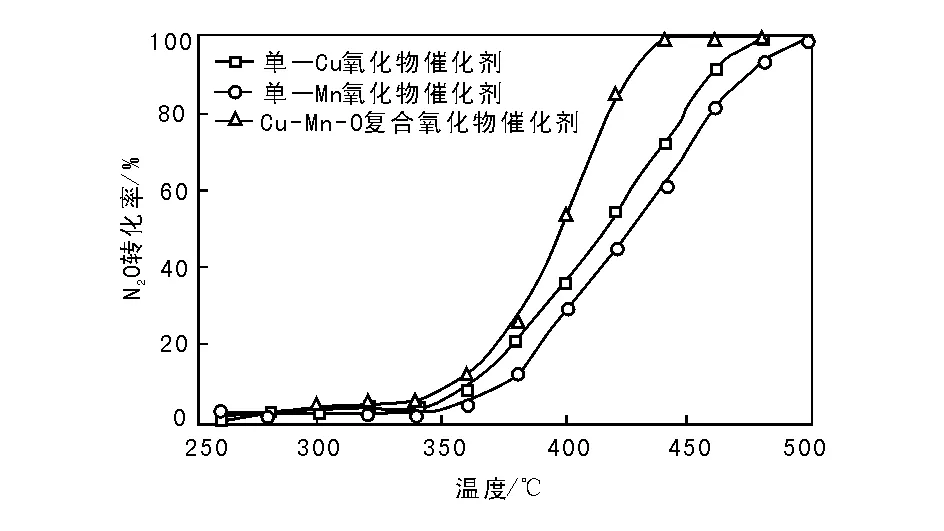
图 1 单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂N2O催化分解性能Figure 1 Catalytic performance of the single oxide and Cu-Mn-O mixed oxide catalysts for direct decomposition of N2O
由图1可以看出,3种催化剂上N2O转化率均随反应温度的升高呈增加趋势。与单一氧化物催化剂相比,Cu-Mn-O复合氧化物催化剂催化活性明显提高,440 ℃时N2O转化率即达到100%,且相同反应温度下,Cu-Mn-O复合氧化物催化剂上N2O转化率高。
2.2N2物理吸附-脱附
图2为单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂的N2物理吸附-脱附曲线。从图2可以看出,单一Cu氧化物催化剂N2物理吸附-脱附曲线未呈现明显的孔结构特征,其他两种催化剂的吸附-脱附曲线均具有Ⅲ型等温线特征,且出现第三类型回滞环,表现出一定的介孔结构特征,主要由催化剂颗粒堆积而成。

图 2 单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂N2物理吸附-脱附曲线Figure 2 N2-physisorption isotherms of the single oxide and Cu-Mn-O mixed oxide catalysts
表1为单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂的织构性质。

表 1 单一Cu、Mn氧化物催化剂和Cu-Mn-O
由表1可见,与单一Cu氧化物催化剂相比,单一Mn氧化物催化剂比表面积和孔容明显提高,平均孔径略增,Cu-Mn-O复合氧化物催化剂比表面积、平均孔径和孔容等织构参数均介于单一Cu、Mn氧化物催化剂之间,与其催化N2O分解活性相关联,认为与单一Cu、Mn氧化物催化剂相比,Cu-Mn-O复合氧化物催化剂织构性质的变化并不是引起催化活性提高的原因。
2.3XRD
图3为单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂的XRD图。从图3可以看出,单一Cu氧化物催化剂在2θ为35.5°、38.7°、48.7°、61.6°、66.3°、67.9°和75.2°处出现的衍射峰归属为晶相CuO的特征衍射峰(JCPDS#41-254),单一Mn氧化物催化剂在2θ为18.1°、23.2°、32.9°、38.2°、49.3°、55.2°和65.8°处出现晶相MN2O3特征衍射峰(JCPDS#41-1442)。与单一Cu、Mn氧化物催化剂相比,Cu-Mn-O复合氧化物催化剂在2θ为18.0°、28.6°、30.5°、35.9°、43.7°、57.8°和63.5°处出现新的衍射峰,归属为CuMn2O4尖晶石物相特征峰(JCPDS#74-2422)[18-19]。
Li X Q等[17]研究Cu-Mn催化剂催化甲苯液相氧化时发现,Cu-Mn催化剂中形成Cu1.5Mn1.5O4活性相,可能与使用的Cu源和Mn源不同有关。此外,Cu-Mn-O复合氧化物催化剂上还出现强度较弱(与单一Cu氧化物相比)的CuO衍射峰,表明Cu-Mn-O复合氧化物催化剂中除形成CuMn2O4尖晶石物相外,还有晶粒较小的CuO物种。

图 3 单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂的XRD图Figure 3 XRD patterns of the single oxide and Cu-Mn-O mixed oxide catalysts(1) 单一Cu氧化物催化剂;(2) 单一Mn氧化物催化剂; (3) Cu-Mn-O复合氧化物催化剂
2.4FT-IR
图4为单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂的FT-IR谱图。

图 4 单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂的FT-IR谱图Figure 4 FT-IR spectra of the single oxide and Cu-Mn-O mixed oxide catalysts(1) 单一Cu氧化物催化剂;(2) 单一Mn氧化物催化剂; (3) Cu-Mn-O复合氧化物催化剂
由图4可以看出,单一Cu氧化物催化剂中出现4个红外吸收峰,其中,448 cm-1处吸收峰由CuO中Cu—O弯曲振动引起,482 cm-1处吸收峰归属为Cu—O对称伸缩振动,在(500~600) cm-1处出现了533 cm-1和591 cm-1劈裂而成的不对称伸缩振动峰[20];单一Mn氧化物催化剂中663 cm-1、609 cm-1、576 cm-1、520 cm-1和444 cm-1处为Mn2O3的特征吸收峰。与单一Cu、Mn氧化物催化剂相比,Cu-Mn-O复合氧化物催化剂只在588 cm-1、533 cm-1和469 cm-1处出现3个红外吸收峰,其中,588 cm-1处归属为铜锰复合氧化物CuMn2O4中处于四面体位的Cu2+引起的Cu—O振动,535 cm-1处仍归属为Cu-Mn-O复合氧化物催化剂中小晶粒CuO的Cu—O伸缩振动,469 cm-1处归属为铜锰复合氧化物CuMn2O4中处于八面体Mn3+引起的Mn—O振动[21-22]。
2.5TPR
图5为单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂的TPR谱图。
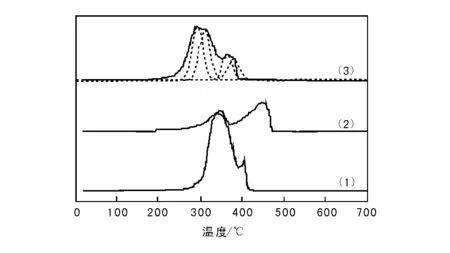
图 5 单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂的TPR谱图Figure 5 TPR profiles of the single oxide and Cu-Mn-O mixed oxide catalysts(1) 单一Cu氧化物催化剂;(2) 单一Mn氧化物催化剂; (3) Cu-Mn-O复合氧化物催化剂
与单一Cu、Mn氧化物催化剂相比,Cu-Mn-O复合氧化物催化剂的还原温度明显向低温方向移动,表明Cu-Mn-O复合氧化物催化剂中形成的CuMn2O4和小晶粒CuO更易于还原。薛莉等[15]在研究Co-M(M=La,Ce,Fe,Mn,Cu,Cr)复合氧化物催化剂N2O直接催化分解性能时发现,添加适量Ce的催化剂,因其提高的催化剂氧化还原能力而表现出较其他催化剂更高的催化活性。Perez-Alonso F J等[24]在研究FexCe1-xO2复合氧化物催化N2O直接分解反应时也认为,Fe掺杂CeO2或Ce掺杂Fe2O3,不仅提高了催化剂比表面积,更重要的是使催化剂易于还原,因而表现出更高的催化活性。Cu-Mn-O复合氧化物催化剂中由于CuMn2O4和小晶粒CuO的形成,变得更加易于还原,因而表现出较单一氧化物催化剂优异的N2O直接催化分解性能。
3结论
(1) 分别采用沉淀法和共沉淀法制得单一Cu、Mn氧化物催化剂和Cu-Mn-O复合氧化物催化剂,N2O直接催化分解活性评价结果表明,Cu-Mn-O复合氧化物催化剂的催化活性高于单一Cu、Mn氧化物催化剂。
(2) 表征结果表明,与单一Cu、Mn氧化物催化剂相比,Cu-Mn-O复合氧化物催化剂中CuMn2O4物相和小晶粒CuO的形成,使其更易于还原,因而表现出优异的N2O催化分解活性。
参考文献:
[1]Dickinson R E,Cicerone R J.Future global warming from atmospheric trace gases[J].Nature,1986,319(6049):109-115.
[2]联合国环境规划署著.刘重业等译.世界环境数据手册[M].北京:中国科学技术出版社,1990.
[3]吴晓蔚,朱法华,杨金田,等.火力发电行业温室气体排放因子测算[J].环境科学研究,2010,23(2):170-176.
Wu Xiaowei,Zhu Fahua,Yang Jintian,et al.Measurements of emission factors of greenhouse gas(CO2,N2O) from thermal power plants in China[J].Research of Environmental Sciences,2010,23(2):170-176.
[4]Pérez-Ramírez J,Kapteijn F,Schöffel K,et al.Formation and control of N2O in nitric acid production:where do we stand today?[J].Applied Catalysis B:Environmental,2003,44(2):117-151.
[5]Pérez-Ramírez J.Prospects of N2O emission regulations in the European fertilizer industry[J].Applied Catalysis B:Environmental,2007,70(1):31-35.
[6]Galle M,Agar D W,Watzenberger O.Thermal N2O decomposition in regenerative heat exchanger reactors[J].Chemical Engineering Science,2001,56(4):1587-1595.
[7]Becker K H,Lörzer J C,Kurtenbach R,et al.Nitrous oxide (N2O) emissions from vehicles[J].Environmental Science & Technology,1999,33(22):4134-4139.
[8]Dacquin J P,Dujardin C,Granger P.Surface reconstruction of supported Pd on LaCoO3:consequences on the catalytic properties in the decomposition of N2O[J].Journal of Catalysis,2008,253(1):37-49.
[9]Doi K,Wu Y Y,Takenda R,et al.Catalytic decomposition of N2O in medical in medical operating rooms over Rh/Al2O3,Pd/Al2O3,and Pt/Al2O3[J].Applied Catalysis B:Environmental,200l,35(1):43-51.
[10]Pirngruber G D,Roy P K,Prins R.The role of autoreduction and of oxygen mobility in N2O decomposition over Fe-ZSM-5[J].Journal of Catalysis,2007,246(1):147-157.
[11]Smeets P J,Meng Q,Corthals S,et al.Co-ZSM-5 catalysts in the decomposition of N2O and the SCR of NO with CH4:influence of preparation method and cobalt loading[J].Applied Catalysis B:Environmental,2008,84(3):505-513.
[12]Giecko G,Borowiecki T,Gac W,et al.Fe2O3/Al2O3catalysts for the N2O decomposition in the nitric acid industry[J].Catalysis Today,2008,137(2):403-409.
[13]Yamashita T,Vannice A.N2O decomposition over manganese oxides[J].Journal of Catalysis,1996,161(1):254-262.
[14]Bennici S,Gervasini A.Catalytic activity of dispersed CuO phases towards nitrogen oxides(N2O,NO,and NO2)[J].Applied Catalysis B:Environmental, 2006,62(3):336-344.
[15]薛莉,贺泓.Co-M(M=La,Ce,Fe,Mn,Cu,Cr)复合金属氧化物催化分解N2O[J].物理化学学报,2007,23(5):664-670.Xue Li,He Hong.Catalytic decomposition of N2O over Co-M (M=La,Ce,Fe,Mn,Cu,Cr) composite oxide catalysts[J].Acta Physico-Chimica Sinica,2007,23(5):664-670.
[16]张燕,卢晗锋,黄海凤,等.高热稳定性Cu-Mn-O催化燃烧催化剂的制备[J].分子催化,2008,22(6):503-506.
Zhang Yan,Lu Hanfeng,Huang Haifeng,et al.Preparation of the high thermal stable Cu-Mn-O catalysts for VOCs catalytic combustion[J].Journal of Molecular Catalysis,2008,22(6):503-506.
[17]Li X Q,Xu J,Zhou L P,et al.Heterogeneous catalytic oxidation of toluene with molecular oxygen over Cu-Mn oxides[J].Chinese Journal of Catalysis,2006,27(5):369-371.
[18]Tanaka Y,Utaka T,Kikuchi R,et al.Water gas shift reaction for the reformed fuels over Cu/MnO catalysts prepared via spinel-type oxide[J].Journal of Catalysis,2003,215(2):271-278.
[19]Tanaka Y,Takeguchi T,Kikuchi R,et al.Influence of preparation method and additive for Cu-Mn spinel oxide catalyst on water gas shift reaction of reformed fuels[J].Applied Catalysis A:General,2005,279(1):59-66.
[20]王文亮,李东升,王振军,等.CuO超细粉体的形貌与红外特性研究[J].无机化学学报,2002,18(8):823-826.
Wang Wenliang,Li Dongsheng,Wang Zhenjun,et al.Sudy on the morphology and infrared spectrum behavior of ultrafine powder CuO[J].Chinese Journal of Inorganic Chemistry,2002,18(8):823-826.
[21]Hosseini S A,Niaei A,Salari D,et al.Nanocrystalline AMn2O4(A=Co,Ni,Cu) spinels for remediation of volatile organic compounds-synthesis,characterization and catalytic performance[J].Ceramics International,2012,38(2):1655-1661.
[22]Morales M R,Barbero B P,Cadús L E.Evaluation and characterization of Mn-Cu mixed oxide catalysts for ethanol total oxidation:influence of copper content[J].Fuel,2008,87(7):1177-1186.
[23]Clarke T J,Kondrat S A,Taylor S H.Total oxidation of naphthalene using copper manganese oxide catalysts[J].Catalysis Today,2015,258(2):610-615.
[24]Perez-Alonso F J,Melián-Cabrera I,Granados M L,et al.Synergy of FexCe1-xO2mixed oxides for N2O decomposition[J].Journal of Catalysis,2006,239(2):340-346.
CLC number:O643.36;TQ426.6Document code: AArticle ID: 1008-1143(2016)03-0042-06
Catalytic decomposition of N2O over Cu-Mn oxide catalysts
ShiJing,HuXiaobo,LiXiao,WangYongning,WangYongzhao*,ZhaoYongxiang*
(School of Chemistry and Chemical Engineering, Engineering Research Center for Fine Chemicals of Ministry of Education, Shanxi University, Taiyuan 030006, Shanxi, China)
Abstract:Using aqueous solution of Cu(NO3)2·3H2O and 50%Mn(NO3)2 as raw material,and K2CO3 as the precipitator, respectively, the single Cu oxide,Mn oxide and Cu-Mn-O composite oxide catalysts were prepared by the precipitation and co-precipitation methods.The catalytic performance of as-prepared catalysts for the catalytic decomposition of N2O was investigated. The structure and properties of the catalysts were characterized by N2-physisorption,XRD,FT-IR and TPR. The results showed that there existed CuO phase and Mn2O3 phase respectively in the single Cu and Mn oxides. There was a certain amount of small crystalline grain CuO besides the new formed spinel phase CuMn2O4 in Cu-Mn-O composite oxide, which possessed better reducibility than the single oxides. Under the reaction condition of N2O content 0.1% and GHSV 10 000 h-1, Cu-Mn-O composite oxide exhibited better catalytic activity for the direct decomposition of N2O, and the conversion of 100% could be obtained at 440 ℃, which was lower 40 ℃ and 60 ℃ than that over the single Cu oxide and Mn oxide, respectively.
Key words:catalytic chemistry; CuO; Mn2O3; CuMn2O4; Cu-Mn oxide; N2O catalytic decomposition
中图分类号:O643.36;TQ426.6
文献标识码:A
文章编号:1008-1143(2016)03-0042-06
doi:10.3969/j.issn.1008-1143.2016.03.006 10.3969/j.issn.1008-1143.2016.03.006
作者简介:石晶,1990年生,女,山西省霍州市人,在读硕士研究生。
基金项目:国际合作基金项目(2013DFA40460);山西省科技创新重点团队基金项目(2012021007)
收稿日期:2016-01-07
催化剂制备与研究
通讯联系人:王永钊,男,副教授,硕士研究生导师;赵永祥,男,教授,博士研究生导师。
