鹿茸水提物减轻顺铂所致的小鼠肾损伤*
2016-06-01董思敏王海璐王全凯
董思敏, 王海璐, 王全凯△, 张 晶△
(1吉林农业大学中药材学院,吉林 长春 130118; 2长白山制药股份有限公司,吉林 吉林 132100)
鹿茸水提物减轻顺铂所致的小鼠肾损伤*
董思敏1,2, 王海璐1, 王全凯1△, 张 晶1△
(1吉林农业大学中药材学院,吉林 长春 130118;2长白山制药股份有限公司,吉林 吉林 132100)
目的: 探讨梅花鹿二杠茸和三岔茸水提物对顺铂(CDDP)所致小鼠肾损伤的影响。方法: 采用灌胃给药方式,用顺铂(15 mg/kg)诱导小鼠肾损伤模型,测定小鼠肾脏指数(KI)、血清肌酐(SCr)、血尿素氮(BUN)、肾脏组织中超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)含量,并对肾脏组织进行HE染色,观察肾脏病理学变化,研究梅花鹿二杠茸和三岔茸的水提物各剂量对小鼠肾损伤的影响。结果: 与顺铂组相比,各剂量鹿茸水提物可显著降低CDDP诱导肾损伤小鼠SCr、BUN水平及肾脏MDA含量,提高SOD和GSH-Px的活性(P<0.05);明显改善肾组织病理学形态,减轻CDDP对肾小管上皮细胞的损伤程度,且同等浓度下,与三岔茸相比,二杠茸水提物能更好地改善肾功能及减轻病理损伤。结论: 鹿茸水提物减轻顺铂引起的小鼠肾损伤,其作用机制可能与鹿茸水提物增强小鼠肾脏组织的抗氧化能力有关。
鹿茸水提物; 顺铂; 肾毒性; 抗氧化作用
鹿茸为鹿科动物梅花鹿(CervusnipponTemminck)或马鹿(CervuselaphusLinnaeus)的雄鹿未骨化密生茸毛的幼角。花鹿茸呈圆柱状分枝,具一个分枝者习称“二杠”,具二个分枝者,习称“三岔”。鹿茸作为我国传统的珍贵药材,具有壮肾阳、益精血、强筋骨等功效[1]。
顺铂(cisplatin,CDDP)是临床化疗最常用的药物之一[2],但其在肾组织内的蓄积可引起肾损伤[3],其疗效与用药剂量成正比[4]。肾毒理学研究认为CDDP肾损伤主要与氧化应激机制有关[5],其临床应用剂量受到限制[6]。据报道,鹿茸水提物具有清除自由基、抗炎、抗氧化、抗肿瘤、增强免疫等作用[7],其是否对CDDP诱导肾损伤有影响则未见报道。本研究旨在比较二杠茸和三岔茸水提物对CDDP肾毒性小鼠肾功能、肾组织形态学和氧化指标的影响,为鹿茸在CDDP肾毒性治疗中的应用提供可靠的理论依据。
材 料 和 方 法
1 动物及实验材料
64只清洁级健康ICR雄鼠(长春市亿斯实验动物技术有限责任公司),体重(20±2)g。小鼠室温饲养,每天更换垫料1次,自由饮食饮水。
梅花鹿二杠茸和三岔茸于2014年采购于吉林省吉云集团鹿产品加工有限责任公司,经吉林农业大学中药材学院王全凯教授鉴定为梅花鹿(CervusnipponTemminck)茸。将鹿茸粉碎过80目筛,于-80 ℃保存备用。
2 主要试剂及仪器
顺铂(上海思域化工科技有限公司,纯度>99%,pt>65%);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、血尿素氮(blood urea nitrogen,BUN)、血清肌酐(serum crea-tinine,SCr)及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒均购自南京建成生物工程研究所;氯化钠注射液(吉林省都邦药业股份有限公司);中性树胶封片剂(武汉百浩天生物科技有限公司);高效切片石蜡(上海华永石蜡有限公司);无水乙醇、甲醛、二甲苯、苏木素、伊红,均为分析纯。
TGL-16G高速离心机(上海安亭科学仪器厂);XSP-BM-8CA生物显微镜(上海彼爱姆光学仪器制造有限公司);石蜡切片机(Leica);DG5033A型酶联免疫检测仪(北京华运安特科技有限责任公司);KQ-250DB台式数控超声波清洗器(昆山市超声仪器有限公司);1 mL无菌注射器配灌胃针头(江西洪达医疗器械集团有限公司)。
3 主要方法
3.1 给药组溶液的配制 准确称取二杠茸粉末及三岔茸粉末各10 g,分别置于锥形瓶内,以水为溶剂,室温下超声提取2次,每次用水100 mL,超声提取0.5 h,过滤,合并提取液,将提取液冷冻干燥,即得二杠茸水提物和三岔茸水提物。精密称取2种水提物各1 g、2 g和4 g,分别溶于100 mL水中,即得各样品的低剂量(low dose, L;100 mg/kg)、中剂量(medium dose, M;200 mg/kg)和高剂量(high dose, H;400 mg/kg)。二杠茸水提物各剂量组分别为DL、DM和DH组;三岔茸水提样各剂量组分别为TL、TM和TH组。
3.2 CDDP溶液的配制 精密称取CDDP 31.5 mg溶于21 mL氯化钠注射液中,配制成1.5 g/L浓度的CDDP溶液,超声30 min,使其充分溶解,得模型组溶液。
3.3 实验动物分组及给药 将实验动物饲养1周调节其适应性,随机分为8组,每组8只,灌胃(intragastric administration,ig)方式给药,每次用药体积均为0.01 mL/g。空白对照组(control group,Con)和CDDP组第 1~8天均给予与给药组等量的生理盐水,每天1次;给药组每天按照剂量ig给药1次,连续给药7 d,第8天正常喂养,并于第9天给药1 h后对给药组和CDDP组均单次ig CDDP溶液(15 mg/kg)。给予CDDP 72 h后解剖,解剖前12 h对小鼠禁食不禁水,按照给药、造膜顺序依次对各组小鼠进行眼球取血,4 000 r/min离心10 min分离血清,4 ℃保存待检测主要肾功能指标;沿腹中线迅速解剖,用生理盐水冲洗肾组织,滤纸吸干,称重,于10%的甲醛溶液中固定5d,进行HE染色,观察肾脏组织病理学改变。
3.4 观察小鼠状况及指标检测 每天按照固定时间给药后称重,观察小鼠状态、毛色和活动情况,记录各组小鼠摄食量、饮水量及体重变化,并按照公式:肾脏指数(kidney index,KI;%)=肾脏重量(g)/体重(g)×100%,计算各组小鼠肾脏指数。
BUN含量采用脲酶法,SCr含量采用肌氨酸氧化酶法,SOD活性测定采用WST-1法,GSH-Px活性测定采用微量酶标法, MDA含量测定采用TBA法,均严格按照试剂盒使用方法进行操作。
3.5 肾组织HE染色 将置于10%的甲醛溶液中固定的左肾脏组织取出,沿冠状面切成两半,将4 mm×3 mm×3 mm大小的肾块置于包埋盒中,经流动水冲洗以除去甲醛,按照低浓度至高浓度乙醇脱水,二甲苯透明,置于60 ℃的软蜡Ⅰ、Ⅱ及硬蜡Ⅰ、Ⅱ,将浸蜡的肾组织放入装有熔化石蜡的包埋铁盒内,晾干。石蜡切片机切片(片厚5 μm),于30 ℃水浴锅内展开后于80 ℃烘箱烘烤2 h,再进行HE染色,用中性树胶封片,于光学显微镜(×400)下观察肾脏组织细胞数量、形态、细胞间质等肾脏结构病理学改变并摄片。
4 统计学处理
实验数据采用均数±标准差(mean±SD)表示,用SPSS 19.0统计软件进行分析,多组间均数比较采用单因素方差分析(one-way ANOVA),组间两两比较使用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 小鼠的一般情况
小鼠给予CDDP当天便出现摄食量和饮水量下降、活动量减少、体重减轻、卷曲拱背、精神稍有萎靡、形体消瘦、活动迟缓、毛色失泽等现象,而Con组生长情况良好,饮食正常,反应灵敏,无上述现象。治疗组基本无上述现象,诸症有所减轻,反应较灵敏。
2 鹿茸水提物对CDDP致小鼠肾损伤肾脏指数影响
肾脏指数是反映肾脏损伤程度的客观指标,与Con组相比,CDDP组小鼠肾指数显著升高(P<0.05),体重减轻,肾脏有膨大现象,发生急性水肿,代谢器官受损严重;各给药组小鼠肾指数趋于Con组水平而显著低于CDDP组(P<0.05)。给药组随用药剂量加大,肾指数依次减小,表现出一定的剂量依赖关系,同等浓度二杠茸水提物对CDDP引起的肾损伤减轻程度明显优于三岔茸水提物,见图1。
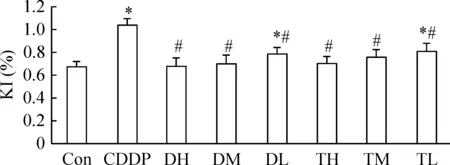
Figure 1.The effect of the aqueous extract of velvet antler on kidney index (KI) of the mice treated with cisplatin. Mean±SD.n=8.*P<0.05vsCon group;#P<0.05vsCDDP group.
图1 鹿茸水提物对小鼠肾脏指数的影响
3 鹿茸水提物对接受CDDP灌胃小鼠BUN和SCr含量的影响
与Con组相比,给予CDDP后,CDDP组小鼠BUN和SCr含量明显升高(P<0.05),说明造模成功;各剂量鹿茸水提取物给药组与CDDP组相比, BUN和SCr的含量均有所下降,差异具有统计学显著性(P<0.05),且存在剂量依赖关系,说明鹿茸水提物能减轻CDDP诱导小鼠急性肾损伤,且同等浓度下二杠茸水提物作用效果优于三岔茸水提物,见图2。
4 鹿茸水提物对接受CDDP灌胃小鼠肾组织中SOD、MDA和GSH-Px的变化
与Con组相比,CDDP组小鼠肾组织中SOD和GSH-Px活性显著降低(P<0.05),MDA含量明显升高(P<0.05);而各给药组小鼠肾组织中SOD和GSH-Px活性与CDDP组相比均有所升高,MDA含量有所下降,除DL、TM和TL组外,其余各组的SOD活性与CDDP组相比差异均具有统计学显著性(P<0.05);除TL组外,其余各组的GSH-Px活性与CDDP组相比差异有统计学显著性(P<0.05);各剂量鹿茸水提取物给药组的MDA含量与CDDP组相比差异均有统计学显著性(P<0.05),表明二杠茸、三岔茸水提物都能显著抑制顺铂引起的肾脏组织 SOD、GSH-Px活性下降和MDA 含量升高;且作用强度存在剂量依赖关系,同等浓度下二杠茸水提物作用效果优于三岔茸水提物,见图3。
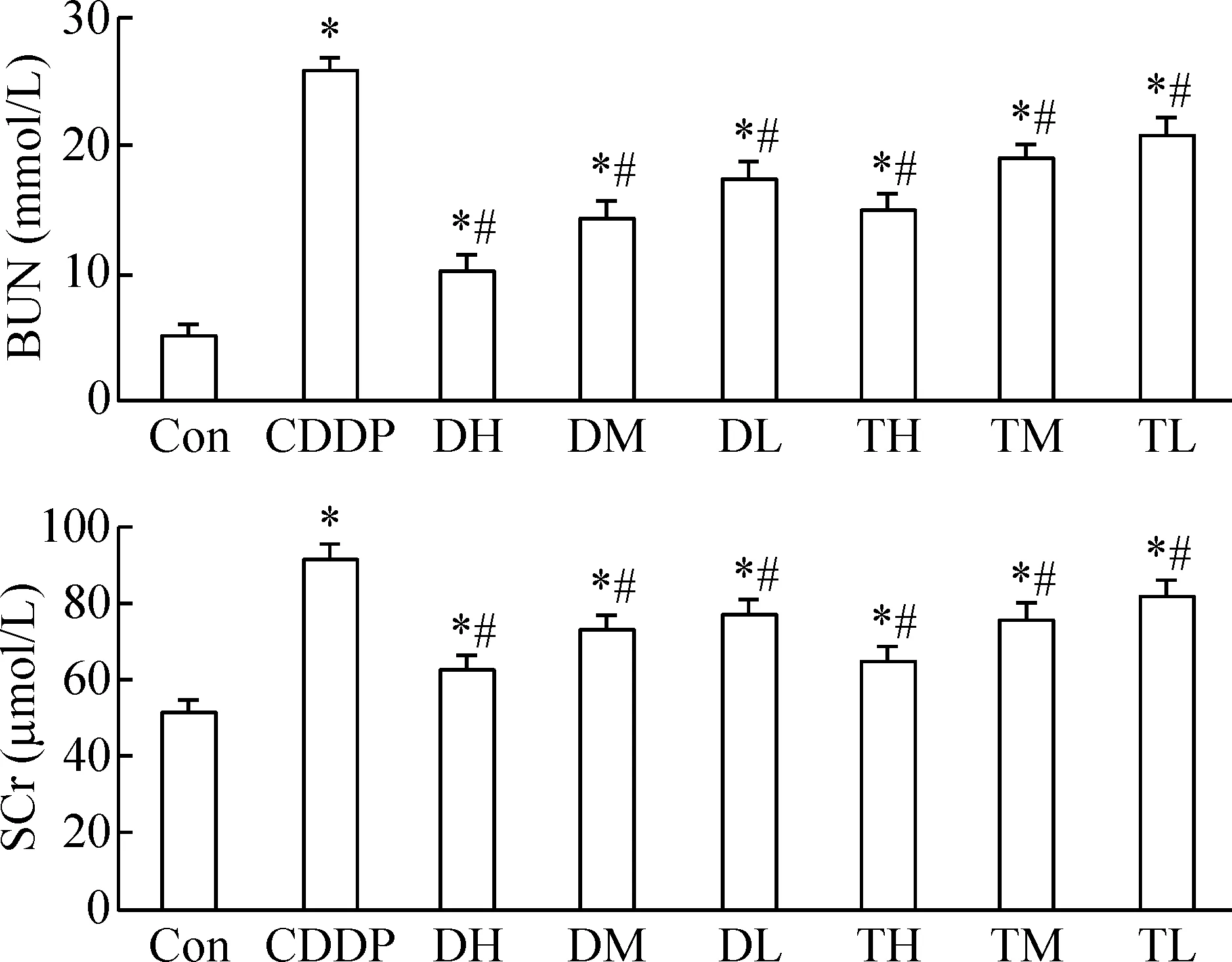
Figure 2.The effects of the aqueous extract of velvet antler on BUN and SCr levels in the mice treated with CDDP. Mean±SD.n=8.*P<0.05vsCon group;#P<0.05vsCDDP group.
图2 鹿茸水提物对CDDP所致小鼠血清BUN、CRE含量的影响

Figure 3.The effects of the aqueous extract of velvet antler on the activitiy of SOD and GSH-Px, and the content of MDA in the mice treated with CDDP. Mean±SD.n=8.*P<0.05vsCon group;#P<0.05vsCDDP group.
图3 鹿茸水提物对CDDP所致小鼠肾组织中SOD、GSH-Px活性和MDA含量的影响
5 肾组织HE染色观察
在分别给予生理盐水、鹿茸水提物或CDDP 72 h后,观察8组小鼠肾脏组织的病理改变。结果发现Con组小鼠的肾组织结构清晰,肾小管排列规则,肾间质及肾小球无充血和炎细胞浸润;CDDP组与Con组相比则出现大面积坏死区域,细胞排列疏松、紊乱,刷状缘消失,部分细胞核消失,肾小管出现明显的萎缩、扩张,坏死的肾小管上皮细胞明显增多,肾近曲小管上皮细胞有空泡变性、坏死,胞质疏松,局部细胞坏死,管腔可见脱落上皮细胞,肾小管出现蛋白管型,管腔狭窄,出现典型的急性肾损伤病理表现;各剂量鹿茸水提取物给药组小鼠的肾组织病理损害明显减轻,随着鹿茸水提物浓度的增加,肾损伤程度减轻,细胞核明显增多,聚集现象减轻,细胞排列逐渐规则,肾小管萎缩程度逐渐减轻,坏死的肾小管上皮细胞明显减少,空泡变性明显减少,细胞排列较规则,胞质疏松程度减少,肾小球和肾小管结构逐渐趋于完整,同等浓度二杠茸水提物作用效果优于三岔茸水提物,见图4。

Figure 4.HE staining of the renal tissues in the mice (×400).
图4 小鼠肾组织HE染色观察
讨 论
中医学认为,CDDP肾毒性属中医“药毒”、“肾虚”范畴。CDDP毒性的本质是肾的精气不足[8]。采用CDDP等肾毒性药物化疗会造成机体组织的损伤[9],减少肾小球滤过率,升高BUN和SCr水平[10],引起肾血管收缩、肾功能损害等症状;其主要靶位是肾小管上皮细胞[11],早期往往首先损害肾近曲小管,导致肾小管细胞结构和功能紊乱等病理改变[12]。西医多通过选择给药时间、控制给药速度和改变给药途径等方法缓解CDDP肾毒性,下午或者傍晚使用CDDP对肾脏的损伤程度最小,毒性最低,这与机体对药物的生物处理和反应呈现出的时间依赖性有关[13]。
机体过量产生活性氧被认为是化疗药物毒副作用的根源[14]。通常情况下,SOD可通过歧化作用清除CDDP代谢过程所产生的氧自由基,保护细胞免受超氧化物自由基的损伤[15]。GSH-Px是体内重要的保护酶类,在细胞保护酶系统中的作用是清除氧自由基[16],能特异地催化还原型谷胱甘肽(GSH)对过氧化氢的还原反应,可以起到保护细胞膜结构和功能完整的作用[17]。脂质过氧化主要产物MDA,其含量变化可反映体内自由基代谢的异常及脂质过氧化速率,因此,MDA含量高低既反映机体脂质过氧化的程度,也间接反映受自由基攻击致肾损害的严重程度[18]。在本实验中,CDDP组小鼠肾组织中的SOD及GSH-Px活性降低,而MDA含量明显升高,CDDP促进肾组织脂质过氧化形成,使体内抗氧化能力降低,体内不能清除过多的自由基,从而促进了氧化应激,加重了肾损伤[19]。
鹿茸水提物可通过清除氧自由基、对抗脂质过氧化反应来减轻CDDP所致的肾功能损伤,促进肾小管的修复。结果表明,预先给予鹿茸水提物能显著抑制CDDP所致的脂质过氧化,改善了体内的抗氧化能力,减轻了CDDP对肾脏的氧化损伤。鹿茸水提物的抗氧化作用可能是其减轻CDDP所致小鼠肾脏损伤的重要机制,其中所含的多糖和蛋白质的抗氧化作用可能也是其增效减毒作用的药理作用物质基础,且二杠茸水提物的药效优于三岔茸,为梅花鹿茸在临床上的应用提供了新的理论依据。
[1] 国家药典委员会.中华人民共和国药典[M]. 2015年版一部. 北京:中国医药科技出版社, 2015:324-325.
[2] 高兆丽,刘广义,李 星,等.葡萄籽原花青素对顺铂所致小鼠肾毒性作用的影响[J]. 中国病理生理杂志, 2014, 30(2):313-317.
[3] Malik S, Suchal K, Gamad N, et al. Telmisartan ameliorates cisplatin-induced nephrotoxicity by inhibiting MAPK mediated inflammation and apoptosis[J]. Eur J Pharmacol, 2015, 748(期):54-60.
[4] 李淑贞,张拴平,郭秋红,等. 新交泰饮对顺铂肾损伤大鼠的保护作用[J].河北中医药学报, 2010, 25(1):5-7.
[5] Zhang JG, Zhong LF, Zhang M, et al. Protection effects of procaine on oxidative stress and toxicities of renal cortical slices from rats caused by cisplatininvitro[J]. Arch Toxicol, 1992, 66(5):354-358.
[6] Kim TW, Song IB, Lee HK, et al. Platycodin D, a triterpenoid sapoinin from Platycodon grandiflorum, ameliorates cisplatin-induced nephrotoxicity in mice[J]. Food Chem Toxicol, 2012, 50(12):4254-4259.
[7] 晋大鹏,胡志帅,陈书明. 鹿茸的化学成分及其生物活性研究进展[J]. 山西中医学院学报, 2009, 10(2):67-68.
[8] 俞建忠. 黄芪抗顺铂致肾损伤的研究进展[J]. 中国实用医药, 2010, 5(32):220-221.
[9] 刘 玲,张娟娟,何蕊玲,等. 黄芪注射液对顺铂所致小鼠肾损害的保护作用[J]. 中国中药杂志, 2010, 35(20): 2736-2740.
[10]Uppuluri S, Ali SL,Nirmala T, et al. Nephroprotector activity of hydro alcoholic extract ofTinosporacordifoliaroots on cisplatin induced nephrotoxicity in rats[J]. Drug Invent Today, 2013, (5):281-287.
[11]孔德阳,郝建兵,叶向梅,等. 盐酸法舒地尔通过活化Akt与抑制PTEN减轻顺铂导致的肾小管上皮细胞凋亡[J]. 中国病理生理杂志, 2015, 3(12):2254-2258.
[12]胡旭宇. 百令提取液对顺铂肾损伤小鼠模型的干预作用及其机理研究[D]. 苏州:苏州大学, 2005.
[13]江圣勇,范燕萍. 调整给药时间减轻顺铂肾毒性的研究[J]. 现代实用医学, 2002, 14(2):67-68.
[14]Wessner B, Strasser EM, Koitz N, et al. Green tea polyphenol administration partly ameliorates chemotherapy-induced side effects in the small intestine of mice[J]. J Nutr, 2007, 137(3):634-640.
[15]Boom H, de Heer E, van der Wal A, et al.The absence of delayed graft function is predicted by the presence of manganese-superoxide dismutase in distal tubules of renal allografts[J]. Transplantation, 2005, 79(8):946-952.
[16]陈 军. 药物诱导肾损伤和糖尿病肾病对比剂急性肾损伤大鼠模型的比较[D]. 天津:天津医科大学, 2012.
[17]杨 洁. 灵芝多糖对顺铂肾毒性的预防作用的研究[D]. 石家庄:河北师范大学, 2008.
[18]谢 伟,黄巨恩. 顺铂肾损害的基础研究[J]. 蛇志, 2008, 20(2):146-148.
[19]张 英,黄维义,王顺蓉,等. 姜黄素抗顺铂肾毒性作用及其机制研究[J].时珍国医国药, 2007, 18(7):1673-1676.
(责任编辑: 林白霜, 罗 森)
Protective effect of aqueous extract of velvet antler on cisplatin-induced nephrotoxicity in mice
DONG Si-min1,2, WANG Hai-lu1, WANG Quan-kai1, ZHANG Jing1
(1CollegeofChineseMedicinalMaterials,JilinAgriculturalUniversity,Changchun130118,China;2ChangbaishanPharmaceuticalCo.Ltd,Jilin132100,China.E-mail:zhjing0701@163.com; 13944125038@163.com)
AIM: To study the protective effect of aqueous extract of 2-branched and 3-branched velvet antler on cisplatin (CDDP)-induced nephrotoxicity in mice. METHODS:The mouse model of renal injury was induced by intragastric administration of CDDP at the dose of 15 mg/kg. After treatment, kidney index (KI), serum creatinine (SCr), blood urea nitrogen (BUN), the activity of superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px), and the content of malondialdehyde (MDA) in the kidney were determined. The renal pathological changes were observed with HE staining. RESULTS: Aqueous extract of velvet antler at the tested dose markedly decreased BUN, SCr and the content of MDA, and elevated the activity of SOD and GSH-Px in the mice pretreated with CDDP (P<0.05). The pathological changes of the renal tissues were improved obviously, and the injury of the epithelial cells of renal tubules was mitigated. The effect of the aqueous extract of 2-branched velvet antler on renal function and cisplatin-induced nephrotoxicity was better than that of 3-branched one at the same concentration. CONCLUSION: The aqueous extract of 2-branched and 3-branched velvet antler has a certain protective effect on cisplatin-induced nephrotoxicity, which may be associated with increasing the anti-oxidative capability of mouse renal tissue.
Aqueous extract of velvet antler; Cisplatin; Nephrotoxicity; Anti-oxidation
1000- 4718(2016)08- 1466- 05
2016- 01- 11
2016- 06- 13
吉林省科技计划发展项目(No. 20140204063YY; No. 20130102058JC)
R285.5; R363
A
10.3969/j.issn.1000- 4718.2016.08.022
杂志网址: http://www.cjpp.net
△通讯作者 张晶 Tel: 0431-84533358; E-mail: zhjing0701@163.com; 王全凯Tel: 0431-84533087; E-mail: 13944125038@163.com
