人PPIL6基因的克隆与原核蛋白表达
2016-05-31刘雅妍罗文辉梁晓红
刘雅妍,罗文辉,梁晓红
(湖南省株洲市中心医院 皮肤科, 湖南 株洲 412007)
基础医学研究
人PPIL6基因的克隆与原核蛋白表达
刘雅妍,罗文辉,梁晓红
(湖南省株洲市中心医院 皮肤科, 湖南 株洲412007)
[摘要]目的 克隆1个新的人类脯氨酸异构酶基因PPIL6(peptidylprolyl isomerase-like 6), 并通过原核表达获得重组蛋白进行生化活性鉴定。方法 通过PCR进行基因克隆。通过荧光定量PCR和免疫组织化学分析PPIL6的组织分布。通过EGFP融合蛋白观察PPIL6的细胞定位。通过大肠杆菌原核表达获得PPIL6重组蛋白。通过表面等离子共振技术检测PPIL6与CsA的相互作用。通过分光光度法检测CsA对PPIL6的抑制。结果 PPIL6存在2个转录本(PPIL6a和PPIL6b), 在脯氨酸异构酶家族中属于一个独立的分支。PPIL6在不同组织中广泛表达, 并在肾小管中有强染色。PPIL6定位于HeLa细胞的细胞核中。PPIL6能够与CsA结合, 并且其活性受CsA抑制。结论 克隆到1个新的人类脯氨酸异构酶基因PPIL6, 可能在细胞核中发挥基因表达调控的功能。
[关键词]脯氨酸异构酶; 绿色荧光蛋白; 细胞定位; 表面等离子共振
脯氨酸异构酶(peptide-prolyl isomerases, PPIase)能够催化蛋白质中脯氨酸氮端肽键的顺反异构[1]。脯氨酸异构酶包括3个大的亚家族:亲环素(cyclophilin)、FK506结合蛋白(FKBP)和parvulin。脯氨酸异构酶能够加速蛋白折叠和成熟, 在许多生理和病理过程中发挥重要功能[1]。比如, PPIA在许多肿瘤中表达升高, 并促进肿瘤生长[2-4], PPID是线粒体渗透转换孔的组成成分[5], 在乳腺癌中表达升高、抑制肿瘤细胞凋亡[6]。PPIL1在结肠癌中表达升高, 通过SNW1/SKIP和/或stathmin7促进细胞增殖[7]。发现新的PPIase有助于认识和研究人类疾病。本实验报道了1个新PPIL6基因的克隆、序列及定位分析、蛋白重组表达, 以及生化性质研究。
1材料与方法
1.1 实验材料人多种组织cDNA文库和pEGFP-N1载体购于Clontech公司。PCR试剂盒、pMD18-T载体、荧光定量PCR试剂盒、BL21大肠杆菌菌株购于Takara公司。PCR产物回收试剂盒购于天根生化科技(北京)有限公司。Ppil6抗体购于Santa Cruz公司。PET-28a原核表达载体、镍柱填料、CM5传感芯片购于GE公司。PCR引物在上海生工合成。Lipofectamin 2000转染试剂购买于Invitrogen公司。
1.2人PPIL6基因的克隆根据人PPIL6的cDNA序列设计克隆引物(上游引物: 5′-CCT TTT CCT CCA AGC TCG TC-3′; 下游引物: 5′-GGG AGG GAT TGG GTG TAG AT-3′)。以人皮肤cDNA文库为模板进行PCR扩增,反应条件如下:94 ℃预变性5 min,94 ℃变性50 s,60 ℃退火1 min,72 ℃延伸1 min,32个循环。PCR产物克隆入pMD18-T载体, 并利用载体引物进行测序。2个剪切本PPIL6a和PPIL6b的序列提交至GenBank, 序列号分别为DQ363562.1和DQ423529.1。
1.3 序列分析PPIL6a和PPIL6b的cDNA分析在UCSC基因组网站(http://www.genome.ucsc.edu)进行。结构域分析在SMART网站(http://smart.embl-heidelberg.de)进行。分子量和等电点分析在Expasy网站(http://cn.expasy.org/tools/)进行。多序列比对用Clustal X软件进行分析[8], 并利用BioEdit软件作图。用来比对的PPIL6蛋白包括:Daniorerio(NP_001018433.1)、Xenopuslaevis(NP_001088675.1)、Gallusgallus(XP_419794.2)、Musmusculus(NP_082706.1)以及Homosapiens(ABC88651.1, PPIL6a)。系统进化树用TreeView软件绘制, 采用的序列为PPIA(NP_066953.1)、 PPIB(NP_000933.1)、PPIC(NP_000934.1)、PPID(NP_005029.1)、PPIE(NP_006103.1)、PPIF(NP_005720.1)、PPIG(NP_004783.2)、PPIH(NP_006338.1)、PPIL1(NP_057143.1)、PPIL2(NP_055152.1)、PPIL3(NP_115861.1)、PPIL4(NP_624311.1)、PPIL5(NP_689542.2)、PPIL6a(ABC88651.1)以及PPIL6b(ABD83948.1)。
1.4PPIL6的组织表达谱分析荧光定量PCR在iCycler荧光定量PCR仪(Bio-Rad)上进行, Ct值由分析软件得出,并用于计算扩增产物的相对表达量。PPIL6的PCR引物为:5′- GGC GCA AAG TTG AGG AAA GG - 3′(正向), 5′- TCT TCA GAT TCT CAG CGG CG - 3′(反向);β-actin的PCR引物为: 5′-CTC ACC ATG GAT GAT GAT ATC GC- 3′(正向), 5′-AGG AAT CCT TCT GAC CCA TGC- 3′(反向)。β-actin的表达量用作内参来计算PPIL6在不同组织内的相对表达量。
1.5 Ppil6的免疫组化分析小鼠新鲜肾脏组织在恒冷冰冻切片机内切片, 厚度为5~6 μm。用Ppil6特异的抗体参考标准方法进行免疫组化染色[9]。
1.6 细胞培养和转染 在37 ℃, 5% CO2条件下, HeLa细胞培养于含10%胎牛血清的高糖DMEM中。细胞传代后24 h后使用脂质体(lipofectamine 2000)进行不同质粒的转染, 转染4 h 后换液。
1.7PPIL6的细胞定位将PPIL6a和PPIL6b的全长开放阅读框克隆入pEGFP-N1载体, 并将表达融合蛋白的质粒用Lipofectamine 2000转染试剂转染至HeLa细胞。转染24 h后, 细胞用PBS洗涤2次, 每次5 min, 并用4%多聚甲醛固定。EGFP融合蛋白直接通过荧光显微镜观察(Leica DM RA2), 并用Leica DC500相机成像。
1.8PPIL6蛋白的原核表达纯化将PPIL6a的全长开放阅读框克隆入PET-28a原核表达载体, 并转化BL21大肠杆菌菌株。挑取单克隆, 在5 mL LB培养基中37 ℃、200 rpm培养过夜获得种子液。将种子液加入500 mL LB培养基中, 37 ℃、200 rpm培养至OD600>0.6, 加入终浓度300 μmol/L的IPTG, 继续培养6 h。培养完成后于4 ℃、5 000 g、离心15 min收集菌体。将细胞沉淀完全重悬于10 mL预冷的PBS中, 将沉淀超声破碎、低温高速离心, 将上清过镍柱并用咪唑洗脱, 超滤去除咪唑后获得溶解于PBS中的PPIL6纯化蛋白。
1.9PPIL6蛋白与CsA的相互作用检测测定重组蛋白的浓度, 确定蛋白浓度高于200 μg/mL, 避免使用Tris缓冲液进行蛋白耦连。用最适pH的醋酸钠缓冲液将蛋白稀释至合适的浓度, 并且按照BIAcore 3000仪器的说明进行蛋白耦连。将CsA用DMSO(100%)配制成10 mmol/L的母液, 之后用含1/100 DMSO(v/v)的HBS-EP缓冲液将母液对半稀释成6个浓度梯度(最高浓度为0.625 μmol/L)。将样品离心后进样, 每个样品重复3次。进样流速为40 μL/min, 进样体积为50 μL, 测试温度为20 ℃。一个样品进样完成后, 用再生缓冲液洗去未充分解离的配体。最后在分析软件中进行曲线拟合和数据分析。
1.10CsA抑制PPIL6酶活的检测将Suc-AAPF-pNA多肽底物溶解于含有480 nmol/L LiCl的TFE中, 使其终浓度达到3 mmol/L; 将α-胰凝乳蛋白酶用1 mmol/L HCl溶解至终浓度42 mg/mL。在94 μL酶活测试缓冲液中加入不同浓度的CsA, 并加入2 μL PPIL6储存缓冲液(蛋白浓度为5 μmol/L), 冰上放置3 h。对照组中不加CsA; 空白组不加入CsA和PPIL6蛋白。在上述混合溶液中加入2 μL底物缓冲液和2 μL α-胰凝乳蛋白酶缓冲液, 迅速混匀并做时间扫描, 连续测定A390值, 吸光度对时间的斜率代表其酶促反应速率。计算公式为: 化合物对PPIase活性的抑制率(%)=[(对照组-实验组) / (对照组-空白组)] × 100%。
2结果
2.1PPIL6的基因克隆为了克隆新的脯氨酸异构酶(PPIase)蛋白家族成员, 我们将PPIA/CYPA的cDNA序列提交至人EST数据库进行序列检索, 结果发现了1条EST序列BX109113.1。通过EST步移法, 拼接出1条全长的cDNA, 并通过其编码氨基酸的序列, 将其命名为PPIL6(PPIase-like 6)。然后通过设计PCR引物, 从人皮肤cDNA文库中获得了PPIL6的全长序列。测序分析发现, 我们同时还获得了1个PPIL6的可变剪接体。将这2个序列分别命名为PPIL6a和PPIL6b, 并提交至GeneBank, 收录号分别为DQ363562.1和DQ423529.1。
2.2 PPIL6的序列分析PPIL6a的基因组信息如图所示(见图1A)。它位于人的6号染色体长臂(6q21), 由8个外显子组成。PPIL6b的基因组信息如图所示(见图1B), 其基因位点与PPIL6a相同, 只不过在第6个外显子后插入了1个新的外显子。PPIL6的cDNA序列如图1C所示, 图中用灰色显示的序列是PPIL6b中插入的序列及其编码的氨基酸。PPIL6a的开放阅读框(ORF)长度为936 bp, 编码312个氨基酸;PPIL6b的开放阅读框长度为1 014 bp, 编码338个氨基酸。为了分析PPIL6的家族蛋白信息及其进化保守性, 从NCBI网站获得了不同物种PPIL6及人不同PPIase成员的蛋白序列。蛋白序列比对显示,该蛋白在进化上高度保守, 其中人PPIL6a的第145位氨基酸之后的序列为一个保守的PPIase结构域(见图2A)。另外, 将人的PPIase蛋白及其类似蛋白的氨基酸序列与PPIL6一起进行系统进化分析可以看出, PPIL6a和PPIL6b在进化上形成的是一个独立的分支(见图2B), 与其他PPIase成员并不相同, 提示了它可能具有独特的功能。2.3 PPIL6的组织表达与细胞定位分析为了解PPIL6在不同组织中的表达情况, 利用荧光定量PCR检测了PPIL6的mRNA在人17种cDNA种的丰度, 并使用β-actin的表达量用作内参。从图3A中可以看出,PPIL6是一个在各种组织中广谱表达的基因, 提示其可能参与基本的生物学过程。由于PPIL6在肾脏中的表达量较高, 我们对小鼠肾脏切片进行了免疫组化分析, 发现Ppil6高表达于肾小管上皮细胞(见图3B),提示该基因可能参与重吸收和排泄过程。将编码EGFP:PPIL6融合蛋白的表达质粒转染到HeLa细胞中, 通过荧光显微镜观察发现PPIL6定位于细胞核中(见图3C)。
2.4 PPIL6a的原核蛋白表达与生化性质分析为了更深入地了解PPIL6的蛋白性质, 我们将PPIL6a的开放阅读框克隆进PET28a表达载体, 并通过IPTG在BL21大肠杆菌菌株中诱导蛋白表达。蛋白诱导表达后, 通过镍柱亲和层析获得纯度高于95%的PPIL6a重组蛋白(图4A)。由于与环孢菌素A(CsA)结合是PPIase蛋白的基本特性, 因此将PPIL6a重组蛋白偶联在BIAcore3000分子相互作用仪的CM5传感芯片上, 并将CsA以不同浓度从芯片表面流过, 获得亲和解离曲线(见图4B)。由图可知, PPIL6a与CsA的结合具有浓度依赖性。通过软件计算, PPIL6a与CsA的KD值为2.18×10-7mol/L。通过体外酶活实验将重组表达的PPIL6a与CsA结合, 并与底物孵育, 发现CsA能够抑制PPIL6a的脯氨酸转移酶活性, IC50为0.45 μmol/L(见图4C)。以上实验证明, PPIL6是一个新的脯氨酸异构酶家族成员。


A: PPIL6a的基因组结构; B: PPIL6b的基因组结构; C: PPIL6的cDNA序列及其编码蛋白。灰色为PPIL6b相对于PPIL6a插入的序列及其编码氨基酸。图1 PPIL6的基因组结构及cDNA序列


A: 不同物种中PPIL6的蛋白序列比对; B: PPIase蛋白家族成员的聚类分析。图2 PPIL6的蛋白序列及脯氨酸异构酶家族的进化分析

A: PPIL6在人不同组织中的表达量分析; B: 免疫组化分析Ppil6在小鼠肾脏组织中的表达分布情况;C: PPIL6a和PPIL6b的细胞定位。图3 PPIL6的组织表达及细胞定位分析
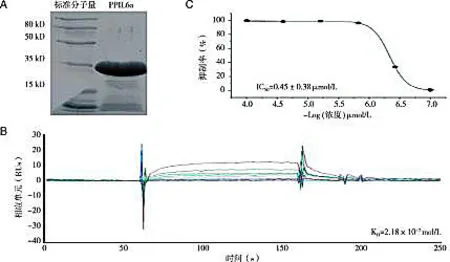
A: PPIL6a蛋白的原核表达纯化结果; B: 表面等离子共振技术分析PPIL6a与CsA的结合;C: CsA对PPIL6a酶活的抑制曲线。图4 PPIL6a蛋白的表达纯化与生化性质分析
3讨论
脯氨酸异构酶(PPIase)是生物体内存在的一大类分子伴侣蛋白[10]。脯氨酸异构酶可以稳定脯氨酰胺键的顺式-反式过渡态, 并且加速异构化过程, 这对蛋白质折叠是非常重要的[11]。亲环素是脯氨酸异构酶中的一类,在许多生理和病理过程中发挥重要功能,比如细胞凋亡[12]、类风湿性关节炎[13]、病毒入侵和包装[14-15]、肿瘤[16-17]等。发现新的亲环素成员对于深入研究该类蛋白的功能具有重要的价值。
本研究以亲环素PPIA/CYPA的序列为“诱饵”,通过表达序列标签(expressed sequence tag, EST)“步移”技术[18],成功克隆了一个新的人类脯氨酸异构酶编码基因PPIL6, 并进一步发现该基因存在PPIL6a和PPIL6b两个可变剪切本。序列分析表明PPIL6在进化上较为保守, 并且在脯氨酸异构酶里是一个独立的群体。表达分析表明,PPIL6在多种组织中广泛表达, 并且在肾脏中高度表达于肾小管上皮细胞, 可能参与渗透等过程;PPIL6定位于细胞核中。生化分析表明,PPIL6能够与CsA结合, 并且其活性能够被CsA抑制。EGFP融合蛋白技术显示,PPIL6定位在细胞核中。这些结果提示,PPIL6可能在细胞核中参与了基因表达调控,而使用CsA及其结构类似物则能够对PPIL6的功能进行阻断,具有潜在的应用价值。
[参考文献]
[1] Gothel S F, Marahiel M A. Peptidyl-prolyl cis-trans isomerases, a superfamily of ubiquitous folding catalysts[J]. Cell Mol Life Sci, 1999, 55(3): 423-436.
[2] Zhu D, Wang Z, Zhao J J, et al. The Cyclophilin A-CD147 complex promotes the proliferation and homing of multiple myeloma cells[J]. Nat Med, 2015, 21(6): 572-580.
[3] Obchoei S, Weakley S M, Wongkham S, et al. Cyclophilin A enhances cell proliferation and tumor growth of liver fluke-associated cholangiocarcinoma[J]. Mol Cancer, 2011, 26(10): 102.
[4] Bonfils C, Bec N, Larroque C, et al. Cyclophilin A as negative regulator of apoptosis by sequestering cytochromec[J]. Biochem Biophys Res Commun, 2010, 393(2): 325-330.
[5] Baines C P, Kaiser R A, Purcell N H, et al. Loss of cyclophilin D reveals a critical role for mitochondrial permeability transition in cell death[J]. Nature, 2005, 434(7033): 658-662.
[6] Wei L, Zhou Y, Dai Q, et al. Oroxylin A induces dissociation of hexokinase II from the mitochondria and inhibits glycolysis by SIRT3-mediated deacetylation of cyclophilin D in breast carcinoma[J]. Cell Death Dis, 2013, 4: e601.
[7] Obama K, Kato T, Hasegawa S, et al. Overexpression of peptidyl-prolyl isomerase-like 1 is associated with the growth of colon cancer cells[J]. Clin Cancer Res, 2006, 12(1): 70-76.
[8] 黄健,黄美容,骆诗露,等. 淋球菌OmpA蛋白的克隆表达、保守性及抗原表位分析[J]. 遵义医学院学报,2015, 38(3):261-265.
[9] 雷微, 陈永艳, 袁伟, 等. 皮肤鳞状细胞癌皮损中p-Akt,p-Stat3,CyclinD1的表达及意义[J]. 遵义医学院学报,2015, 38(3):275-278.
[10] Nath P R, Isakov N. Insights into peptidyl-prolyl cis-trans isomerase structure and function in immunocytes[J]. Immunol Lett, 2015, 163(1): 120-131.
[11] Naoumov N V. Cyclophilin inhibition as potential therapy for liver diseases[J]. J Hepatol, 2014, 61(5): 1166-1174.
[12] Hamilton G. Cyclophilin A as a target of Cisplatin chemosensitizers[J]. Curr Cancer Drug Targets, 2014, 14(1): 46-58.
[13] Yang Y, Lu N, Zhou J, et al. cyclophilin A up-regulates MMP-9 expression and adhesion of monocytes/macrophages via CD147 signalling pathway in rheumatoid arthritis[J]. Rheumatology (Oxford), 2008, 47(9): 1299-1310.
[14] Chukkapalli V, Randall G. Hepatitis C virus replication compartment formation: mechanism and drug target[J]. Gastroenterology, 2014, 146(5): 1164-1167.
[15] Nkongolo S, Ni Y, Lempp F A, et al. Cyclosporin A inhibits hepatitis B and hepatitis D virus entry by cyclophilin-independent interference with the NTCP receptor[J]. J Hepatol, 2014, 60(4): 723-731.
[16] Ghosh J C, Siegelin M D, Vaira V, et al. Adaptive mitochondrial reprogramming and resistance to PI3K therapy[J]. J Natl Cancer Inst, 2015,doi:10.1093/jnci/dju502.
[17] Qian Z, Zhao X, Jiang M, et al. Downregulation of cyclophilin A by siRNA diminishes non-small cell lung cancer cell growth and metastasis via the regulation of matrix metallopeptidase 9[J]. BMC Cancer, 2012, 12: 442.
[18] Aldea M, Kushner S R. Instructions for the cloning program[J]. Gene, 1988, 65(1): 117-122.
[收稿2016-01-17;修回2016-03-22]
(编辑:王静)
Cloning and prokaryotic protein expression of humanPPIL6 gene
LiuYayan,LuoWenhui,LiangXiaohong
(Department of Dermatology, Zhuzhou Central Hospital, Zhuzhou Hunan 412007, China)
[Abstract]Objective To clone a noval human peptidylprolyl isomerase (PPIase) gene peptidylprolyl isomerase-like 6 (PPIL6) and purify the recombinant protein through prokaryotic expression and then evaluate its biochemical activity.Methods PPIL6 was cloned through PCR. Tissue distribution of PPIL6 was monitored by quantitative real-time PCR and immunohistochemistry. The cellular localization of PPIL6 was observed using EGFP fusion protein. Recombinant PPIL6 was purified from E. coli. The interaction between PPIL6 and CsA was detected by SPR. The inhibitory effects of CsA on PPIL6 was measured by spectrophotometry.Results There were two isoforms of PPIL6 (PPIL6a and PPIL6b). PPIL6 presented an isolated branch in PPIase family. PPIL6 was widely expressed in human tissues with strong staining surround kidney tubules. PPIL6 distributed in the nucleus of HeLa cells. PPIL6 bound to CsA and CsA inhibited PPIL6 activity.Conclusion A novel PPIase gene, PPIL6, is cloned and speculated to play a regulatory role in gene expression in nucleus.
[Key words]peptidylprolyl isomerase; green fluorescent protein; subcellular localization; surface plasmon resonance
[中图法分类号]R34
[文献标志码]A
[文章编号]1000-2715(2016)02-0143-07
