DNA修复机制的研究
2016-05-30刘扬杭海英
刘扬 杭海英
2015年度的拉斯克基础医学研究奖和诺贝尔化学奖分别授予了研究DNA损伤响应和DNA修复机制的科学家,以表彰他们在基础科学研究领域所取得的成就。
1953年,沃森(J.Watson)和克里克(F.Crick)解析出著名的DNA(脱氧核糖核酸)分子双螺旋结构。从那时起,DNA分子有遗传属性并在细胞分裂时能够自我复制,从而保持物种的延续就成为大家的共识。但是DNA一直受到多种外源(如紫外线照射和环境污染物等)及内源(如活性自由基)物质的攻击,同时DNA的每次复制进程都伴随着随机错误。所有这些因素可导致DNA发生氧化、烷基化、形成多种DNA加合物,以及DNA单链或双链的断裂。但是DNA分子并没有因此变得杂乱无章,依然能正常稳定地工作。这种神奇工程的缔造者就是生物体内那些被称为“DNA管家”的蛋白分子,是它们对基因组不断进行监督并及时校正修复DNA的损伤,从而使生物体维持正常的新陈代谢。
2015年度拉斯克基础医学研究奖(Albert Lasker Award for Basic Medical Research)分别授予两位研究DNA损伤修复的科学家,威特金(E.M.Witkin)和埃利奇(S.J.Elledge),以表彰他们在DNA损伤响应一保护基因组机制方面的发现。2015年度诺贝尔化学奖也授予了研究DNA损伤修复的科学家,他们是英国的林达尔(T.Lindahl),美国的莫德里奇(P.Modrich)和桑贾尔(A.Sancar),他们的贡献在于阐释了细胞内DNA修复的机制和对遗传信息的保护。同年的拉斯克基础医学研究奖和诺贝尔奖都授予同一研究领域的科学家,是过去没有发生过的事情,这表明了DNA损伤修复的基础性研究工作在科学发展、人类健康方面所取得的成绩和对未来攻克癌症、造福人类的重要意义。
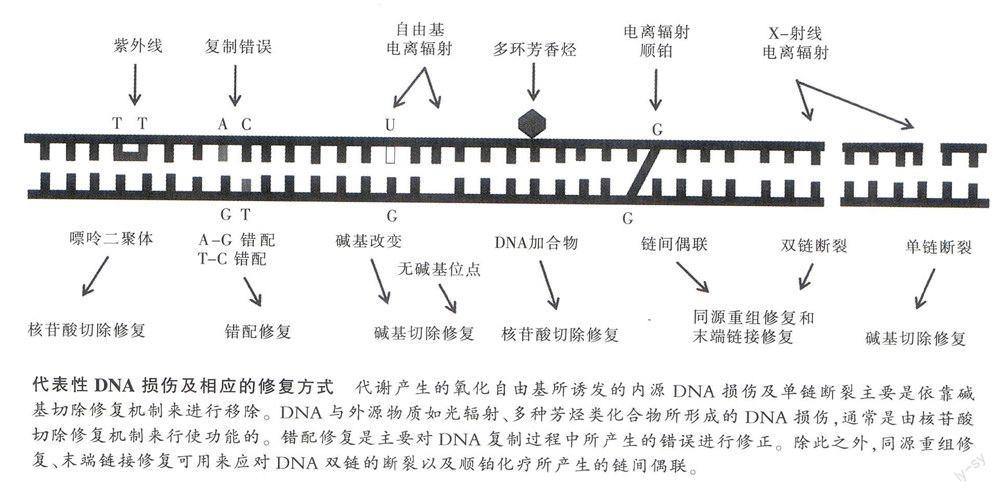
碱基切除修复
林达尔是三位诺奖得主中,最早对DNA稳定性提出质疑的科学家。林达尔1938年出生于瑞典斯德哥尔摩,获瑞典卡罗琳斯卡医学院(Karolinska Institute)医学博士学位。1981年-2009年任剑桥大学克莱尔实验室(Clare Hall Laboratory)主任。2010年至今,任弗朗西斯·克里克研究所(Francis Crick Institute)名誉负责人。早在1960年代末,他就发现作为一种与DNA相近的分子,RNA(核糖核酸)的降解要快得多,高温时更是如此。“难道DNA就真的那么稳定吗?”带着这个疑问,林达尔开始了对DNA稳定性的研究,并通过实验证实DNA经历着缓慢但却可见的衰变。正是由于体内DNA损伤修复机制的存在,使得每天都会遭遇成千上万次攻击的基因组仍能保持正常的运行。从此,林达尔打开了通向DNA损伤修复研究领域的大门。
他首先从寻找细菌中的修复蛋白着手。胞嘧啶(C)、胸腺嘧啶(T)、腺嘌呤(A)与鸟嘌呤(G)组成DNA的四种碱基,在DNA的双螺旋结构中,T与A在两个氢键的作用下配对出现,而C和G则在三个氢键的作用下配对出现。但是,研究发现C很容易失去环外氨基,失去氨基的C(即T)便与A在两个氢键的作用下配对,导致基因信息的改变。这种缺陷的持续将会导致DNA复制发生变异,从而诱发基因组的不稳定性。
1974年,林达尔首先报道了一种细菌酶,这种细菌酶能够移除受损的C,从而抵消产生的突变。随后,他发现并检测了细胞中多种用来进行DNA修复的蛋白质。糖基化酶(glycosylases)是这些修复蛋白中执行碱基切除修复过程中的第一步(即切除各种受损碱基)的一类水解酶。随后,他的研究团队又揭示了该通路中碱基切除后的几个配套修复步骤,描绘出了“碱基切除修复”(BER)机制的全貌,表明碱基切除修复不仅存在于细菌中,也发生在人和其他生物上面。
1996年,林达尔成功地在生物体外实验中重组各种人碱基修复蛋白因子,证明人细胞也存在碱基切除修复机制。林达尔的工作表明DNA修复领域是多因子参与的修复通路。由于碱基损伤在细胞内频繁发生.该机理的揭示对于研究其他修复通路机理有至关重要的启迪作用。
DNA错配修复
莫德里奇1946年出生于美国新墨西哥州,在斯坦福大学获得医学博士学位,是美国杜克大学医学中心生物化学教授,也是霍华德·休斯医学研究所(Howard Huges Medical Institute)的研究员。莫德里奇与DNA世界的结缘来自于他的父亲——一位高中生物学教师的影响,作为一位生物学老师,父亲对DNA相关内容有着浓厚的兴趣,并潜移默化地影响了儿子的研究方向。
从博士研究生到助理教授,莫德里奇检验了一系列作用于DNA的酶:DNA聚合酶,DNA连接酶,以及多种限制性内切酶等。在1970年代末,他把Dam甲基化酶作为他主要的研究方向。1979年,他报道了Dam甲基化酶可以将甲基基团加合到DNA上,这些甲基基团扮演着路标的角色,指示特定的限制性内切酶在正确位置切断DNA链。此后,哈佛大学的分子生物学家梅塞尔森(M.Meselson)发现,甲基基团的指示功能还体现于:当DNA出现错配碱基时,甲基基团可以帮助细胞确认在纠错时的正确DNA模板。随后他们通过共同研究发现,当DNA出现碱基错配时,会不断纠正没有甲基化的那条链。由此,DNA错配修复是DNA发生复制时一种自然的过程,在DNA复制过程中出现错误、互补链上碱基不能匹配时,DNA错配修复功能发挥作用,以未甲基化为标志来识别新合成的错误的DNA链,纠正不匹配的碱基。
事实上,在莫德里奇开始研究DNA错配修复机制之前,科学家就已知道DNA在复制进程中会发生错误,体现于:A与C或G与T发生错配。莫德里奇的工作表明,DNA错配修复机制主要用来修复DNA复制过程中产生的碱基错配,这种机制的存在可使产生的碱基错配率降低三个数量级。对莫德里奇来说,这一发现开启了他之后十余年的系统性研究,他的实验室也相继研究并鉴定出11个参与DNA错配修复的蛋白因子,并成功地在体外实验中重现了复杂的错配修复分子的修复过程,此成果发表在1989年的美国《科学》(Science)周刊上。“我对科学研究的热爱就在于它能解决问题的一面”,莫德里奇在回忆当年研究并表征不同DNA错配修复蛋白的经历时说,“我从其中每一小步过程中都体会到解决问题后的快乐与满足”。
核苷酸切除修复
桑贾尔1946年出生于土耳其,拥有土耳其、美国双重国籍,美国德州大学达拉斯分校博士毕业,现任美国北卡罗来纳大学教堂山分校生物化学与生物物理教授。兴趣是人们最好的老师,桑贾尔的经历对这句话做出了最好的说明。桑贾尔有7个兄弟姐妹,家境一般,但他父母仍尽最大努力让每个孩子都接受教育。桑贾尔上学时非常用功,对生命科学,尤其是生物化学特别感兴趣,因而攻读生化博士。对桑贾尔来说,成为一名生物学家是他的理想,但是他的生化教授却建议他先去学习医学,做一名医生,然后再回来做基础研究。他听从老师的建议,在行医两年后关闭了自己的诊所,去美国攻读博士学位。
在科研生涯的早期,桑贾尔就发现,即使细菌暴露在紫外线辐射下奄奄一息,可当它们再受到可见蓝光的照射时,却可以很快恢复状态。究竟是什么原因使得细菌死里逃生?怀着对这一神奇现象的好奇心,他发现了可以修复紫外损伤DNA的酶——光解酶,并利用DNA重组技术使细菌产生出足够的光解酶。然而这一研究结果在当时并没有引起重视。博士毕业后,他想继续在DNA损伤修复领域进行研究,可是所发出的全部博士后申请都被拒绝。后来,他了解到耶鲁大学的鲁珀(D.Rupp)对DNA修复很感兴趣,虽然当时鲁珀的实验室没有博士后的位置,但却有实验员的空缺,于是他以实验员的名义加入了鲁珀实验室。当时,耶鲁大学是美国研究DNA损伤修复的重要中心,除了鲁珀外,还有很多该领域最前沿的科学家,如在切除修复和重组修复中做出杰出贡献的霍华德一弗兰德斯(P.Howard-Flanders)、哈钦森(F.Hutchinson)和雷丁(C.Radding)都在那里工作过。
当时,科学家已经知道细菌有两种修复紫外线损伤DNA的机制:一种依赖于光解酶;另一种是形成对紫外线敏感的细菌突变系,它们又分别称为UvrA、UvrB与UvrC的突变基因。于是,桑贾尔便开始在耶鲁大学探索紫外修复系统的分子机制,成功分离并纯化出了在这种系统中起作用的UvrA、UvrB和UvrC蛋白。
他首次发现这三种蛋白的协同作用可以识别紫外辐射造成的DNA损伤。其中UvrA和UvrB的主要作用是对损伤进行识别与确认,而UvrC的功能是在DNA受损部位两端进行剪切,这样一个包含损伤部位在内的12-13个核苷酸片段就被移除。随后,DNA聚合酶以完好的DNA链为模板,合成正常的DNA序列用以弥补空缺,以便DNA连接酶将新合成的片段与原DNA链相连。最终,细菌的“核苷酸切除修复”机制就这样诞生了。此后,桑贾尔对人体内的“核苷酸切除修复”机制进行了研究,发现人体中有更多的蛋白分子参与紫外线损伤修复,其修复机制远比在细菌中发现的要复杂得多,但基本原理是类似的,都包括对损伤的识别、确认和切除。
DNA损伤应答
损伤后的DNA不仅要有DNA修复,还需要DNA损伤响应机制来共同参与错误的纠正,从而保证正常生理活动和生命延续。2015年拉斯克基础医学研究奖获得者威特金首先发现这一损伤响应机制的存在,并阐述了其在原核生物中的基本特征,而另一获奖者埃利奇则揭示了在真核生物中DNA损伤响应的分子通路。这两套系统的运转细节各异,但在调控大量基因的活性以帮助机体免遭厄运的功能方面则是一致的。
威特金1921年出生于纽约,1971年开始任新泽西州拉特格斯大学(Rutgers University)教授,直到1991年退休。1944年她首先发现具有抗紫外线能力的大肠杆菌,并发现抗紫外线特征的可遗传性,开启了细菌紫外线损伤修复的遗传学研究。后来,越来越多的证据证明,DNA是遗传物质和基因载体,威特金的研究则逐渐聚焦到大肠杆菌DNA损伤响应。她发现细菌病毒(即噬菌体)的释放、易错类型的DNA复制、细菌生长及分裂等DNA损伤响应具有许多共同的特征,这些研究为后来提出的细菌DNA损伤应急机制(SOS机制)奠定了基础。
现在知道,SOS系统包括40多个基因,其中关键蛋白是RecA。当DNA受到损伤并衍生出单链DNA时,RecA以多聚链状方式(RecA*)结合到单链DNA上,从而破坏抑制蛋白Lex A。Lex A分解后,细菌细胞SOS应答就启动了。RecA*还可切除噬菌体基因阻遏蛋白,也可直接或间接切断UmuD形成UmuD,进而促进易错重组的修复。
相比前四位科学家,哈佛大学医学院布里格姆妇女医院(Brigham and Women's Hospital)的埃利奇教授最为年轻。他在1990年代进入DNA修复领域时,也用大肠杆菌研究DNA重组修复,发现了Rad53激酶在协调DNA修复中的重要作用。后来,他的实验室将研究方向转到真核生物DNA损伤响应和修复,并找到1000多个参与真核生物损伤响应的蛋白。在真核生物细胞中,RPA蛋白结合损伤产生单链DNA,活化激酶ATR。而ATM激酶的活化对应着损伤诱发的双链DNA断裂。ATR和ATM随后会激活一连串其他激酶,包括Chkl、Chk2等,这些激酶又会作用于多种下游目标,启动多种损伤应答,如细胞周期阻滞、凋亡、衰老等。
DNA修复研究展望
DNA修复系统的缺陷会对正常人细胞造成重大威胁,并引发癌症等疾病。如核苷酸切除修复基因有缺陷的人,在阳光下就容易患上皮肤癌;缺失DNA错配修复基因的人,会更容易患上结肠癌。但是,对于癌细胞的DNA来说,通过抑制修复体系,就能增加化疗疗效,减缓癌症的生长。比如,奥拉帕尼(olaparib)就是一种可抑制修复体系的抗癌药物。所以,在对癌症治疗的同时,如何更好地开展癌症预防也同样重要。通过基因测序及样本验证,鉴定得到有效的癌症驱动基因,可以更精准地对不同患者进行相关的预防治疗。
事实上,不仅仅是上述科学家,包括中国科学家在内的许多科学家,都对阐释DNA修复通路做出了杰出的工作。到目前为止,国内的DNA损伤修复研究领域已获得多项国家科技部重大研究计划项目的资助。此外,许多修复通路在细胞内也有重叠,还与其他生物过程、途径相互交叉,它们之间的协调机理还需要做进一步的研究突破。相信通过国内外科学家对DNA损伤修复领域及其他相关领域更多的探索和研究,攻克癌症、早衰、糖尿病等一系列顽疾的目标会离我们越来越近。
