美国引进甘蔗品种对黑穗病的抗性鉴定与初步评价
2016-05-30李毅杰高轶静李翔雷敬超等
李毅杰 高轶静 李翔 雷敬超等

摘 要 为筛选出抗甘蔗黑穗病的优异亲本材料,采用人工浸渍接种法对27个甘蔗品种进行1年新植试验的黑穗病抗性鑒定。通过潜育期(LP)、持续发病期(SDD)、累计丛发病率(IP)、累计茎发病率(IS)和病情进展曲线下的面积(AUDPC)这5个病情参数,结合标准对照种的抗性表现,综合评价参试品种的抗性,并采用系统聚类分析进行验证。结果表明:5个病情参数之间的相关性均达到极显著水平,是甘蔗黑穗病抗性鉴定与评价的重要指标。参试品种中,未发病品种6个,占22.22%;高抗(HR)品种5个,占18.52%;抗病(R)品种10个,占37.04%;中抗(MR)品种1个,占3.70%;中感(MS)品种2个,占7.41%;感病(S)品种3个,占11.11%。系统聚类分析的结果与参试甘蔗品种的抗性表现一致。
关键词 甘蔗;黑穗病;抗性鉴定;病害参数;聚类分析
中图分类号 S435.661 文献标识码 A
由甘蔗鞭黑粉菌(Ustilago scitaminea Sydow)引起的甘蔗黑穗病(sugarcane smut disease)是一种世界性的重要甘蔗病害。自1877年南非纳塔尔(Natal)发现该病害以来[1],目前除巴布亚新几内亚(Papua New Guinea)外,所有植蔗国和地区均有该病发生的报道[2-3]。甘蔗黑穗病为系统性侵染病害,一旦有一株发病,其余分蘖均可发病,不但造成甘蔗产量损失,还使甘蔗糖分降低,影响品质[4]。该病的广泛流行使得许多植蔗国不得不淘汰一些丰产、高糖但感病的栽培品种,尤其在中国最大的甘蔗产区广西,由于黑穗病菌分化和ROC系列品种单一化问题严重,甘蔗黑穗病发生情况日趋严重,在占广西种植面积达到60%左右的主栽品种ROC22上发病率高达20%[5]。
抗病育种是防治甘蔗黑穗病最经济、最有效的措施,抗病性鉴定评价是抗病育种的重要环节,甘蔗黑穗病抗性水平受环境条件影响大,抗性评价的准确性和效率直接影响抗病育种的效率[6]。甘蔗黑穗病抗性鉴定所采用的接种方法主要有浸渍法[7]、针刺法[8-9]、催芽和真空渗透接种法[10-11]。其中浸渍法被普遍采用。但浸渍法也衍生出2个分支:第一种是采用冬孢子为接种体[12],第二种是采用异型(“+”和“-”交配型)担孢子等量混合作为接种体[13]。这2种浸渍法的鉴定结果均比较接近自然条件下黑穗病的侵染方式,但采用接种体为冬孢子时,不同小种黑穗病菌混合比例存在随机性,不能保证每次接种病原的一致性,也不能明确评价寄主所感抗的黑穗病菌小种类型。另外,每次接种前需要检测混合黑穗病菌冬孢子粉的萌发率以确定接种体的浓度。再者,需要采集大量的甘蔗黑穗病菌冬孢子作为接种体,工作量较大。而异型担孢子混合接种的优点在于:经过分离、纯化、鉴定小种类型并保存之后,每次接种可通过人工培养获得新鲜的接种体,接种体的浓度和比例也较易控制,省去检测接种孢子活力及田间采集的大量工序,接种的甘蔗黑穗病菌小种也是明确的。
本研究采用人工浸渍接种的方法,应用流行病学参数,对广西农业科学院甘蔗研究所从美国引进的甘蔗种质材料的黑穗病抗性进行鉴定及综合评价,以期筛选出抗黑穗病甘蔗优异材料,为甘蔗新品种选育和推广应用提供科学依据。
1 材料与方法
1.1 材料
从美国引进的甘蔗种质材料20份,分别为CPCL06-3179、CPCL06-3332、CPCL06-3458、CPCL06-3477、CP06-2422、CP06-2874、CP06-2897、CP06-3051、CP07-1527、CP07-1533、CP07-1618、CP07-2137、CP07-2518、CP07-2547、CP09-4147、CP09-4256、CP09-4257、CP09-4369、CP09-4448、CP09-4707;以广西蔗区主栽品种ROC22、桂糖29号(GT29)和桂糖42号(GT42)(其中GT29和GT42均为广西农业科学院甘蔗研究所育成品种及黑穗病抗性鉴定标准对照种F134(感小种2,抗小种1)、NCo310(抗小种2,感小种1)、NCo376(高抗小种1和2)和Ya71-374(高感小种1和2),合计27份甘蔗品种材料,由广西农业科学院甘蔗研究所繁殖场和海南基地提供。
1.2 方法
1.2.1 黑穗病接种体的准备 将甘蔗黑穗病菌的“+”和“-”交配型菌株(实验室保存,并鉴定为甘蔗黑穗病菌1号小种的2个交配型)分别在PDA平板培养基上活化后,挑取少许接入YEPS(蔗糖20 g/L,蛋白胨20 g/L,酵母浸膏10 g/L,pH值6.5)液体培养基中120 r/min 28 ℃培养3 d。然后分别取2 mL接入含有300 mL YEPS液体培养基的500 mL玻璃三角瓶中,120 r/min 28 ℃培养7 d。取少量培养液于光学显微镜下,将孢子悬浮液调整为1×106个/mL,然后将“+”和“-”交配型菌液等量混合,再以1 ∶ 2的比例用清水稀释,待用。
1.2.2 浸渍接种 各材料选择鳞芽良好的种茎,去除叶鞘后砍成双芽段,并分别装入网袋备用。将砍下的新鲜种茎放入黑穗病菌混合液中浸泡10 min,取出后用塑料袋保湿,24 h后播种于大田。
1.2.3 种植管理 各接种材料于2015年9月1日种植在广西农业科学院甘蔗研究所隆安试验基地,种植地土壤类型主要以沙页岩赤红壤为主。采用随机区组设计,设3个重复,2行区,行距1.2 m,行长3 m,每行下种量30个芽,每小区60个芽,每个材料共180芽。下种盖土后喷施除草剂封闭,并在行沟封盖白色地膜(种植前几天降雨,土壤湿润)。其余田间管理按常规大田生产操作。
1.2.4 调查记录 种植后发现有黑穗病株出现时进行第一次调查,之后每隔15 d调查1次,直至发病情况稳定为止。为了判断新鞭,在发病蔗茎的每条黑鞭上挂吊牌标记,注明出现日期和顺序数。记录所有供试材料甘蔗黑穗病黑鞭出现的初始日期、发病丛数、总丛数、发病茎数及总茎数,并计算潜育期(LP)、持续发病期(SDD)、累计丛发病率(IP)、累计茎发病率(IS)和病情进展曲线下的面积(AUDPC)等5个病情参数。病情进展曲线下的面积(AUDPC)计算公式如下:AUDPC=(IS1+IS2)/2×(t2-t1),其中IS1和IS2分别是相邻调查的IS,t2和t1分别是相邻调查时间。
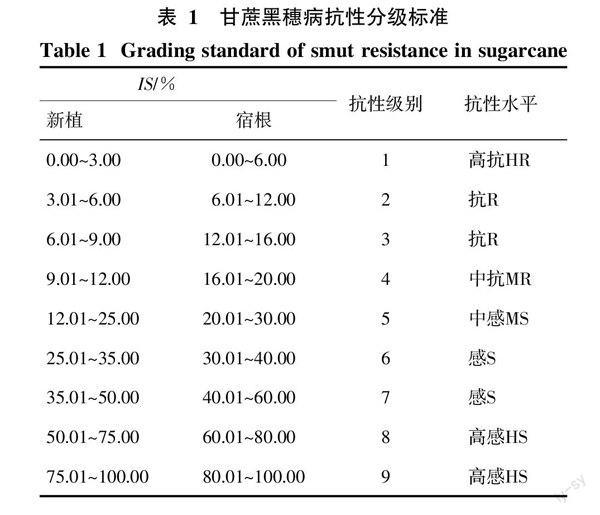
1.2.5 甘蔗抗黑穗病抗性分级 甘蔗黑穗病的分级参照前人1~9级分级标准进行抗性分级[14],詳见表1。本试验采用最终的累计茎发病率来确定供试材料的抗性水平,并且以3个重复中抗性较差的来确定该品种的抗性级别。
1.3 数据处理与统计分析
使用DPS14.10版软件进行相关性分析、方差分析和聚类分析[15]。相关分析类型选择Pearson相关;对数据进行反正弦平方根转换后,采用SNK法进行多重比较,得出方差分析结果;对5个病情参数SSD、LP、IS、IP和AUDPC的数据进行标准化转换后,采用卡方距离x2和类平均法(UPGMA)对试验材料进行系统聚类分析,评价试验材料的抗病性。
2 结果与分析
2.1 病害参数间的相关分析
5个病情参数的相关分析结果(表2)表明,LP与SDD、IP、IS、AUDPC之间呈负相关,且均达到极显著水平,说明潜育期的长短会显著影响病情。SDD是衡量甘蔗抗再侵染能力的重要指标,其与IP、IS、AUDPC之间均存在极显著的正相关,表明在整个病害流行季节中,抗再侵染能力的强弱对甘蔗抗病性的表型性状存在显著的影响。IP、IS与AUDPC三者之间均呈正相关,相关性均达到极显著水平。因此,5个病情参数均与甘蔗黑穗病抗性关系密切,是甘蔗抗黑穗病性评价很有价值的指标。其中,IS与AUDPC之间的相关系数最大,高达0.990,这主要是由于在计算AUDPC过程中涉及到IS这一指标。
2.2 黑穗病抗性表现
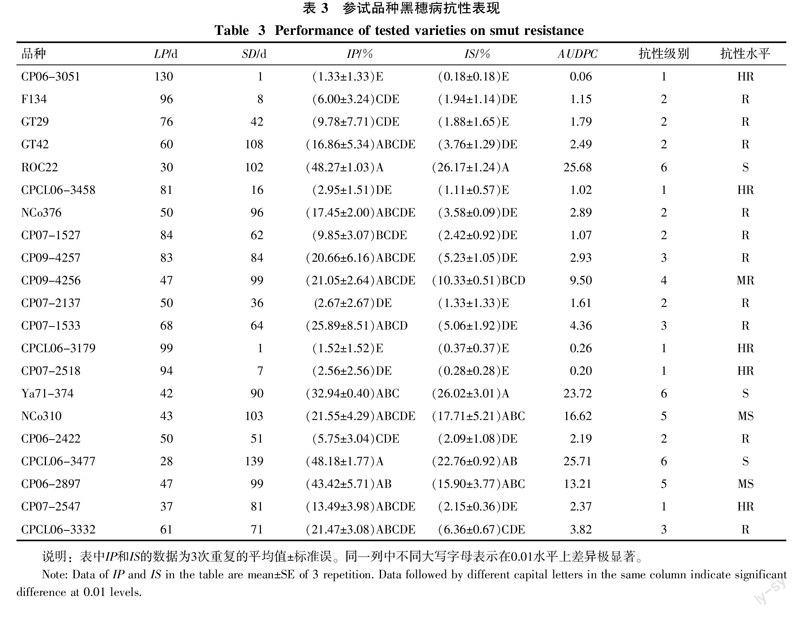
供试的27份材料中,CP06-2874、CP07-1618、CP09-4147、CP09-4369、CP09-4448和CP09-4707等6个品种未发病,占参试品种数的22.22%,其余21个品种均有不同程度的发病表现,其中CP06-3051、CPCL06-3179、CP07-2137、CP07-2518这4个品种只有1个重复发病,病情参数值详见表3。ROC22的累计丛发病率和累计茎发病率均最高,CPCL06-3477的病情进展曲线面积最大。参试材料的抗性级别和抗性水平根据最终累计茎发病率来划分(见表1),抗性水平为HR的品种5个,占18.52%;抗性水平为R的品种10个,占37.04%;抗性水平为MR的品种1个,占3.70%;抗性水平为MS的品种2个,占7.41%;抗性水平为S的品种3个,占11.11%;没有出现抗性水平为HS的品种。抗性鉴定的标准对照种F134、NCo310、NCo376、Ya71-374的抗性水平依次为R、MS、R、S。广西蔗区主栽品种ROC22、GT29、GT42的抗性水平依次为S、R、R。主栽品种的IS与标准对照种的IS相比,在0.01水平上,ROC22与NCo310和Ya71-374之间差异不显著,GT29、GT42与F134和NCo376之间差异不显著。
2.3 聚类分析
聚类分析结果表明,供试材料的黑穗病抗性表现具有丰富的多样性(图1)。除CP06-2874、CP07-1618、CP09-4147、CP09-4369、CP09-4448和CP09-4707等6个品种未发病,自成1类,不参加聚类外,当阈值为0.52时,其余21个品种可分为4类。第Ⅰ类:包含5个品种,分别为CP06-3051、CPCL06-3179、CP07-2518、F134和CPCL06-3458,总体特征为潜育期长,持续发病期短,发病率低,抗性水平高。第Ⅱ类:包含GT29、GT42等10个品种,抗性水平比第Ⅰ类低,但是病情进展也比较缓慢,AUDPC值为1.79~4.36。第Ⅲ类:包含3个品种,分别为CP09-4256、NCo310和CP06-2897,表现为累计丛发病率平均达到20%以上,累计茎发病率平均达到10%以上,抗性水平中等。第Ⅳ类:包含3个品种,分别为ROC22、CPCL06-3477和Ya71-374,总体表现为潜育期短,持续发病期长,发病率最高,抗性最差。
3 讨论与结论
甘蔗黑穗病的抗性评价通常采用最大累计茎发病率,也有采用最大累计丛发病率,个别采用病情进展曲线下的面积[16]。无论采用何种病情指数作为抗性评价的指标均为单一的指标。本试验的相关分析结果表明,所调查的5个病情参数之间相关性均达极显著水平,多指标的抗性综合评价更为客观。此外,在试验中设置标准对照种也是必要的,尽管前人的分级标准中明确规定了发病率值所对应的抗性等级,但由于抗性的表现是品种(寄主)、病原小种(寄生物)和环境等因素共同作用的结果,所以抗性的表现及发病率的高低并非只取决于品种本身的抗性[17],可以通过供试材料与标准对照种有关参数值的差异显著性分析和聚类分析对鉴定材料做出评价,而不单依据病情参数的绝对值大小来判断,降低了因环境互作影响表型而误判的风险。
根据前人研究,普遍认为中国大陆的甘蔗黑穗病病菌小种存在小种1和小种2[18-19]。夏红明等[20-21]认为,标准对照种F134和NCo310在接种不同的黑穗病菌后,田间的抗性表现不同,并以此来判断小种的类型。笔者在前期研究中通过综合应用BSA和SSR标记技术,获得了一个同时抗2个小种的抗性连锁标记[22],后期也可以利用此技术作辅助鉴定。沈万宽等[13]通过相异交配型1 ∶ 1的混合菌体注射接种甘蔗小苗,发现接种菌株的致病力明显强于小种1和小种2的致病力,表明极有可能存在新的黑穗病菌小种。
甘蔗对黑穗病菌的抗性有形态学抗性、生理生化和分子水平抗性[23-27]。前人的研究结果表明,芽的大小、芽的深浅、芽鳞的紧凑程度、萌发孔的位置等结构特点以及芽的萌芽与否都对甘蔗品种的抗病性有显著影响[28-30]。浸渍接种与其他研究中所采用的针刺接种[22]和注射接种[13]的方法相比,接种后的黑穗病发病率相对较低,但因其未破坏甘蔗植株及芽的形态学抗性,故其黑穗病抗性鉴定结果比较接近田间黑穗病的实际发生情况,抗性鉴定结果更合理。
采用浸渍法人工接种黑穗病抗性鉴定结果表明,从美国引进的20份甘蔗种质材料,除CP09-4256、CP06-2897和CPCL06-3477这3个品种抗性较差外,其余材料抗性较强。其中CP06-2874、CP06-3051等10个品种表现为高抗黑穗病,可考虑选择作为甘蔗黑穗病抗病育种的亲本材料。广西蔗区主栽品种ROC22在本试验中发病率最高,表现为感病品种,试验结果与前人研究一致[4,31-32]。近年来ROC22在田间自然感染黑穗病的发生率较高,导致广西蔗区黑穗病发生严重,经济损失重大,不宜再扩大种植和推广。GT29和GT42为广西农业科学院甘蔗研究所新近育成品种,在本试验中鉴定为抗病品种,与往年试验结果一致[33-34],目前在广西的种植面积不断扩大,有望代替ROC系列品种,也可作为甘蔗黑穗病抗病育种的亲本材料。由于本试验只对供试材料进行了秋季新植蔗的抗性鉴定,缺少对宿根蔗的试验观察,然而抗性等级与作物季和年份的相关显著[35],且甘蔗对黑穗病抗性遗传是中度可重复[36],所以参试材料仍需多年多点鉴定,才能保证评价的准确性。
参考文献
[1] McMartin A. Sugarcane smut: reappearance in Natal[J]. S Afr Sugar J, 1945, 29: 55-57.
[2] Singh N, Somai B M, Pillay D. Smut disease assessment by PCR and microscopy in inoculated tissue cultured sugarcane cultivars[J]. Plant Sci, 2004, 167: 987-994.
[3] Riley I T, Jubb T F, Egan B T, et al. First outbreak of sugarcane smut in Australia[J]. Proc Int Soc Sugar Cane Technol, 1999, 23(2): 333-336.
[4] 王维赞, 何 红, 朱秋珍, 等.引进甘蔗新品种对黑穗病抗性的鉴定[J]. 中国农学通报, 2010, 26(15): 285-288.
[5] 李毅杰, 段维兴, 黄 志, 等.广西甘蔗生长中期主要病虫害发生与抗病性评价[J].广东农业科学, 2016, 43(6): 127-131.
[6] 阙友雄, 林剑伟, 黄文华, 等.甘蔗杂交后代黑穗病抗性评价与抗感池构建[J]. 热带作物学报, 2009, 30(1): 21-25.
[7] Byther R S, Steiner G W. Camparision of inoculation techniques for smut testing in Hawaii[J]. Proc Inter Soc Sugar Cane Technol, 1974, 15: 280-288.
[8] Chao C P, Hoy J W, Martin F A. Evaluation of traits associated with resistance to sugarcane smut[J]. J Amer Soc Sugar Cane Technol, 1989, 9: 6-16.
[9] Waratich K S. Testing technique for resistance to whip smut of sugarcane[J]. Indian J Mycol Plant Pathol, 1989, 19: 227-229.
[10] Bleicher J, Tokeshi H. Effect of vacuum inoculation method on sugarcane caryopases colonization by Ustilago Scitaminea[J]. Proc Inter Soc Sugar Cane Technol, 1980, 17: 1 446-1 459.
[11] Dean J L. The effect of wounding and high pressure spray inoculation on the smut reactions of sugarcane clones[J]. Phytopathology, 1982, 72: 1 023-1 025.
[12] 许莉萍, 陈如凯. 甘蔗黑穗病及其抗病育种的现状与展望[J].福建农业学报, 2000, 15(2): 26-31.
[13] 沈万宽, 姜子德, 杨湛端, 等.甘蔗抗黑穗病的鉴定新方法及其品种抗性评价[J]. 华中农业大学学报, 2014, 33(2): 51-56.
[14] 闕友雄, 许莉萍, 林剑伟, 等.甘蔗品种黑穗病抗性评价体系的建立[J]. 植物遗传资源学报,2006,7(1):18-23.
[15] 唐启义. DPS数据处理系统:实验设计、统计分析及数据挖掘(第2版)[M]. 北京: 科学出版社, 2010.
[16] 许莉萍, 陈如凯, 陈平华.甘蔗分离群体的黑穗病病情指数分析[J]. 热带作物学报, 2004, 25(3): 33-36.
[17] 许莉萍, 林彦铨, 傅华英.甘蔗抗黑穗病性评价及品种的抗性鉴定[J]. 福建农业大学学报, 2000, 29(3): 292-295.
[18] 陈如凯, 许莉萍, 林彦铨, 等. 现代甘蔗遗传育种[M]. 北京:中国农业出版社, 2011.
[19] Que Y X, Xu L P, Lin J W, et al. Molecular variation of Sporisorium scitamineum in mainland China revealed by RAPD and SRAP markers[J]. Plant Dis, 2012, 96(10): 1 519-1 525.
[20] 夏红明, 吴才文, 陈学宽, 等. 甘蔗材料的黑穗病抗性鉴定[J]. 中国糖料, 2007(3): 26-27.
[21] 夏红明, 黄应昆, 陆 鑫, 等. 甘蔗新品种(系)及引进品种抗黑穗病鉴定研究[J]. 中国糖料, 2015, 37(6): 24-25.
[22] 高轶静, 张荣华, 张革民, 等.与甘蔗抗黑穗病基因连锁的SSR标记筛选[J]. 热带作物学报, 2013, 34(11): 2 222-2 226.
[23] Lloyd H L, Pilla Y M. The development of an improved method of evaluating sugarcane for resistance to smut[J]. Proc S Afr Sug Tech Ass, 1980, 54: 168-172.
[24] Anon G C. Early testing of sugarcane smut[J]. Sugarcane Breeding Inst Newsletter, 1988, 7: 4-6.
[25] Dinkova T D, Gutierrez R, Ramos L M, et al. Inhibitors of teliospore germination of smut disease of sugarcane[J]. Revista de Protection Vegetal, 1992, 7: 167-171.
[26] Lloyd H L, Naidoo G. Chemical assay potentially suitable for determination of smut resistance of sugarcane cultivars[J]. Plant Dis, 1983, 67: 1 103-1 105.
[27] Pandmanaban P, Mohanraj D, Alexander K C. Tissue invertase as a possible index of smut infection in sugarcane[J]. Current Sci, 1988, 57: 902-903.
[28] Padmanaban P, Alexander K C, Shanmugam N. Mechanism of smut resistance in sugarcane[J]. Sugar Cane, 1998, 6: 14-16.
[29] Gloria B A, Albernas M C C, Amorim L, et al. Structural characteristics of buds of sugarcane cultivars with different levels for resistance to smut[J]. Zeitschrift fur Pflanzenkrankheiten and Pflanzenschutz, 1995, 102: 502-508.
[30] 龚得明, 林彦铨, 陈如凯. 甘蔗抗黑穗病育种技术的研究Ⅲ.甘蔗芽若干特性与抗黑穗病的关系[J]. 作物学报, 1996, 22(3): 362-364.
[31] 高轶静, 张革民, 张荣华, 等. 甘蔗优良新品种(系)的黑穗病抗性鉴定[J]. 中国糖料, 2013(2): 25-26, 29.
[32] 沈万宽, 杨湛端, 刘福业. 甘蔗品种(品系)对黑穗病的抗性鉴定与评价[J]. 华中农业大学学报, 2014, 33(5): 40-44.
[33] 张荣华, 何 红, 张革民, 等.宿根性特强甘蔗新品种桂糖29号的选育[J]. 中国糖料, 2011(1): 1-4.
[34] 王伦旺, 廖江雄, 谭 芳, 等.高產高糖抗倒伏甘蔗新品种桂糖42号的选育及高产栽培技术[J]. 南方农业学报, 2015, 46(8): 1 361-1 366.
[35] Chao C P, Hoy J W, Saxton A M, et al. Heritability of sugarcane smut resistance and correlation between smut grade and yield components[J]. Crop Sci 1990, 23: 54-56.
[36] 林彦铨, 陈如凯, 龚得明. 甘蔗抗黑穗病的数量遗传分析[J].福建农业大学学报, 1996, 25(3): 271-275.
