能量共振特异性传递靶向断裂DNA或蛋白质
2016-05-30成波
成波
摘 要 在生物学的研究和实践中,有针对性地抑制或者是灭活某种特定的生物体,并且保证邻近的其它生物体不受或者少受伤害,这种需求是广泛的。比如清除或者抑制肿瘤细胞的同时不伤害人体正常细胞,灭活病原体但是不伤害人体组织等。通常会采用某些化学药物放射线等方法对病原体进行杀灭的同时不可避免地严重伤害到了周围的正常细胞。本文给出一种设想,采用能量谐振,碱基段间相互牵扯,沿着特定序列传递能量的方式,靶向破碎具有特定DNA序列的生物体的DNA,达到即灭活和抑制该种生物体,又不损伤其它序列DNA的生物体。
关键词 能量谐振 牵扯传递 特异性 DNA断裂 靶向杀菌 治疗癌症
中图分类号:R944.9 文献标识码:A DOI:10.16400/j.cnki.kjdks.2016.05.027
Abstract In biological research and practice, it targeted inhibition or inactivation of a particular organism and other organisms from neighboring guarantee or less hurt, this demand is widespread. For example, remove or inhibit tumor cells without harm to the body's normal cells, inactivate pathogens but does not harm human tissue and the like. Often they use certain chemicals and other methods of radiation to kill pathogens while inevitable serious injury to the surrounding normal cells. This paper presents a vision, using resonance energy, between each other involved base section, energy transfer along the way specific sequences, specific DNA sequences having broken target organism DNA, i.e., to achieve the kind of organism inactivation and suppression and does not damage DNA sequence other organisms.
Key words ultrasonic resonance; energy delivery; targeting therapy; DNA break; sterilization; treatment of cancer
如何殺灭致病病原体或癌变细胞,是当前医学界对疾病进行治疗的一大研究热点和难点。我们目前主要用手术或者各种化学药物对致病因素进行清除,以达到治疗疾病的目的。然而这些方式都有其缺陷。手术的方式对人体本身就是个创伤,化学药物可能对身体的正常细胞造成伤害。因此,如何在对疾病进行治疗时候避免对正常细胞造成伤害,靶向的清除致病因素,是亟待解决的问题。多种能量波(如超声波)都可以穿透人体组织并且向内部提供能量,本文介绍一种可能的利用超声波特异性断裂靶DNA的方法,以期将这种方法应用于实际临床中。
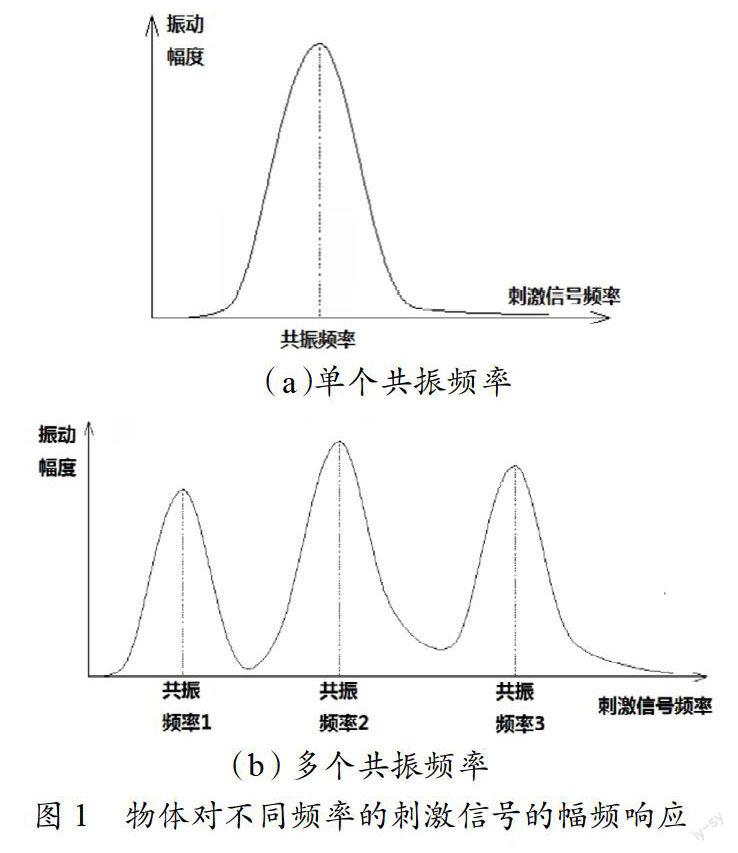
任何一个具有一定形态的物体,从信号处理的角度来看,都是一个机械滤波器,给它施加一定频率的机械振动信号(比如超声波),都会让它获得一定幅度的振动,它一定具有一个或者多个特定的固有频率(也称谐振频率和共振频率),①它的振动幅度与施加信号的频率和它自身的固有频率有关。如果输入信号的频率和物体的谐振频率相同,那么该物体就会在这个输入信号的激励下共振起来,获得最大振幅。②③它如同一个机械的带通滤波器,只不过这个通带频率可能很窄(如图1(a)),或者有几个很窄的通频带而成为梳状滤波器(如图1(b))。以上是信号处理的基础知识。这些知识同样适用于电学和电磁学等各种波动学说。也就是说,任何带电物体(包含极性分子以及分子片段)都具有以上所描述的机械特性完全类似的电磁学特性。 DNA(和RNA)分子的碱基、脱氧核糖核苷酸、核糖核苷酸以及它们组成的序列,从结构上看,都具有以上的机械和电磁学等特性。
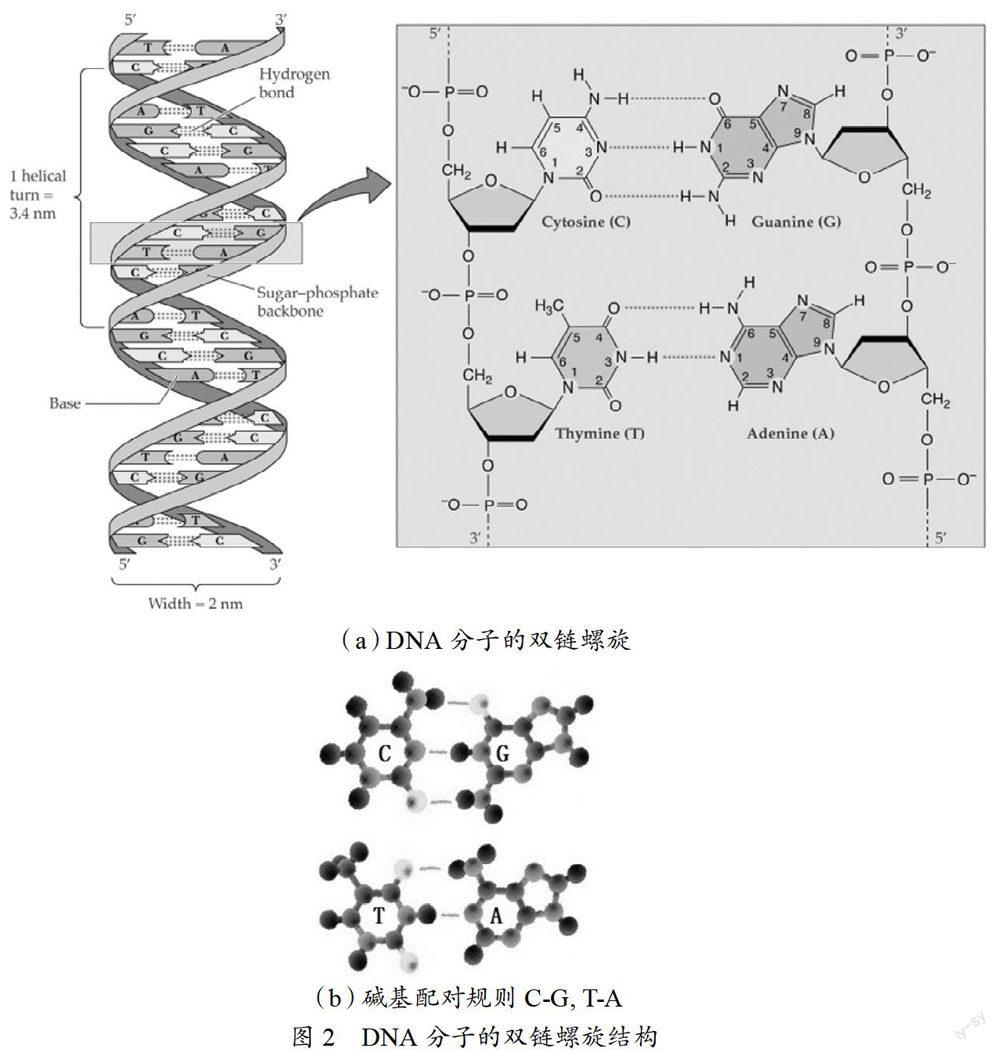
生物体的遗传物质是DNA(部分物种是RNA,因为情况类似,以下统称DNA),俗称遗传基因。任何生物都由体内的DNA决定它身体的结构、功能、发育生长等,依靠DNA编码繁衍后代。DNA分子是双链螺旋结构④(如图2(a) ),每个单链由含有ATGC(RNA为AUGC)四种碱基的脱氧核糖核苷酸(deoxynucleoside,是一类分子片段,一个基团,简称脱氧核苷酸,本文中为了描述方便,用碱基和ATGC直接代指对应的脱氧核苷酸,本文不再区分碱基与含有该碱基的脱氧核苷酸)按照一定的顺序排列而成,两条链之间按A-T(RNA中是A-U),C-G由氢键严格配对组成碱基对(如图2(b)),一长串含有碱基的脱氧核苷酸对形成双链。⑤⑥同一条链上相邻两个碱基之间由磷酸二酯键(以下简称酯键)相连。这个排列顺序就是遗传密码,组成很长的双链结构,对于一个生物体或者细胞来讲,如果DNA不能正常工作,其生命过程就会受到阻碍甚至死亡。
因此,如果我们可以特异的只破坏病原体的DNA,而不影响正常细胞的DNA,就可以做到靶向治疗了。然而过程并没有这么简单,通常而言,我们所熟知的破坏DNA的方法是使用特定的限制性内切酶对特定的酯键切割,但是蛋白质酶很难在人体内维持活性,很可能被免疫系统攻击,并且很难靶向到病原体处。就算没有被攻击,也靶向到了病原体,也很难穿透其细胞膜。所以目前还没有成熟的通过内切酶进行治疗的先例。我们给出另一个思路:基于DNA双螺旋结构和DNA分子所具有的特定频率响应特性(可能包含机械力学、电磁学等性能,以下统一以机械力学特性为例说明,电磁学等特性完全类似)做到特异性位点切割DNA分子的思路。
因为ATGC四种脱氧核苷酸自身机械结构差异性,因此它们的机械振动频率一定有差异,每一种结构都具有一个固有振动频率,假设: A、T、G、C的固有振动频率分别为1 MHz,2 MHz,3 MHz,4 MHz;如果对DNA分子施加以上任意一个频率的超声波,对应频率的脱氧核苷酸会发生共振。若我们事先通过基因测序方法获得病原体的DNA单链序列中特异性的一段序列为(为了下面描述方便,特地给每个脱氧核苷酸进行编号)
A1-G1-T1-C1-A2-T2-G2-C2-T3-G3-A3-......
给该DNA链发射1MHz的超声波,引起A1共振(当然每一个A都会共振,下面同理),持续一定的时间(假设1ms),在这段时间内相邻G1因为与A1间酯键连接,一定会获取一定的振幅(即能量),根据G1的振动相位施加同相位的3MHz超声波,使得G1共振,因为G1先从A1那里获得了一定的能量,后面的3Mhz超声传给它的能量是同相位的,使得G1获得更大的振幅,G1大幅度振动又会通过酯键牵引T1振动,使得T1也振动起来,3Mhz施加1ms长时间,在G1剧烈振动并且带动T1振动厉害后,又按照T1的振动相位施加2Mhz的超声波,让T1在获得G1傳递过来的能量的基础上更加剧烈地与2Mhz超声波共振,持续1ms以后,再次施加4Mhz的超声波,使得C1的振幅更大,以此类推下去,总是让能量沿着特定的序列不断地传递下去(过程中能量有一定衰减),对施加超声波信号的频率和相位进行调节,使得只有按特定顺序排列的碱基序列可以不断获得最大的振动幅度,沿着单链传递达到一定长度(比如100个碱基)以后,因为碱基振动太过剧烈,酯键或氢键会断裂。断裂后就可以停止超声波发射了。因为给出的超声波的时间序列是按照特定碱基序列给出的,因此不是按超声顺序排列的碱基序列在这个过程中不能够持续不断共振而获得足够大的能量,并且在这个过程中,是有阻力的振动,阻力会不断消耗能量,因此其它顺序排列碱基序列的能量传递和积累速度远远不如特定序列(与超声波的序列对应的碱基序列)快。这样就实现了抑制特定序列的DNA生物的繁殖或生长。通过超声波的时间编码,实现有针对性地灭活或抑制对应DNA编码的生物体的目标。但是对其它编码的生物体又伤害很小。
当前治疗肿瘤所采用的放疗,是采用电磁波或高能射线等,能够非特异性打碎DNA,人体的正常细胞和肿瘤细胞全部灭活,因为非特异性的原因,放疗对病人的副作用很大,并且常常不能完全清除体内的肿瘤细胞。本文的路线方法也可以选择癌细胞的特异序列进行攻击既能够特异性的杀灭包含特定序列的DNA的癌细胞,又能不伤害其他正常细胞。
以上描述的思路拿超声波举例说明完全是为了叙述方便,其实电磁波(包含光波)对作为极性基团的脱氧核苷酸来说也是一种很不错的共振激励能量波,思路还可以开阔一点,还可以从脱氧核苷酸作为极性基团的电磁学等特性考虑采用电磁波、粒子射线、电子轨道跃迁等诸多方法。组成序列的个体也不限于只针对单个脱氧核苷酸,可以考虑脱氧核苷酸对,甚至多个脱氧核苷酸或脱氧核苷酸对的组合(因为组合的原因,会导致编码数增多,但这并不影响该方法的原理的可行性)。甚至推而广之,针对形成生物体氨基酸只有21种和其构象只有有限的几种的特点,针对每种氨基酸及其构象找到其共振频率,对每种氨基酸和其构象进行频率编码顺序施加机械或者电磁频率能量,让其达到能量频率共振顺序传递的目的。其最根本的原理就是沿着特定序列谐振并且通过相邻的牵扯传递和积累能量,达到最后特异性破碎DNA或蛋白质的目的。实际上荧光共振能量转移就是利用了这个原理,但是它只实现了一步转移,本文中提到的方案是要实现多步转移并巧妙地利用这个多步达到特异性的目的。显然这个思路雏形还有待把它付诸实施的有兴趣人们在实践中不断完善和修正,工程量非常大,但笔者认为,这条思路不失为一种可供探索用于医治百病的“灵丹妙药”。
注释
① 何静华,形继祖编,生活中的物理(79).广州出版社,2003.8:10.
② 刘栓江,李建新.大学物理,航空工业出版社,2001:66.
③ 孙林岩.普通高等教育“十五”国家级规划教材 人因工程(修订版).中国科学技术出版社,2005.1:334.
④ Watson, J.D. and Crick, F.H., 1953. Molecular structure of nucleic acids. Nature 171:737-738.
⑤ Rich, A., Nordheim, A. and Wang, A.H., 1984. The chemistry and biology of left-handed Z-DNA. Annu Rev Biochem 53:791-846.
⑥ Gerald Karp, Cell and Molecular Biology concepts and Experiments, Third Edition,John Wiley & Sons,Inc.
