化学蛋白组学与青蒿素机理研究
2016-05-30王继刚华子春林青松
王继刚 华子春 林青松
2015年,中国科学家屠呦呦因发现青蒿素而获诺贝尔生理学或医学奖。青蒿素的发现为治疗疟疾做出了革命性贡献,然而其精确的抗疟机理几十年来却依然不甚明了。最近,科学家利用化学蛋白组学的手段更加清晰地阐明了青蒿素特异高效的抗疟机理,从分子层面解开了青蒿素抗疟的神秘面纱。
疟疾是一种由寄生虫感染而引起的恶性疾病。世界卫生组织估计每年约有2亿人感染,66万人死于疟疾。绝大多数受害者是不到5岁的儿童,受到疟疾威胁的人口则多达32亿人。疟原虫感染人体后会在短时间内破坏人体内80%的红细胞,威胁患者生命。
在众多的治疗疟疾药物中,青蒿素是最为有效的一种。青蒿素是从一种称为黄花蒿的植物中提取的天然化合物。30多年前,中国科学家屠呦呦最早发现并证明青蒿素在治疗疟疾中的重要作用。青蒿素的发现和广泛使用使得每年数百万疟疾感染者免于死亡的威胁。虽然青蒿素作为一种最有效的抗疟药物得到广泛使用,但其抗疟机制仍不明了。更令人担忧的是,最新的研究还发现了对青蒿素产生抗药性的病例,一旦疟原虫对青蒿素产生耐药性并大面积传播,必将给人类带来一场大灾难。因此,研究青蒿素内在的抗疟机制对于控制青蒿素的抗药性及开发新型抗疟药物有着重要意义。
疟疾与青蒿素
人们往往以为狮子和鲨鱼是凶猛残暴的动物,然而据研究,每年死于这些猛兽的仅有几十人。蚊子是人们熟悉又讨厌的昆虫,大家绝对不会想到,世界上最危险的动物居然是小小的蚊子。有些蚊子携带着具有传播性的疟原虫,人被这些蚊子叮咬后,会染上致命的疾病——疟疾。
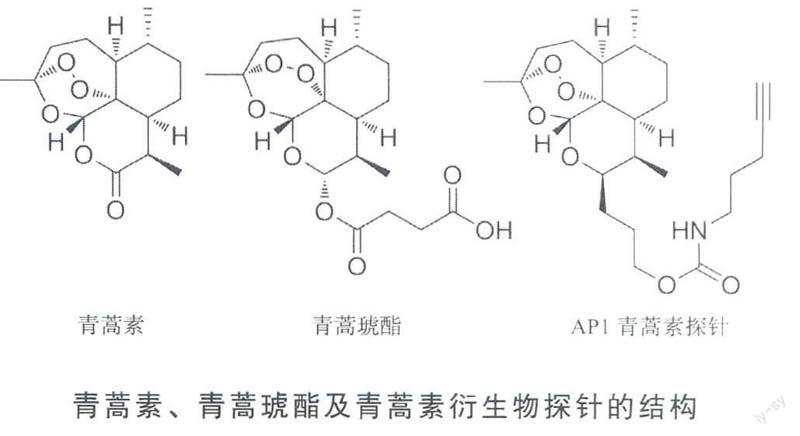
青蒿素是目前最强有效的抗疟药物。它能够在几小时内起效,并快速杀灭人体血细胞内的寄生虫,被认为是抗击疟疾的最后一道防线。青蒿素是一种特殊的具有过氧桥结构的倍半萜内酯类化合物,为无色针状晶体,易溶于醋酸乙酯、氯仿丙酮、乙醚等溶剂,但几乎不溶于水,相对分子质量282.33,是从菊科植物黄花蒿中分离出来的。近年来,青蒿素及其多种衍生物被广泛应用于疟疾的临床治疗,其中包括双氢青蒿素、青蒿琥酯和蒿乙醚,它们的化学结构中都带有具活性的过氧桥结构。
主流的青蒿素抗疟机理假说
青蒿素在其被发现并广泛运用几十年后,其准确的作用机制依然没有定论。在东南亚某些地区,已发现一些青蒿素逐步耐药的迹象,一旦青蒿素耐药并大面积传播,必将给人类带来一场大灾难。
青蒿素抗疟机理的研究有两个难点:第一,青蒿素是一个前体药物,本身没有很活跃的性质,需要通过其他物质的激活,才能变成高杀伤力的药物,但对于激活剂及其来源是什么,一直都有很多争论。第二,青蒿素被激活后,是通过结合哪些生物分子来杀灭疟原虫的,也一直是悬而未决的问题。
在青蒿素如何被激活的问题上,游离的二价铁离子和血红素都曾被认为是青蒿素活化所需要的二价铁离子的来源,但是相关研究的结果却互相矛盾。关于青蒿素的作用靶点,可从众说纷纭中归纳为以下几种假说。
(1)血红素结合模型。梅什尼克(S.Meshnick)早期在质谱研究中观察到血红素被青蒿素烷基化的结合产物,并在体外实验中发现青蒿素与血红素的反应产物能氧化红细胞膜上的巯基。类似的青蒿素烷基化血红素的结果,在其他实验室的研究中也得到了验证。之后,罗伯特(A.Robert)在用青蒿素治疗处理后的被鼠疟感染的小鼠的脾脏和尿液中,也分离鉴定到青蒿素与血红索的烷基化产物。但随后的实验揭示青蒿素对血红素的烷基化并不是其抗疟作用所必需的。
(2)肌浆内质网钙ATP酶靶点理论。该理论最早由克里什纳(S.Krishna)提出。他根据青蒿素在化学结构上与毒胡萝卜素(thapsigargin)的相似性,及后者能特异地结合并抑制肌浆内质网钙ATP酶(PfATP6),推测青蒿素可能会对PfATP6有潜在抑制作用。他利用在非洲爪蟾卵母细胞中表达PfATP6来进行试验,发现青蒿素的确对这类蛋白有抑制作用。此理论曾风靡一时,但后来越来越多的学者质疑该理论:有些实验不能被重复,或者认为PfATP6即使是青蒿素的靶蛋白,但也不一定是最重要的靶蛋白。
此外,还有一些其他蛋白被认为是青蒿素的靶蛋白,如转移控制肿瘤蛋白,氯喹抗性转运蛋白,消化泡上的膜转运蛋白等,但都没有足够证据证明这些蛋白与青蒿素抗疟作用有直接关系。
(3)线粒体模型理论。有研究发现,青蒿素能抑制酿酒酵母在非发酵培养基中的生长,而对在发酵培养基中培养的酿酒酵母的生长没有明显影响,这种现象暗示青蒿素与线粒体功能有密切联系。电子传递链的组分也显示出对青蒿素的敏感性,但最近的一些研究结果表明,在青蒿素处理过的疟原虫中,线粒体的形态与功能并没有受到严重影响。
以上这些假说是几十年来几代科学家利用生物化学、细胞生物学等方法建立的青蒿素机理模型,但它们都不能很好地解释青蒿素对疟原虫的高效、高特异性的杀伤作用。
利用化学蛋白组学研究青蒿素的作用机理
化学蛋白组学是近十几年来快速发展起来的一门集生物学、化学与质谱技术于一体的交叉学科。它提供了一种直接的有效的分析药物或者小分子化合物结合蛋白,以及分子的分离和鉴定手段,被越来越多地运用于揭示天然产物、药物的作用机理及其靶点的研究领域。
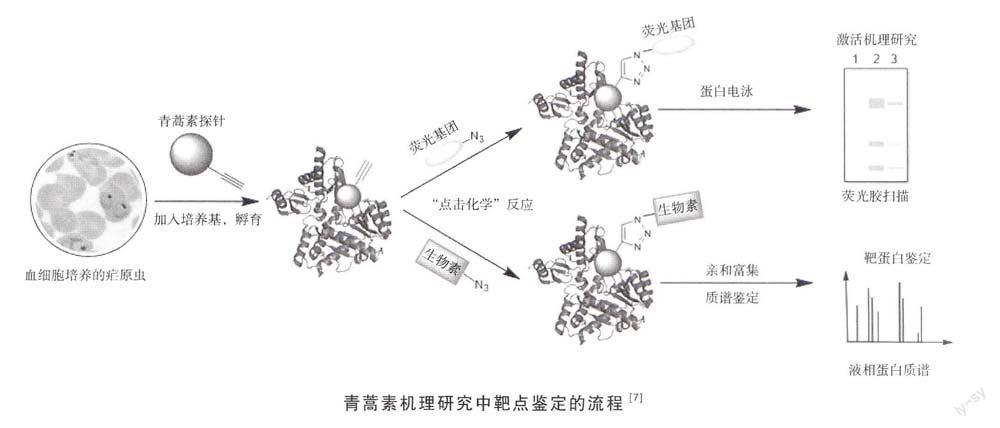
其中的主要原理是利用修饰后的药物或小分子探针去与生物大分子(靶标)结合,有效地标记或富集出与探针结合的生物靶标,然后运用凝胶电泳和生物质谱等手段鉴定这些靶蛋白。探针的修饰包括连接荧光素、同位素,或与固相载体作用。
笔者实验室利用化学蛋白组学的方法,系统鉴别出124种与青蒿素共价结合的靶蛋白。这些蛋白大多与疟原虫的重要生物过程有关,它们通过较广泛的靶点范围破坏寄生虫的生化环境,导致其死亡。研究人员利用体外结合的方法,证实了激活青蒿素的物质是血红素,而非游离的二价铁离子。为青蒿素杀灭疟原虫的功能与特异性提供了一个最为合理的解释,加快了青蒿素抗药性的研究进程。
鉴定青蒿素作用的靶蛋白
为更全面系统地研究青蒿素的作用机制,鉴定其作用靶点,笔者实验室利用化学生物学的平台,设计合成了一系列青蒿素类似物的化学探针。经过测试,这些青蒿素类似物探针同未修饰的青蒿素具有相似的药物活性,且保持了其结合位点的特异性,在药理学上与青蒿素相似,所以其作用方式及靶点能够代表青蒿素。
这些青蒿素类似物探针的修饰结构非常小巧,只加人了一个生物正交反应基团(炔基)。此修饰保证了最小化地影响药物结构及其生物利用度,又能够在后期通过自由连接荧光染料来示踪药物靶点,或者连接生物素来亲和纯化靶蛋白。另外一个突出的优点就是,小巧的化学修饰使青蒿素探针依然具有良好的穿膜性与生物利用度,这样可以进行活细胞的孵育,从而检测青蒿素在活体细胞内的结合作用蛋白。这种方法不同于传统的先裂解细胞,再进行孵育纯化的药物靶点鉴定方法,研究者采用的是能在活体细胞内作用的探针,它能更好地反映药物在生理条件下的结合与作用方式。
通过将活的疟原虫与青蒿素类似物共同孵育、提取粗蛋白、亲和纯化、电泳和串联质谱等一系列实验,最终鉴定出124种青蒿素直接作用的靶蛋白。值得注意的是,实验过程中所采用的洗去非特异蛋白的过程极为苛刻,经过反复多轮的清洗,在对照组中未发现任何寄生虫的蛋白。同时,为了提高实验结果和青蒿素靶点的可信度,选取三组重复探针,亲和纯化实验中共同鉴定出的蛋白作为青蒿素靶蛋白。在这些靶蛋白中,有33种蛋白之前被认为有可能是比较优秀的潜在抗疟药物的靶点,包括SERCA/PfATP6这一已知的青蒿素靶蛋白。这些靶蛋白参与了疟原虫许多重要的生物过程,包括羧酸代谢过程、细胞生物胺代谢过程、核苷代谢过程和核糖核苷生物合成过程等。
青蒿素靶蛋白参与多种疟原虫生存相关的生理过程
笔者团队还验证了一些参与疟原虫重要代谢途径的酶在体外与青蒿素类似物的相互作用。这些酶包括鸟氨酸转氨酶(OAT),丙酮酸激酶(PyrK),L-乳酸脱氢酶(LDH),亚精胺合酶(spdSyn)以及S-腺苷甲硫氨酸合成酶(SAMS)。实验证实青蒿素类似物可与这5种酶直接发生作用。与青蒿素结合后,参与疟原虫生理过程的关键酶都被庞大的倍半萜内酯共价修饰,其酶活性因此被不可逆地破坏,疟原虫快速死亡。
阐明青蒿素的活化机制
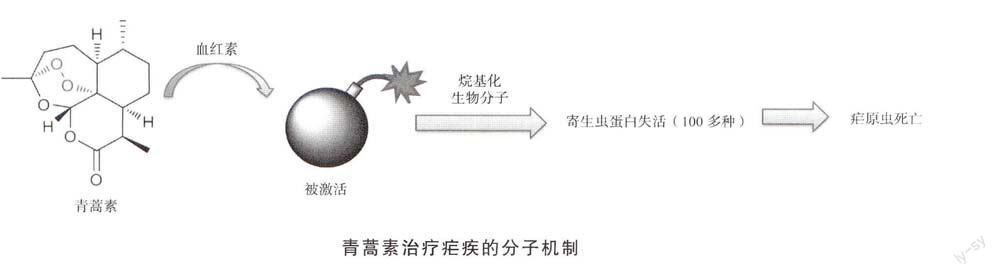
有了青蒿素的靶蛋白信息,就可利用纯化的靶蛋白与青蒿素的体外作用实验完美地解决青蒿素的活化机制。研究发现青蒿素类似物与靶蛋白的结合需要添加血红素,并且这种结合会在添加了维生素c、Na2S2O4或者谷胱甘肽(GSH)之后得到强化,这些试剂都可以将氯化血红素还原成血红素。与之形成对比的是,添加了二价铁离子之后,并不能检测出两者之间的结合。当添加铁螯合剂去除二价铁离子之后,青蒿素类似物与靶蛋白的结合也没有受到影响。但是,当添加蛋白酶抑制剂阻断血红蛋白消化从而减少血红素的释放之后,两者的结合受到明显抑制。这说明在青蒿素活化过程中,起决定作用的是血红素,而非游离铁离子。
随后检测青蒿素对不同时期疟原虫的活性。可以观察到青蒿素对不同生长期的寄生虫都有作用,青蒿素类似物可与所有生长期的寄生虫蛋白结合,但在早期环状体期的效果弱于晚期阶段(如滋养体和裂殖体阶段)。这与之前报道的青蒿素在寄生虫晚期阶段的杀伤效果比早期环状体期强100倍的结果相吻合。
环状体期的青蒿素活化主要依靠疟原虫体内血红素的生物合成。由于这一阶段血红素的产量较低,青蒿素的活化程度也相对较低。在后期,虫体内合成的血红素也可活化青蒿素,但是血红蛋白降解释放出的血红素对药物活化起了主要作用。寄生虫后期的血红素大量产生导致了青蒿素的高活性,这使得青蒿素表现出极强的抗疟性。
青蒿素抗疟机理与未来研究方向
综上所述,疟原虫感染人体后,会如同吸血鬼一般疯狂地吞噬人体红细胞。青蒿素本身只是一个药物前体,它需要被“激活”后才能发挥作用。血红素分子恰恰是青蒿素的特异性激活剂。而血红素分子是人血红蛋白的一个重要组成成分。当疟原虫在大量吞噬红细胞的时候,会释放出非常高浓度的血红素分子,这样青蒿素就会在疟原虫代谢旺盛的地点被激活。激活后的青蒿素就会与疟原虫体内数以百计的寄生虫蛋白结合,致使其失去活性,进而杀死疟原虫。与此相对应的是,正常红细胞中的血红素分子由于被牢牢地结合在血红蛋白中而无法激活青蒿素。因此青蒿素对于正常细胞的毒副作用非常小。这也就是说,疟原虫噬血的本性使其不可避免地成为青蒿素攻击的目标。
笔者团队设计合成的青蒿素类似物可以在体内和体外实验中直观地显示药物活性,由此揭示青蒿素在不同寄生虫生存阶段的活化机制,并鉴别出其广泛的靶蛋白位点。这些靶蛋白的识别有助于人们进一步了解疟原虫的生长代谢规律,针对某些地区出现的日益严重的疟原虫抗药性,设计出更有效的用药方案。
青蒿素独有的激活方式也与目前发现的青蒿素抗药性有着紧密的联系。通过现有的研究成果,可以针对疟原虫代谢特点和生存周期,科学地设计与测试新的青蒿素治疗周期与用药方案,减缓耐药性的发生。与此同时,可以运用结构生物学方法,更加准确地解析青蒿素与其靶蛋白结合的精准方式,从而设计更加高效的青蒿素衍生药物。目前的研究还不能检测非共价键连接的靶点,因此,开发新的青蒿素类似物用以捕捉暂时性的青蒿素一蛋白间的相互作用是一个非常有意义的研究方向。确定每个共价或者非共价连接的青蒿素靶蛋白在寄生虫杀伤中的作用也将是未来研究的热点。
青蒿素也许是自然界中最聪明的一类药物,谁会想到大自然会设计出一种巧妙利用寄生虫噬血的特性去对付它呢?青蒿素治疗疟疾只是一个例子,也许还有一些现代医学束手无策的疾病在大自然中已经有了解决方案,自然界生物进化过程中有着太多的东西值得我们去学习和了解,并运用它们来解决人类面临的问题。
