南方根结线虫Mi—eft2 基因 RNAi 沉默效应研究
2016-05-30黎娟华孙海彦赵平娟彭明
黎娟华 孙海彦 赵平娟 彭明


摘 要 以南方根结线虫延长因子2基因(Mi-eft2)T克隆质粒为模板,克隆该基因的3个部分片段(各200 bp),作为体外合成dsRNA的模版,利用该 dsRNA(F1ds,F2ds,F3ds)干扰南方根结线虫2龄幼虫(J2)的Mi-eft2表达。结果显示,利用real-time PCR作为检测方法,干扰处理后的J2线虫Mi-eft2的表达量(F1、F2、F3),与对照处理的J2线虫Mi-eft2的表达量(F0)相比,分别降低了21%、69%、0.02%。将经过干扰处理的J2线虫和作为对照处理的J2线虫(500头/株)分别接种5株番茄,培养45 d后观察表型。发现干扰处理后J2线虫与对照处理的J2线虫接种番茄后产生的根结数相比较,分别减少了57.09%、68.94%、7.01%。说明Mi-eft2表达的沉默效应会使南方根结线虫对番茄造成的危害程度相应降低,也说明了利用RNAi干扰该基因表达的方法有利于对南方根结线虫病害防治方法的探索。
关键词 南方根结线虫;Mi-eft2;RNA干扰;双链RNA
中图分类号 S432.45 文献标识码 A
Abstract Three partial fragments(each 200 bp)of the elongation factor 2 gene(Mi-eft2)were PCR cloned by using the south root knot nematode(Meloidogyne incognita)Mi-eft2 T-cloning plasmid as the template. And the fragments were used as the templates for the in vitro synthesis of double strain RNA(dsRNA). That three dsRNA(F1ds,F2ds,F3ds)were used to interfere the expression of Mi-eft2 of the M. incognita J2 nematodes. The J2 nematodes without interference treatment were used as the control treatment. As results, by using real-time PCR as the detection method, compared with the expression data of Mi-eft2 of the control treatment, the Mi-eft2 expression data of the J2 nematodes after interference-treatment(F1, F2, F3)were silenced in varying degrees, which reducing within 21%, 69%, 0.02%, respectively. The J2 nematodes after interference treatment and the J2 nematodes of the control treatment were inoculated 5 tomatoes respectively(500 nematodes/plant), and then the plants were cultivated 45 days before phenotype investigation. As results, compared with the quantity of root knot caused by the control treatment J2 nematodes, the quantity of root knot caused by the J2 nematodes after-interference treatment reduced within 57.09%, 68.94%, 7.01%, respectively. The results provided that in this research, the disease severity of tomato caused by M. incognita would decrease accordingly, along with the silence effect of the expression of Mi-eft2. It suggested that the method by using RNAi to interfere this gene's expression would be good for the strategy study of the south root knot nematode disease control.
Key words Meloidogyne incognita; Mi-eft2; RNA interference; Double strain RNA
doi 10.3969/j.issn.1000-2561.2016.06.022
植物寄生性線虫对农作物的危害严重,影响了农作物的产量和品质。南方根结线虫(Meloidogyne incognita)是重要的植物寄生线虫之一,寄主广泛,在世界上每年造成的损失达上千亿美元[1-2]。化学防治,包括土壤熏蒸法,是最常用的防治根结线虫的方法。但是大部分杀线虫的药剂都是非特异和有毒的,对环境、地下水和人畜危害较大,所以,化学防治方法受到了限制。农作物植物寄生线虫的危害越来越严重[3],因此,对新的防治根结线虫病害方法的研究非常重要。RNA干扰(RNA interference,RNAi)这种反向遗传学方法可以使模式线虫秀丽隐杆线虫(Caenorhabditis elegans,C. elegans)的基因沉默[4-5]。同样,将RNA干扰的方法应用于沉默根结线虫的基因,使线虫的生长发育和繁殖受到干扰,从而实现对根结线虫防治的相关研究[6-8],也是防治根结线虫的一种新方向。如何选择根结线虫靶基因进行沉默是这种方法的关键。笔者在发掘可用于培育沉默根结线虫的转基因植物过程中,克隆到一个南方根结线虫的延长因子2基因(elongation factor 2,Mi-eft2),该基因与C. elegans的延长因子2基因(Ce-EF2)有 86.9%的同源性;蛋白质功能预测结果表示,该基因具有水解酶的活性,在蛋白质延长过程中起作用,与真核生物中的延长因子2基因(EF2)的功能相似[9-11]。在利用RNAi敲除模式线虫秀丽隐杆线虫基因,鉴定其功能的过程中发现,对EF2的沉默会引起线虫发育受阻、胚胎致死及产卵减少,证明EF2基因是线虫生命周期必须的重要基因[4],而且该基因在真菌、细菌、动物、植物中都很保守[12]。因此,笔者利用RNAi干扰南方根结线虫Mi-eft2基因的表达,通过接种寄主植物番茄来研究南方根结线虫危害植物的能力变化,有利于人们理解南方根结线虫的生命周期和致病性,对探索防治南方根结线虫病害方法的研究有一定意义。
1 材料与方法
1.1 材料
1.1.1 菌种、质粒与材料 靶基因Mi-eft2的T克隆载体质粒为本实验室保存。Escherichia coli Top10感受态细胞购自天根公司(Tiangen Biotech Beijing CO., LTD)。南方根结线虫采自海南海口,并于大棚中单卵块纯化和培养,培养新鲜孵化2龄幼虫用于实验。番茄品种为广东蔬菜研究所生产宝石F1。
1.1.2 试剂及测序 胶回收试剂盒、质粒提取试剂盒为天根公司产品,RNA提取试剂盒为invitrogen公司的RNA purification regagent, dsRNA合成试剂盒为promega公司的T7 RioMAXTM Express RNAi System(货号:P1700),real-time PCR产品(产品货号:DRR081A)购自TAKARA公司,PCR反应体系Taq MasterMix 2X(货号KT201-02)购自天根公司,cDNA第一链合成试剂盒FastQuant RT Kit(with gDNase)购自天根公司,其他试剂均为国产分析纯。序列测定由上海生物工程技术有限公司完成。
1.2 方法
1.2.1 总RNA的提取及cDNA第一链合成 总RNA的提取:将南方根结线虫2龄幼虫或成熟雌线虫于提取液中研磨,提取方法参照说明书(DP320-02, DP407-02)。cDNA第一链合成以南方根结线虫的总RNA为模板,使用天根公司的 FastQuant RT Kit(with gDNase)进行,方法参照说明书(KR106)。
1.2.2 dsRNA目标模板合成 根据笔者已发表的靶基因Mi-eft2的序列[9],分别从该基因5′(自开放阅读框起第1~200 bp)、3′(自开放阅读框起第2 131~2 331 bp)和中间部分(自开放阅读框起第1 459~1 659 bp)选择3个长度为200 bp合成目的dsRNA片段,这3个模板片段分别命名为 Fragment1,Fragment2,Fragment3,简写为 F1,F2,F3。并根据这些片段分别设计引物,引物退火温度60 ℃左右。因为本实验所用合成 dsRNA 的试剂盒,合成一个dsRNA片段,需要在同一个片段的5′、3′端分别添加含T7启动子的序列,并以这2个片段为模板合成dsRNA(详情见试剂盒使用方法)。因此根据这3个片段分别设计了含T7启动子序列(以下加下划线的序列)的引物。引物F1:F1-F-F:5′-TAATACG
ACTCACTATAGGATGAAGGCTCGAATTCAA-3′F1-F-R: 5′-AAGGGTCCTAATCAACACCAACAA-3′;F1-R-F: 5′-ATGAAGGCTCGAATTCAA-3′/F1-R-R: 5′-TAATACGACTCACTATAGGAAGGGTCCTAA
TCAACAC-3′。F2引物:F2-F-F: 5′-TAATACGA
CTCACTATAGGATGGTGCAATGCATTTT-3′/ F2-F-R: 5′-AAGGGTCCTATGAAAGGCACAT-3′;F2-R-F: 5′-ATGGTGCAATGCATTTT-3′/ F2-R-R: 5′-TAATACGACTCACTATAGGAAGGGTCCTATGAAA
G-3′。F3引物:F3-F-F: 5′-TAATACGACTCACT
ATAGGGAATACAAGAGCCAGTC-3′/ F3-F-R: 5′-AGGGTCCTACAGTATTTGAACGCA-3′;F3-R-F: 5′-GAATACAAGAGCCAGTC-3′/ F3-R-R: 5′-TAA
TACGACTCACTATAGGAGGGTCCTACAGTATT-3′)。以Mi-eft2的T克隆载体质粒为模板,扩增目标片段。PCR反应体系为Taq MasterMix 2× 25 μL(Taq MasterMix 2×包括:0.1 U Taq Polymerase/μL,500 μmol/L dNTP each,20 mmol/L Tris-HCl(pH8.3),100 mmol/L KCl,3 mmol/L MgCl2),正向引物(10 μmol/L)2 μL,反向引物(10 μmol/L)2 μL,模版0.2 μL(<1μg),dH2O(灭菌蒸馏水)补至50 μL。反应条件为:94 ℃预变性3 min;94 ℃ 变性20 s,退火20 s,72 ℃ 延伸20 s,退火温度为 60 ℃,25個循环;最后72 ℃ 延伸10 min。PCR产物经1%琼脂糖凝胶电泳回收,连接于pMD18-T Simple载体,并转化大肠杆菌Top10菌株的感受态细胞,然后送测序。
1.2.3 dsRNA合成 dsRNA的合成方法参照说明书(Part# TB316)。分别将添加T7启动子的5′,3′模板各500 ng加入合成体系,按照以下步骤进行:①37 ℃条件下进行体外转录,30 min;②70 ℃,反应10 min,再在室温下冷却20 min,目的为生成dsRNA;③加入DNase和稀释了200倍的RNase,37 ℃,反应30 min,目的为降解DNA模板和单链 RNA;④加入0.1体积3 mol/L的醋酸钠(pH5.2),1体积的异丙醇,置冰上5 min,13 000 r/min离心收集沉淀;⑤加入0.5 mL冷冻的70%乙醇,13 000 r/min离心5 min,弃上清,自然风干15 min,⑥加入原始反应体积的2~5倍无核酸超纯水溶解,原液稀释100倍后,分光光度计OD260测浓度,-70 ℃保存待用。
1.2.4 南方根结线虫Mi-eft2基因的RNA干扰和检测 南方根结线虫2龄幼虫Mi-eft2基因的 RNA干扰方法参照Rosso等[13]Yohei等[14]。将2龄幼虫浸泡在50 μL的含有1.0 μg/μL的dsRNA特定溶液中[14](1.25 g/L NaCl,0.75 g/L NH2PO4,1.5 g/L Na2HPO4,3 mol/L spermidine,0.05% gelatine,1% resorcinol),对照处理将线虫浸泡在不含dsRNA的特定溶液中。室温条件下浸泡4 h。将对照和干扰处理后的线虫分别取样提取总RNA,然后合成第一链cDNA,以此为模板,根据线虫Mi-eft2基因和内参基因actin的序列分别设计 PCR引物,PCR产物根据所用试剂盒产品说明设计为150 bp,目标基因的PCR引物为:E2-F/E2-R(E2-F:5′-ATGGTGCAATGCATTTT-3′/ E2-R:5′-AAGGGTC
CTATGAAAGGCA-3′),内参基因β-actin的序列(CF099470)引物为Act-F/Act-R(Act-F:5′-AGGC
TGGATTTGCGGGTGATGAT-3′/ Act-R:5′-AAGAG
GTATCTTGACTTTGAA-3′)。然后利用Real time PCR的方法检测处理后目标基因的表达变化情况,确定对南方根结线虫目标基因的 RNA干扰效果。Real time PCR反应体系为:SYBRR Premix Ex TaqTM II(2×)12.5 μL,正向引物(10 μmol/L)1 μL,反向引物(10 μmol/L)1 μL,模板 2 μL,dH2O(灭菌蒸馏水)补至25 μL。所用仪器为Stratagene公司的Mx3005p。Real-time PCR程序為检测相对表达量的算法Comparative Quantitation(Calibrator),反应条件为:95 ℃预热30 s;95 ℃,5 s,60 ℃,20 s秒,40个循环,并采集信号;每个样品3个重复,PCR 3次重复。数据分析软件为MxPro-3005p。
1.2.5 RNA干扰后线虫和寄主植物的共培养 将发芽后14 d大的番茄苗移到直径10 cm的塑料花盆,土壤和蛭石比例为3 ∶ 1;每盆单独放置培养7 d,然后将对照(未经处理的线虫)和经过 RNA干扰处理的线虫经镜检确定数量,500头/株,放置在番茄根附近,共培养45 d。对照和3个dsRNA片段共4个处理,每个处理和5盆番茄共培养;观察线虫侵染番茄结果,统计根结数和卵块数。番茄培养条件为室外自然条件。
1.3 数据处理
本研究所涉及数据统计分析:real time PCR 检测基因相对表达量的数据分析由MxPro-3005p 自动产生;干扰处理的线虫接种番茄后所产生的根结数与对照处理的线虫接种番茄后所产生的根结数通过Microsoft Excel进行标准差统计再对以上两类数据分别用SPSS 19.0中的Dunnett's多重比较进行单向方差分析。
2 结果与分析
2.1 dsRNA目标模板及dsRNA的合成
根据设计好的引物组合(F1-F-F/F1-F-R,F1-R-F/F1-R-R;F2-F-F/F-2F-R,F2-R-F/F1-R-R;F3-F-F/F3-F-R,F3-R-F/F3-R-R)扩增目标片段,产物分别记为:F1F,F1R;F2F,F2R;F3F,F3R。经测序发现扩增片段大小为200 bp,与目标片段序列一致。结果见图1。
dsRNA目标片段F1、F2、F3的合成模板分别为:F1F/F1R;F2F/F2R;F3F/F3R。将对应的模板以500 ng的量加入反应体系,dsRNA合成结果见图2,分别标记为 F1ds、F2ds、F3ds。目标片段的大小是200 bp,因为dsRNA的迁移速率比dsDNA慢,所以dsRNA产物的位置在 250 bp左右。所得产物经OD260测浓度后用于RNA干扰溶液的配制。
2.2 南方根结线虫Mi-eft2基因的RNA干扰及检测
对南方根结线虫RNA干扰处理和对照处理的线虫进行采样,通过镜检发现,经过RNAi处理的线虫活力和对照处理线虫活力相当。将采样的线虫提取总RNA,用于检测目标基因干扰效果实验;将对照处理的线虫(名称是F0)Mi-eft2基因表达量设为 Calibrator,数值是1,检测其它3个片段干扰处理线虫的相对表达量(名称和数值分别为:F1:0.79、F2:0.31、F3:0.98,均为平均数),结果见图3所示。从结果可以看出,F2的目标基因表达量比对照目标基因表达量减少了大约69%,F1的目标基因表达量比对照的目标基因表达量则减少了大约 21%,方差分析显示 :F2、F1的结果与对照 F0 的结果相比差异显著,而F3的目标基因表达量与对照相比变化不大。由此推测目标片段F2的dsRNA对线虫该基因的干扰效果最明显,F1的dsRNA对线虫该基因的干扰效果则次之,F3的dsRNA对线虫该基因的干扰效果基本没有发生变化。
2.3 RNAi处理后的线虫对寄主植物接种结果
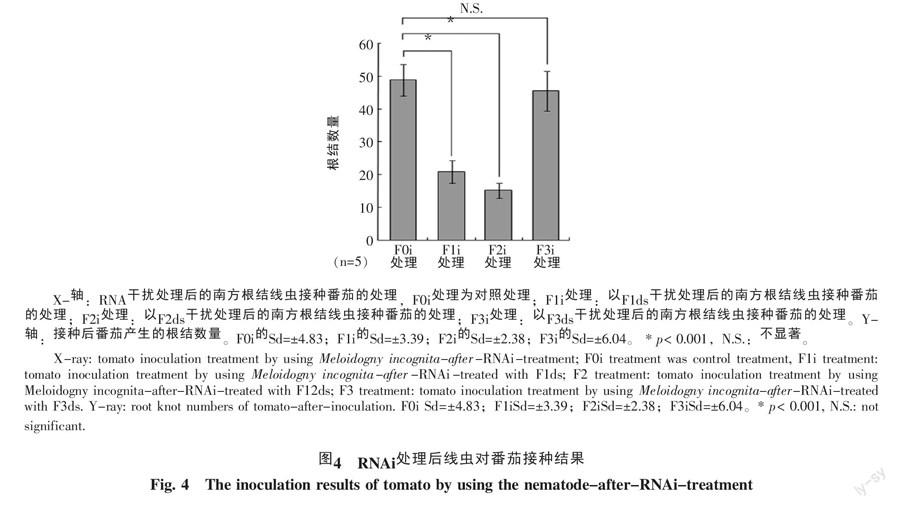
用 RNAi 处理过的线虫接种番茄 45 d后,将番茄根上的泥用水冲净,在显微镜下统计所产生的根结数量,与对照处理(标记为F0i)进行比较。3个dsRNA处理过的线虫接种番茄(分别标记为:F1i、F2i、F3i)产生的根结数见图4所示。对照F0i番茄根中平均产生了48.93个根结;F1i番茄在根中平均产生了21个根结,相比对照减少了57.09%;F2i番茄在根中则平均产生了15.2个根结,相比对照减少了68.94%;F3i 番茄在根中则产生了45.5个根结,相比对照减少了7.01%。从图3和图4可以看出,线虫目的基因表达受到干扰程度和线虫接种番茄后在根中产生根结的数量变化趋势一致,说明对Mi-eft2表达的干扰,影响了南方根结线虫在番茄根中产生根结的数量,干扰越大,影响就越大,产生的根结数量越少,对植物造成的危害也减少。
3 讨论与结论
据报道,南方根结线虫Mi-eft2基因的保守区域和真核生物延长因子2的保守区域同源性很高,说明该基因在线虫里高度保守;同时预测 Mi-eft2推测蛋白MI-EFT2具有和真核生物延长因子2相似的功能[9]。因此对该基因的分离和鉴定有利于人们认识南方根结线虫的生长发育周期。随着现代农业的发展,根结线虫病的为害逐年加重[15-16],RNA干扰可以沉默根结线虫的基因,使线虫的生长发育和繁殖受到干扰,从而实现对根结线虫的防治[6-8],也是一种值得探索的新方向。
笔者通过沉默南方根结线虫的Mi-eft2基因,接种寄主植物番茄后发现:Mi-eft2的表达受到干扰后,该线虫在番茄根中形成的根结数,与对照处理的根结数相比较,降低了57.09%~68.94%。与对照相比,目的基因的沉默会引起线虫对寄主造成危害程度的变化,而且基因沉默的效果越大,线虫对寄主的危害就越低,如图3,图4所示。这说明南方根结线虫对寄主的危害能力可能跟Mi-eft2基因相关。但是该基因的沉默影响线虫的发育、繁殖,还是影响线虫的寄生能力还有待进一步的研究鉴定。
本研究中,同一个基因,选取序列不同的区域来合成 dsRNA 片段,对该基因产生了不同的干扰沉默效果,从序列的 5′、3′端选取的片段,干扰效果没有序列中间部分片段的干扰效果好,或许是因为在基因序列的5′端和3′端附近一般会存在某些调控元件等蛋白结合位点[17],影响了dsRNA片段对序列的沉默效应。同时,进行in vitro RNAi时,一般需设置一个非靶标基因的dsRNA作为对照,以证明靶标基因的沉默确实是靶标基因的dsRNA导致的,国际上比较常用GFP作对照。虽然在本研究中没有使用GFP作为对照,但是本研究所使用的 3 个片段合成靶标基因dsRNA中,有1个片段几乎没有干扰效果,因此可认为靶标基因的沉默是由靶标基因dsRNA导致的。从图3、4可以看出,F2对线虫基因的干扰效果与对照的结果相比,基因表达量降低了69%,该干扰处理后的线虫接种寄主植物后危害降低了,表现在产生的根结数减少了68.94%;而 F1对线虫基因的干扰效果与对照的结果相比,基因表达量降低了21%,该干扰处理后的线虫接种寄主番茄后,产生的根结数量却减少了57.09%,对寄主的危害程度与 F2 的对应趋势不同,这说明体外合成dsRNA片段可以快速地沉默线虫的目的基因,但是干扰处理过的线虫接种寄主植物后,在培养过程中,土壤和自然环境中不可控制的因素很多,所以使得研究结果具有一定的局限性。
由于Mi-eft2在真核生物中比较保守,对于本研究中用于合成dsRNA的3个DNA片段的选择,可能会非特异沉默其他生物的eft2基因。因此,在利用体外合成dsRNA快速沉默南方根結线虫目的基因来研究其特性外,今后笔者还将考虑该3个片段与其它线虫甚至高等生物的同源性,通过与其他物种的序列比对,找出该基因DNA序列中非同源性的序列进行合成靶基因dsRNA片段的设计,然后,再构建表达该基因dsRNA的植物表达载体,得到相应的转基因植物,进行接种线虫的实验,以期获得更准确的结果。
参考文献
[1] Trudgill D L and Bloc V C, Apomictic, polyphagous root-knot nematodes: exceptionally successful and damaging biotrophic root pathogens[J]. Annu Rev Phytopathol, 2001, 39, 53-77.
[2] Chitwood D J. Research on plant-parasitic nematode biology conducted by the United States Department of Agriculture-Agricultural Research Service[J]. Pest Menag Sci, 2003, 59: 748-753.
[3] 赵 鸿, 彭德良, 朱建兰. 根结线虫的研究现状[J]. 植物保护, 2003, 29(6): 6-9.
[4] Fraser A G, Kamath R S, Zipperlen E, et al. Functional genomic analysis of C. elegans chromosome I by systematic RNA interference[J]. Nature, 2000, 408(6810): 325-330.
[5] Kamath R S, Fraser A G, Dong Y, et al. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi[J]. Nature, 2003, 421: 231-237.
[6] Huang G Z, Allen K Davis E L, et al. Engineering broad root-knot resistance in transgenic plants by RNAi silencing of a conserved and essential root-knot nematode parasitism gene[J]. PNAS, 2006, 103(39): 14 301-14 306.
[7] Yadav B C, Veluthambi K, Subramaniam K. Host-generated double stranded RNA induces RNAi in plant-parasitic nematodes and protects the host from infection[J]. Mol Biochem Parasitol, 2006, 148: 219-222.
[8] Fairbaim D J, Cavallaro A S, Bernard M, et al. Host-delivered RNAi: an effective strategy to silence genes in plant parasitic nematodes[J]. Planta 2007, 226(6): 1 525-1 533.
[9] 黎娟华, 赵平娟, 孙海彦, 等. 南方根结线虫延长因子2基因 cDNA全长克隆和序列分析[J]. 中国农学通报, 2011, 27(01): 223-228.
[10] Andersen J S, Lam Y W, Leung A K, et al. Nucleolar proteome dynamics[J]. Nature, 2005, 433(7021): 77-83.
[11] Tu L C, Yan X, Hood L, et al. Proteomics analysis of the interactome of N-myc downstream regulated gene 1 and its interactions with the androgen response program in prostate cancer cells[J]. Mol Cell Proteomics, 2007, 6(4): 575-588.
[12] Li X, Alafuzoff I, Soininen H, et al. Levels of mTOR and its downstream targets 4E-BP1, eEF2, and eEF2 kinase in relationships with tau in Alzheimer's disease brain[J]. FEBS J, 2005, 272(16): 4 211-4 220.
[13] Rosso M N, Dubrana M P, Cimbolini N, et al. Application of RNA interference to root-knot nematode genes encoding esophageal gland proteins[J]. Mol Plant Microbe Interact, 2005, 18(7): 615-620.
[14] Yohei M, Kayo K, Tahashi I, et al. RNA interference-mediated growth control of the southern root-knot nematode meloidogyne incognita[J]. Biosci Biotechnol Biochem, 2012, 76(2): 378-380.
[15] 郭荣君, 刘杏忠. 根际细菌与植物寄生线虫[M]. 北京, 中国科学技术出版社, 2004: 51-65.
[16] 徐建华, 李红梅, 沈培垠, 等. 南方根结线虫群体间致病性变异的生物测定[J]. 南京农业大学学报, 1999, 22(3): 33-36.
[17] 宋尔卫. RNA干扰的生物学原理与应用[M]. 北京: 高等教育出版社, 2005: 100-110.
