香蕉不同生育期根际土壤细菌群落变化研究
2016-05-30孙建波邹良平李文彬王宇光彭明
孙建波 邹良平 李文彬 王宇光 彭明

摘 要 土壤微生物是土壤质量和健康的敏感性指标。研究认为,根际微生物区系失调是作物土传病害发生的一个重要原因。通过对香蕉不同生长期根际土壤中细菌多样性和数量的研究,对香蕉枯萎病发生的机理及生物防治具有重要意义。实验采用Real-time PCR和T-RFLP技术,对巴西蕉不同生长期根际细菌数量和多样性进行了研究。结果表明:随着香蕉生长期的增加,根际土壤细菌数量从3月的1.1×1010 copies/g土壤逐渐增加到7月的2.7×1010 copies/g土壤,随后逐渐减少。然而,根际细菌多样性从3月到7月呈逐渐减少趋势,到7月达到最低,为1.99。另外,不同月份中优势菌的种类和在总细菌中所占的比例也不同。在实验期内,随着香蕉生育期的延长,某些细菌种类大量繁殖,土壤根际细菌群落结构失衡,土壤微生物环境有恶化趋势。
关键词 香蕉;根际;土壤细菌群落;末端限制性酶切长度片段多态性;荧光定量PCR
中图分类号 S668.1 文献标识码 A
Abstract Soil microorganism is a sensitivity index of soil quality and health. Some studies have indicated that the decline of microbial communities in the rhizosphere is an important reason for soil-borne diseases. The research on bacterial diversity in the rhizosphere of banana can be helpful to understand the mechanism of fusarium and know how to control it by biological methods. In this study, the techniques of Real-time PCR and terminal restriction fragment length polymorphlsm were used to analyze the abundance of soil bacteria and bacterial diversity in the rhizosphere of banana. During the growing stages from March to July, the abundance of bacteria changed from 1.1×1010 copies.g-1 soil in March to 2.7×1010 copies/g soil in July, and then gradually decreased. In contrast, the indices of bacterial diversity decreased from 2.52 in March to 1.99 in July. However, it increased gradually from July to September. In addition, significant changes of the bacterial community abundance and diversity of dominant bacteria were observed in the rhizosphere of banana. The species and proportion of dominant bacteria were significantly changed in different growing stages of banana. The results indicated that the abundance of soil bacteria and bacterial diversity in the rhizosphere were changed during the growing stage of banana.
Key words Banana; Rhizosphere; Soil bacterial communities; T-RFLP; Real-time PCR
doi 10.3969/j.issn.1000-2561.2016.06.019
香蕉枯萎病是一種土传病害,目前化学药剂和抗性育种对香蕉枯萎病的防效有限。因此,迫切需要寻找新的防治香蕉枯萎病的方法。近年来,越来越多的学者提出从根际微生物区系的角度来研究作物土传病害的新思路。
土壤中微生物种群及结构的异常变动与作物土传病害的发生密切相关。土壤中有益微生物与有害微生物之间保持着一定的动态平衡关系。已有研究表明,良好的根际微生物区系可以有效抑制土传病害的发生[1-3]。研究认为,微生物种群结构失衡是导致连作障碍和作物减产的重要原因[4-5]。
当土壤中微生物多样性水平降低、病原拮抗菌减少时,土壤抑制病害能力降低,病害随之发生。吴凤芝等[6]研究表明,不同作物与黄瓜间作提高了黄瓜土壤细菌多样性,降低了黄瓜病情指数。王丽丽等[7]研究表明,通过增加烟草土壤中细菌群落的多样性和数量,可以有效防控烟草青枯病和连作障碍。
因此,研究香蕉不同生育期土壤中微生物菌群的演替规律,进一步明确不同生育期的优势菌,进而针对性地引入病原拮抗菌和有益菌,对抑制病原菌增殖和病害发生具有重要意义,而目前还未见相关研究报道。
实时荧光定量PCR(Real-time PCR)技术由于具有较高的特异性和灵敏性,已广泛应用于土壤微生物的检测方面。末端限制性片段长度多态性(T-RFLP)技术能获得大量因无法培养而不能获得的微生物信息,已被用来研究复杂的细菌群落结构。
细菌在土壤微生物群落中数量和种类最多,在土壤生态系统中起着主要作用。本研究通过分析香蕉生长期根际土壤细菌群落的变化,为在实践中通过土壤微生物种群和结构的改良,减轻香蕉土传病害和连作障碍提供依据。
1 材料与方法
1.1 材料
香蕉品种为巴西蕉(Musa sp., AAA, Cavendish group cv. Baxi)。香蕉组培苗于2月种植于中国热带农业科学院热带生物技术研究所试验田。供试土壤热带红壤土,前茬未种植任何作物。土壤基本理化性质为:有机质含量1.48%、碱解氮595.60 mg/kg、有效磷129.30 mg/kg、速效钾43.39 mg/kg、pH6.65。试验地采用常规管理,人工去除杂草。每2个月采用抖落法收集根部土壤,过筛后存于4 ℃冰箱。各处理重复3次,每次重复4株香蕉。对照不种植任何作物。
1.2 方法
1.2.1 土壤总DNA的提取 利用Fast DNA SPIN kit for soil(Qbiogene)提取。DNA的纯度和浓度利用紫外分光光度计测定(Jasco,Tokyo,Japan)。每个土样平行提取3次混合作为1次重复。
1.2.2 Real-time PCR 细菌群落数量的大小利用实时荧光定量PCR(Real-time PCR)来分析。Real-time PCR反应体系:25 μL反应体系中包含12.5 μL SYBRGreen PCR Master Mix,10 ng模板DNA,0.1 μmol/L细菌通用引物338F:5′-CCTACGGGAG
GCAGCAG-3′和518R:5′-ATTACCGCGGCTGCTG
G-3′[8]。反应条件为:95 ℃ 3 min;95 ℃变性30 s,53 ℃退火40 s,72 ℃延伸1 min,40个循环。每一个土壤样品3次重复。
1.2.3 标准品制备 利用通用引物27F:5′-AGA
GTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTAC
CTTGTTACGACTT-3′[9]扩增细菌保守区16S rDNA片段。反应体系和条件同上。PCR纯化后与pGEM-T载体连接构建重组质粒。将测序正确的阳性克隆扩增培养后提取质粒DNA,用紫外分光光度计测定其浓度,梯度稀释后用作标准品。标准品质量浓度根据核酸分子长度和阿伏加德罗常数换算成模板拷贝数浓度。
1.2.4 细菌群落数量大小的计算 待测样品与标准品应用同一反应条件,同时进行Real-time PCR,根据荧光定量PCR仪自动生成的标准曲线计算对待测样品进行定量分析。
1.2.5 T-RFLP 用细菌通用引物27F:5′-AGAG
TTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACC
TTGTTACGACTT-3′[10]。扩增细菌16S rDNA保守区片段。其中27F引物的5′端用6-carboxyfluorescein(6-FAM)荧光标记以便检测。25 μL PCR反应体系如下:10×PCR buffer(无Mg2+)2.5 μL,dNTP(10 mmol/L)0.5 μL,Mg2+(25 mmol/L)2 μL,引物(20 μmol/L)各0.25 μL,Taq DNA polymerase(5 U/μL)0.25 μL,模板DNA 0.5 μL。反应条件为95 ℃ 3 min,95 ℃变性30 s,52 ℃退火1 min,72 ℃延伸1.5 min,30个循环。每个土壤样品3次重复,PCR产物经1%琼脂糖凝胶电泳检测后混合并用Qiagen gel extraction kit(Qiagen, Germany)纯化。纯化后的PCR产物用HaeIII限制性内切酶進行酶切。20 μL酶切反应体系中包含8 μL PCR产物,2.0 μL 10×PCR buffer,3U HaeIII内切酶,混匀后37 ℃酶切3 h。酶切产物用纯化试剂盒(Omega)进行脱盐纯化。纯化产物送往上海生工生物公司在ABI 373测序仪(Applied Biosystems)上进行基因扫描。
1.3 数据分析
末端限制性片段(Terminal restriction fragments,T-RFs)的大小和强度采用GENEMAPPER(4.0,Applied Biosystem)软件进行分析。每个T-RF的相对丰度以相对峰面积值(即每个T-RF所拥有的峰面积占总峰面积的百分比)计算。为避免杂峰的干扰,T-RF相对丰度低于2%的不予考虑,另外,片段长度小于50 bp或大于600 bp的T-RF也不予分析。相对丰度大于6%的T-RF被认为各处理中的主要细菌。本实验中各相对丰度为前5位的T-RF所代表的细菌被称为各处理中的优势细菌。利用BIO-DAP软件进行细菌群落多样性指数(Shannon Diversity H′)的计算。利用SPSS进行统计分析。
2 结果与分析
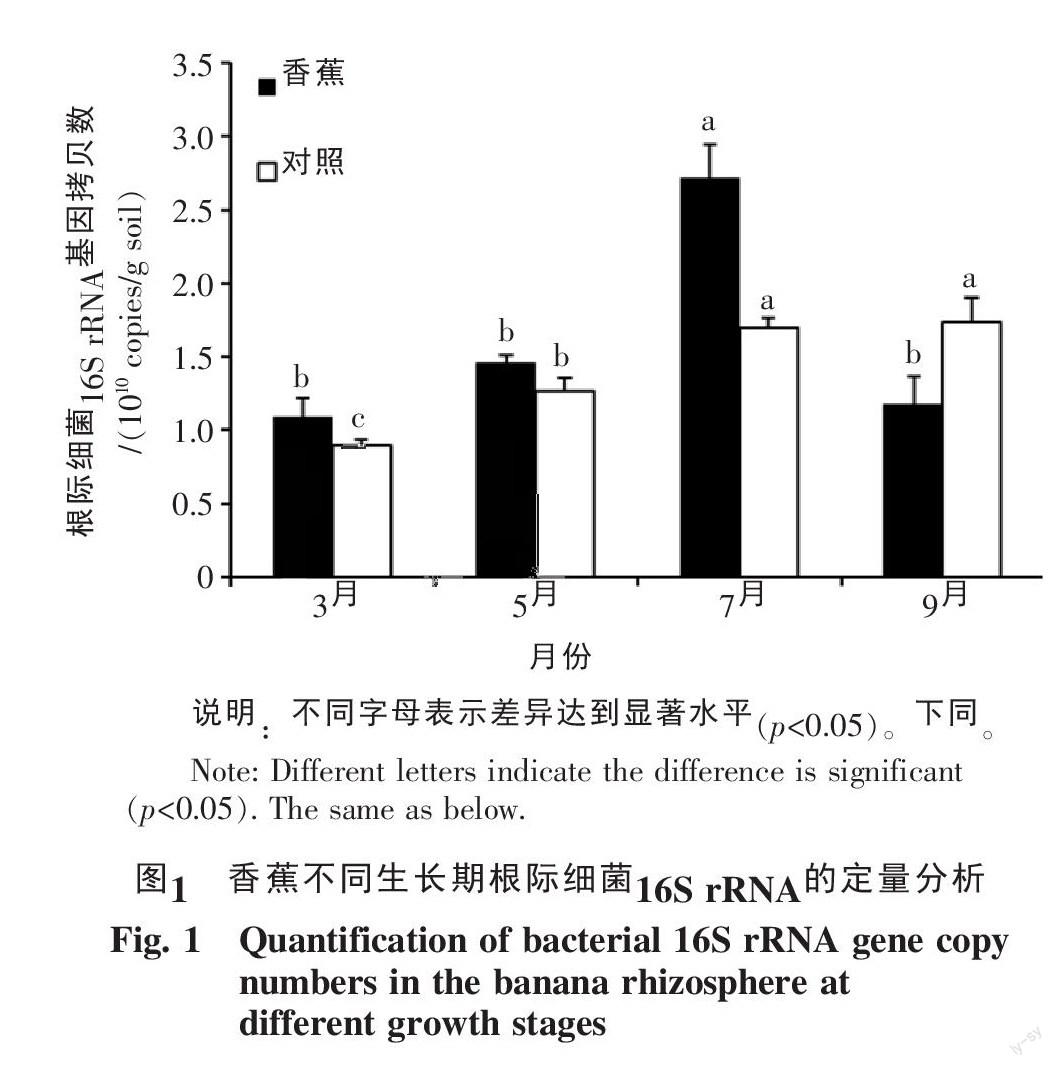
2.1 香蕉不同生长期根际细菌数量分析
本实验中基于细菌16S rRNA保守基因进行Real-time PCR扩增,对香蕉根际土壤总细菌进行定量分析。实验结果表明,在香蕉生长的不同时期,根际细菌数量发生了明显的变化。3、5、7和9月根际土壤细菌数量分别为1.1×1010、1.5×1010、2.7×1010、1.2×1010 copies/g土壤(图1)。由图1可以看出,3~7月,根际细菌数量呈逐渐增加趋势,到7月达到最大值,随后逐渐下降。Duncan检验表明,7月细菌数量显著高于其它月份。
2.2 香蕉不同生长期根际细菌多样性分析
根据统计分析可知,不同时期根际细菌的种类和相对丰度都发生了明显的变化。去除杂峰干扰后的有效片段在3、5、7、9月的数量分别为15、14、10、13条。3~7月,细菌群落数逐渐减少,到9月又有所上升。主要细菌种类在不同生长期也表现出差异:3、5、7、9月的主要细菌种类分别为10、8、6、8种。
图2是香蕉不同生长时期根际细菌多样性的变化情况。3、5、7、9月根际土壤细菌多样性分别为2.52、2.48、1.99、2.08。从图中可以看出,3~7月,Shannon多样性指数呈下降趋势,然后又逐渐上升。
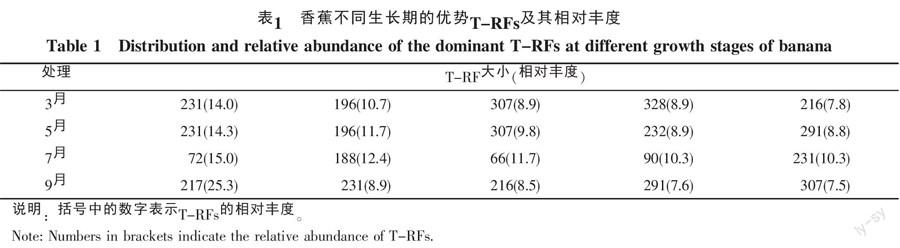
表1显示了香蕉不同生长期根际土壤中优势群落情况。在3月和5月,共有的优势菌T-RF为231、196、307 bp的细菌。但它们在不同月份占总细菌中的比例却不相同。在3月,231、196、307 bp的峰面積占总峰面积的比例分别为14.0%、10.7%、8.9%。而在5月,231、196、307 bp所占总峰面积的比例却变为14.3%、11.7%、9.8%。在7月和9月,共有的优势菌只有231 bp所代表的细菌。并且231 bp所占比例从7月的10.3%减少为9月的8.9%。另外,每个月份特有优势菌群的数量也发生了变化,3、5、7、9月特有细菌的数目分别为1种(328 bp)、1种(232 bp)、4种(72、188、66、90 bp)和1种(217 bp)。
以上结果表明:香蕉生长期间根际土壤细菌数量、多样性和群落结构发生了明显的变化。
3 讨论
本研究结果表明:香蕉根际微生物数量随着香蕉生长发育阶段的不同而不同。香蕉根际细菌数量在7月达到最大后开始下降。金凌波等[11]研究表明,春季大豆从苗期到盛花期,根际细菌数量增加,盛花期到成熟期,又呈现减少趋势。于翠等[12]研究表明,本溪山樱根际解磷细菌数量在萌芽期最低,之后逐渐升高,落叶期又开始降低。并且认为,是由于根系生理代谢活动的强弱不同导致了解磷细菌数量的差异。这些结果均与本研究的结果相似。本研究中,香蕉根际土壤细菌多样性指数随着生育期的延长呈现出先下降然后又上升的趋势。赵春芳等[13]研究表明,正茬麦冬在生长期,其根际土壤细菌多样性也呈现先下降再上升趋势,并且这种变化与作物生长代谢的强弱有关。本试验中,根际土壤细菌数量在7月达到最高,然而多样性指数在7月却最低,这原因可能是香蕉根系在7月生理代谢旺盛,其代谢产物仅有利于某些特定菌群的生长而发展成为优势菌群,这些优势菌群对另外一些菌群具有竞争优势,结果造成少数优势菌群的大量繁殖,另外一些菌群在竞争中被抑制或消失。
根际土壤微生物的数量和种群结构与根系分泌物关系密切[14-15]。香蕉生长前期植株生长代谢逐渐加强,分泌物也逐渐增多,从而有利一些细菌的生长。7月后微生物数量呈下降趋势,这种变化可能与根系代谢下降从而根系分泌物减少有关。微生物种群在竞争根系分泌物营养的同时,会造成一些微生物种群的消失[16-17],这样就打破了根际微生物种群的平衡,进而造成根际微生物多样性呈下降趋势。
4 结论
试验表明:随着香蕉生长期的增加,某些细菌种类大量繁殖,土壤根际细菌群落结构失衡,土壤微生物环境有恶化趋势。刘艳霞等[18]研究认为,烟草土壤微生物多样性的提高有利于土壤保持健康的生态平衡,从而抑制烟草青枯病的发生。因此,本研究结果从根际微生物生态方面为香蕉枯萎病的防治提供了一定的借鉴。
参考文献
[1] Workneh F, Bruggen A H C V. Microbial density, composition, and diversity in organically and conventionally managed rhizosphere soil in relation to suppression of corky root of tomatoes[J]. Applied Soil Ecology, 1994, 1(3): 219-230.
[2] Bruggen A H C V, Semenov A M. A new approach to the search for indicators of root disease suppression[J]. Australasian Plant Pathology, 1999, 28(1): 4-10.
[3] Mazzola M, Gu Y H. Wheat Genotype-Specific Induction of Soil Microbial Communities Suppressive to Disease Incited by Rhizoctonia solani Anastomosis Group(AG)-5 and AG-8.[J]. Phytopathology, 2002, 92(12): 1 300-1 307.
[4] 胡元森, 刘亚峰, 吴 坤, 等. 黄瓜连作土壤微生物区系变化研究[J]. 土壤通报, 2006, 37(1): 126-129.
[5] Xu Y, Wang G, Jian J, et al. Bacterial communities in soybean rhizosphere in response to soil type, soybean genotype, and their growth stage[J]. Soil Biology & Biochemistry, 2009, 41(5): 919-925.
[6] 吴凤芝, 周新刚. 不同作物间作对黄瓜病害及土壤微生物群落多样性的影响[J]. 土壤学报, 2009, 46(5): 899-906.
[7] 王丽丽, 石俊雄, 袁赛飞, 等. 微生物有机肥结合土壤改良剂防治烟草青枯病[J]. 土壤学报, 2013, 50(1): 150-156.
[8] Seghers D V K, Reheul D, Bulcke R, et al. Effect of long-term herbicide applications on the bacterial community structure and function in an agricultural soil[J]. Fems Microbiology Ecology, 2003, 46(2): 139-146.
[9] Ahn J H, Kim Y J, Kim T, et al. Quantitative improvement of 16S rDNA DGGE analysis for soil bacterial community using real-time PCR[J]. Journal of Microbiological Methods, 2009, 78(2): 216-222.
[10] Culman S W, Duxbury J M, Lauren J G, et al. Microbial community response to soil solarization in Nepal's rice-wheat cropping system[J]. Soil Biology & Biochemistry, 2007, 38(12): 3 359-3 371.
[11] 金凌波, 周 峰, 姚 涓, 等. 磷高效转基因大豆对根际微生物群落的影响[J]. 生态学报, 2012, 32(7): 2 082-2 090.
[12] 于 翠, 吕德国, 秦嗣军, 等. 本溪山樱根际与非根际解磷细菌群落结构及动态变化[J]. 应用生态学报, 2006, 17(2): 2 381-2 384.
[13] 赵春芳, 刘 浩, 余龙江. 连作对麦冬根际土壤细菌群落的影响[J]. 微生物学通报, 2010, 37(4): 487-491.
[14] Dunfield K E, Germida J J. Diversity of bacterial communities in the rhizosphere and root interior of field-grown genetically modified Brassica napus[J]. Fems Microbiology Ecology, 2001, 38(1): 1-9.
[15] Nardi S, Concheri G, Pizzeghello D, et al. Soil organic matter mobilization by root exudates[J]. Chemosphere, 2000, 41(5): 653-658.
[16] Rumberger A, Merwin I A, Thies J E. Microbial community development in the rhizosphere of apple trees at a replant disease site[J]. Soil Biology & Biochemistry, 2007, 39(7): 1 645-1 654.
[17] Orlando J, Chávez M, Bravo L, et al. Effect of Colletia hystrix(Clos), a pioneer actinorhizal plant from the Chilean matorral, on the genetic and potential metabolic diversity of the soil bacterial community[J]. Soil Biology & Biochemistry, 2007, 39(11): 2 769-2 776.
[18] 劉艳霞, 李 想, 曹 毅, 等. 抑制烟草青枯病型生物有机肥的田间防效研究[J]. 植物营养与肥料学报, 2014, 20(5): 1 203-1 211.
