荷花腐败病防治药剂室内筛选及田间药效试验
2016-05-30夏玲曾莉莎吕顺周建坤郑志波麦进培邓志平
夏玲 曾莉莎 吕顺 周建坤 郑志波 麦进培 邓志平

摘要:【目的】筛选可有效控制荷花腐败病的化学药剂,为病害防控提供参考。【方法】选用34种化学药剂,以荷花腐败病菌株Hhgw-2-3为供试接种体,进行室内平板抑菌试验和土壤抑菌试验,并从中选取4种室内抑菌效果较好的化学药剂开展田间药效试验。【结果】平板抑菌试验结果表明,硫磺·多菌灵、丙环唑、福美双、苯醚甲环唑、咪鲜胺、恶霉灵、乙蒜素和氟硅唑等对荷花腐败病菌抑菌效果明显,抑菌率达80.00%~100.00%。土壤抑菌試验结果表明,氟硅唑、莲藕腐败灵、丙环唑、恶霉灵、咪鲜胺、福美双、生石灰+硫磺(60+3)、菌毒清、硫磺·多菌灵、百菌清和生石灰+碳酸氢铵(2+1)对荷花腐败病菌的抑菌效果较好,抑菌率在80.00%以上。田间药效试验结果表明,供试4种药剂恶霉灵、硫磺·多菌灵、咪鲜胺和菌毒清对荷花腐败病均有一定的防效,相对防效为11.15%~39.38%,其中以硫磺·多菌灵的效果最好,对荷花腐败病的相对防效为39.38%。【结论】硫磺·多菌灵对荷花腐败病的田间防效较好,且用药成本低,可在荷花病区大面积推广应用。
关键词: 荷花;腐败病;药效试验;防治效果
中图分类号: S436.8 文献标志码:A 文章编号:2095-1191(2016)07-1129-06
0 引言
【研究意义】我国栽培荷花历史悠久,是世界荷花栽培中心。荷花腐败病是荷花种植区发生最普遍、为害严重的病害之一, 其病原属为Fusarium commune,在荷花生长期和莲藕贮藏期均可发病。荷花腐败病属土传病害,病菌常造成藕鞭、藕节、藕根腐烂,同时地上部分的叶、花也会萎蔫黄枯,发病严重的整株枯死(谷慧珍和张河清,2006)。因此,荷花腐败病能否得到有效控制,已成为荷花栽培及荷花产业持续发展急需解决的重大问题。【前人研究进展】近年来,国内许多学者对莲腐败的发生规律及病害药剂防治进行了研究,并筛选出多种化学药剂。何可佳等(1997)报道,在莲藕移栽前用70%甲基托布津1000倍液浸种藕和用“961”盖种剂盖种藕对莲藕腐败病有很好的防治效果;在莲田翻耕时,用石灰1500 kg/ha(100 kg/667 m2)也有一定的防治效果。张夕林和杨慕林(2006)认为种藕和土壤带菌是莲藕发生腐败病的主要原因,夏季气温高、雨水少、藕田灌水少、使用未腐熟的有机肥及连作田发病重;粮果丰、甲基托布津等药剂处理莲藕闷种后再栽种,或叶面喷雾对莲藕腐败病均有较好的防治效果,其防效可达70%~80%;粮果丰、甲基托布津、百菌清、多菌灵等药剂的防效可达75%~80%。陈传聪等(2008)选用凯润等杀菌剂对莲腐败病进行田间防效试验,结果表明,25%凯润乳油2000倍液、30%爱苗乳油2500倍液、25%丙环唑乳油1500倍液和50%苯菌灵可湿性粉剂1000倍液对莲腐败病有较好的防治效果。葛有茂和赵士熙(2009)通过不同施药方法对莲腐败病防效的比较研究发现,采用靶向施药方式针剂注射法对莲腐败病有良好的防效。【本研究切入点】由于荷花叶片结构特殊,叶上表层有蜡质,一般农药喷施不易被吸收,选择有效的农药和适当剂型,并采用適宜的施药方法和技术,才能提高防治效果。【拟解决的关键问题】选取34种化学药剂进行室内平板抑菌试验及土壤抑菌试验,并选用4种室内抑菌效果较好、用药成本低的药剂进行田间药效试验,以期筛选出安全、高效的适用药剂,为防治荷花腐败病提供科学依据。
1 材料与方法
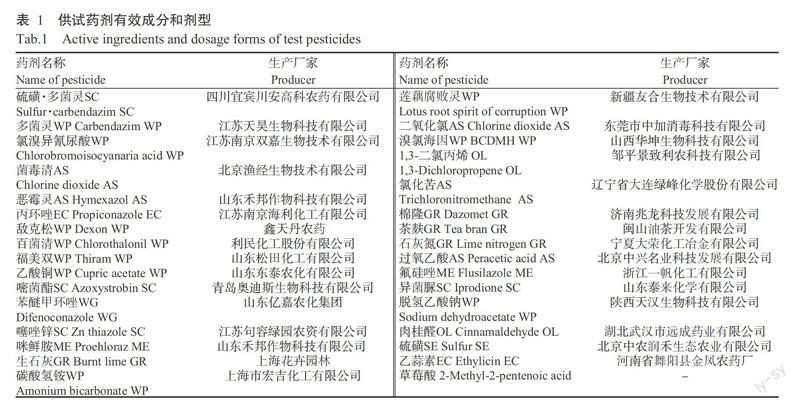
1. 1 供试材料
基于前期的致病力测定试验,选用致病力较强的荷花腐败病菌株Hhgw-2-3(由东莞市香蕉蔬菜研究所分子实验室分离鉴定)作为供试接种体。
供试药剂共34种,包括杀菌剂、食品防腐剂、土壤消毒剂和复合药剂等,另有3个组合药剂:生石灰+硫磺(60+3)、生石灰+碳酸氢铵(2+1)、茶麸+氯溴异氰尿酸(500+1),分别缩写为CaS、CaNH和TCl。其中32种原厂供试药剂的有效成分名称及其生产厂家见表1。
1. 2 试验方法
1. 2. 1 菌液的准备 Hhgw-2-3接种于马铃薯乳糖产孢子培养液中(马铃薯200 g、乳糖20 g、水1000 mL,121 ℃高温灭菌20 min),在25 ℃、150 r/min条件下振荡培养5~7 d后,用无菌水配成浓度为106个/mL的病原菌孢子悬浮液,备用。
1. 2. 2 平板抑菌试验 采用生长速率法对药剂毒力进行测定。依据预试验结果,用无菌水将供试药剂调配成适宜浓度的母液,再将供试药剂用巴氏消毒法灭菌(62 ℃水浴加热30 min),调配成相对应的浓度,取2 mL药液与18 mL融化的PDA混匀,静置冷却成平板。
将供试菌株Hhgw-2-3在PDA培养基上培养5~6 d后,用直径7.0 mm的灭菌打孔器取菌饼。将菌丝片接种在含有相应浓度药剂的PDA培养基上,设空白灭菌培养基为对照,每处理重复3次。28 ℃恒温培养箱培养4 d后,用十字交叉法测量菌落直径。以菌落直径或半径长短平均值计算菌丝生长抑制率。
纯生长量=菌落平均直径-菌饼直径
抑菌率(%)=(对照纯生长量-处理菌落纯生长量)/对照纯生长量×100
1. 2. 3 土壤抑菌试验 为了模拟荷花田间生长环境,选用容量50 L大塑料桶作为试验容器。将300 mL Hhgw-2-3孢子悬浮液(约106个/mL)与约20 kg土搅拌混匀制成病土,加入30 L无菌水,倒入大塑料桶中,保持桶中土壤深度35 cm,土壤覆水深度10~20 cm。供试药剂共34种(表3),每种药剂处理1桶病土,使供试药剂稀释1000倍,设3个重复,室温下密封放置14 d后,取各种药剂处理中土壤深度为20~30 cm的土样各50 g,分别加入50 mL无菌水混匀,并进行10倍梯度稀释,取1 mL的103倍稀释液均匀涂布于K2培养基上(Komada改良培养基)(Komada, 1975;Sun et al., 1978;Smith et al., 2008),每个稀释液涂布3个培养基,于28 ℃培养3 d,计数菌落形成单位(CFU/g)。根据菌落形成单位计算各供试药剂在土壤中的抑菌率。
1. 2. 4 田间药效试验 根据前期平板抑菌试验和土壤抑菌试验结果,选取4个室内抑菌效果较好的药剂进行田间小区试验。
选用一块荷花腐败病重病田作为试验区(连续3年荷花腐败病发病率在50.00%以上),试验点位于广东省东莞市桥头莲湖公园。设5个处理,每处理面积约25 m×25 m=625 m2,每处理3个重复。前期土壤统一用生石灰+碳酸氢氨进行处理。处理1:70%恶霉灵WP,2250 g/ha;处理2:1 mg/L硫磺·多菌灵AS,34.5 L/ha;处理3:85%菌毒清AS,3000 g/ha;处理4:25%咪鲜胺ME,15000 mL/ha;处理5:空白对照,不作任何药剂处理(CK)。以上处理从荷花出现浮叶开始施药,之后根据天气情况每隔10~15 d喷药1次,共用药3次。
在对照处理荷花出现萎蔫后开始调查,每隔10 d调查1次发病株数,至荷花腐败病病情不再发展为止,共调查3次。按病株率和防效计算田间试验结果。
发病率(%)=发病株数/调查总株数×100
防效(%)=(對照发病率-处理发病率)/对照发病率×100
1. 3 统计分析
试验数据采用SPSS 19.0进行统计分析。
2 结果与分析
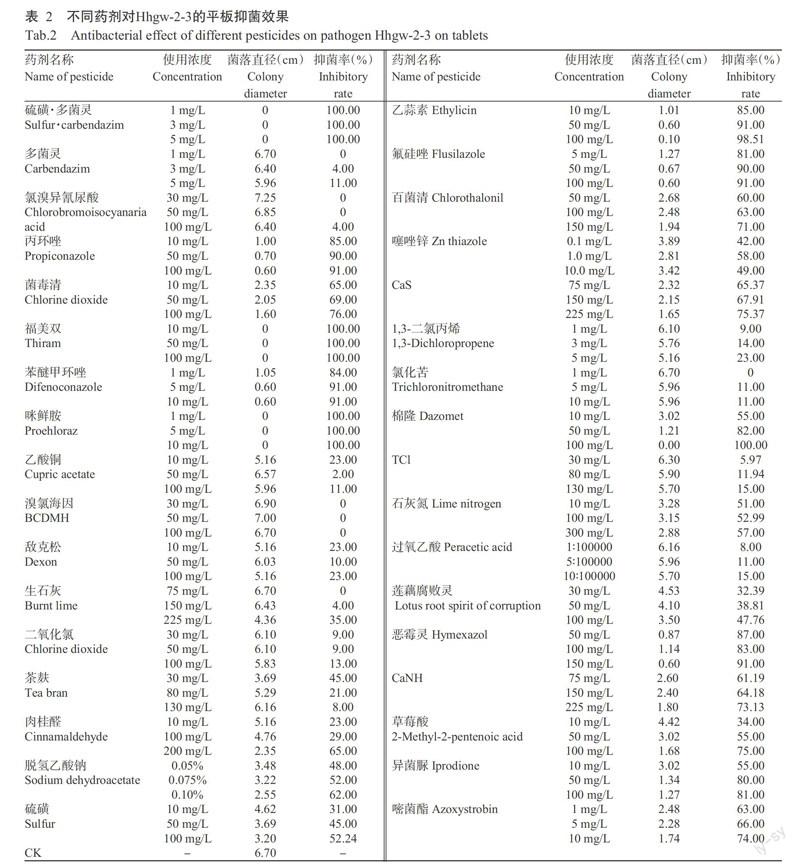
2. 1 平板抑菌试验结果
不同药剂对病原菌菌丝生长的抑制效果存在明显差别,结果见图1和表2。供试药剂中对Hhgw-2-3菌丝生长抑制效果较好的药剂有:硫磺·多菌灵、丙环唑、福美双、苯醚甲环唑、咪鲜胺、恶霉灵、乙蒜素和氟硅唑等8种,8种药剂在设计浓度水平下的抑菌率均达80.00%以上;抑菌率在60.00%以上的药剂还有:菌毒清、肉桂醛、脱氢乙酸钠、百菌清、CaS、棉隆、草莓酸、异菌脲、嘧菌酯和CaNH等;而抑菌效果差,甚至没有抑菌效果的药剂有7种,分别为多菌灵、氯溴异氰尿酸、溴氯海因、氯化苦、TCL、过氧乙酸和二氧化氯,7种药剂在最大浓度下抑菌率小于20.00%;其余药剂对病原菌有一定的抑菌作用。
2. 2 土壤抑菌试验结果
不同供试药剂对土壤中的病原菌抑菌效果存在明显差异。由表3可知,供试34种药剂中对病原菌抑菌率达80.00%以上的有:氟硅唑、莲藕腐败灵、丙环唑、恶霉灵、咪鲜胺、福美双、CaNH、菌毒清、硫磺·多菌灵、百菌清、CaS;抑菌效果较差或没有抑菌效果的药剂(抑菌率低于20.00%)有:氯化苦、石灰氮、敌克松、嘧菌酯和生石灰等。
2. 3 不同药剂对荷花腐败病的田间防治效果
根据平板抑菌试验和土壤抑菌试验结果,选取恶霉灵、硫磺·多菌灵、菌毒清和咪鲜胺4个抑菌效果较好、用药成本低、适合大面积推广的药剂进行田间试验,结果见表4。由表4可知,4种药剂对荷花腐败病均有一定的防效,相对防效为11.15%~39.38%,且不同药剂间的相对防效差异显著(P<0.05),其中,硫磺·多菌灵处理的荷花腐败病发病率最低,为28.34%,相对防效为39.38%,其次是施用菌毒清处理,荷花腐败病发病率为35.68%,相对防效为23.68%,恶霉灵和咪鲜胺的防效较差。
3 讨论
荷花腐败病是一种典型的土传病害,病原菌以菌丝在种藕和土壤中越冬,次年5月中旬~6月初遇适宜条件先从莲藕植株根部侵染,逐渐扩散至地下茎及全株,以水流和种藕调运的形式传播,病菌常造成藕鞭、藕节、藕根腐烂,同时地上部分的叶、花也会萎蔫黄枯,发病严重的整株枯死(谷慧珍和张河清,2006)。目前,能有效防治荷花腐败病的化学药剂较少且使用混乱,筛选有效防治荷花腐败病的化学药剂及研究其施药方法意义重大。
唑类杀菌剂的稳定性较高,对作物多种病原菌具有高效、内吸、广谱的作用(姚金刚,2013)。本研究在PDA平板抑菌试验中,以丙环唑、苯醚甲环唑、恶霉灵等为唑类杀菌剂代表,对荷花腐败病菌有明显的抑制效果,抑菌率达80.00%以上;在土壤抑菌试验中同样表现良好的抑菌效果,丙环唑、苯醚甲环唑和恶霉灵的抑菌率分别为93.18%、72.52%和97.07%,表明唑类杀菌剂对荷花腐败病菌具有良好的抑制效果。
在PDA平板抑菌试验中,氯溴异氰尿酸、溴氯海因和二氧化氯等氯溴类杀菌剂对荷花腐败病菌的抑菌效果较差,对土壤中的病菌抑菌效果也不明显,可见氯溴类药剂不适合用于防治荷花腐败病。以多菌灵和乙酸铜等为代表的广谱保护性杀菌剂对荷花腐败病菌的抑制效果也较差,有些药剂甚至没有效果。
在平板抑菌试验和土壤抑菌试验的基础上选取4种药剂进行了田间试验,结果显示,恶霉灵、硫磺·多菌灵、咪鲜胺和菌毒清对荷花腐败病均有一定的效果,但与室内试验结果相比效果欠佳,其原因可能与施药方法、药剂剂型、试验田地选择和当年的气候条件等因素有关,其确切原因有待继续开展小区试验来求证。
在荷花腐败病防治中,由于荷花叶片结构特殊,一般农药喷施不易被吸收,选择有效的农药及适当剂型的基础上,采用适宜的施药方法和技术,才能保证安全用药,提高防治效果。在荷花腐败病防治中,还应跟踪气候情况,如气温、日照时长、降水等,查清田间既往病史和种藕的来源(曾璐,2013),从而进一步了解不同因素對病害发生的影响,完善荷花腐败病防治技术,达到有效防控的目的。
由于本研究大部分药剂仅在室内开展试验,要使药剂在生产上大面积应用,还需进一步开展田间试验示范,以便为农户提供更为可靠的荷花腐败病化学防治方法。
4 结论
本研究结果表明,硫磺·多菌灵、丙环唑、福美双、咪鲜胺、恶霉灵和氟硅唑等6种药剂对荷花腐败病菌有较好的室内抑制效果,对病原菌的抑制率均达80.00%以上,且药效稳定,具有一定的应用潜力,其中,硫磺·多菌灵的田间防效较好,用药成本低,可在荷花病区大面积推广应用;氟硅唑、莲藕腐败灵、丙环唑、恶霉灵、咪鲜胺、福美双、生石灰+碳酸氢铵(2+1)、菌毒清、硫磺·多菌灵、百菌清和生石灰+硫磺(60+3)等11种药剂具有较好的土壤抑菌效果,可用于病区的土壤消毒。
参考文献:
陈传聪,罗银华,阮承莲,吴景栋,黄回南. 2008. 防治莲腐败病药剂筛选试验[J]. 江西植保,31(1): 36-37.
Chen C C, Luo Y H, Ruan C L, Wu J D, Huang H N. 2008. Screening test of fungicides for prevention of lotus rot di-
sease[J]. Jiangxi Plant Protection, 31(1): 36-37.
葛有茂,赵士熙. 2009. 不同施药方法对莲腐败病防效的比较研究[J]. 植物保护, 35(2): 148-152.
Ge Y M, Zhao S X. 2009. Comparative study on the effects of different methods of pesticide applications on control efficacy of the rhizome rot on lotus[J]. Plant Protection, 35(2): 148-152.
谷慧珍,张河清. 2006. 藕莲腐败病的诊断与防治[J]. 福建热作科技, 31(2): 17-18.
Gu H Z, Zhang H Q. 2006. Diagnose and control of Fusarium bulbigenum of lotus root[J]. Fujian Science & Technology of Tropical Crops, 31(2): 17-18.
何可佳,黄声仪,刘福禄,黄建强,王泽林. 1997. 湘莲腐败病防治研究[J]. 长江蔬菜,(3): 16-18.
He K J, Huang S Y, Liu F L, Huang J Q, Wang Z L. 1997. Study on prevention and control of Xiang lotus rot disease[J]. Journal of Changjiang Vegetabless,(3): 16-18.
姚金刚. 2013. 三环唑和丙环唑在水稻和土壤中残留污染行为研究[D]. 北京:中国农业科学院.
Yao J G. 2013. Study on the residual behavior of tricyclazole and propiconazole in paddy and soil[D]. Beijing: Chinese Academy of Agricultural Sciences.
曾璐. 2013. 湘莲腐败病病原菌分离鉴定及其防治研究[D]. 长沙:湖南农业大学.
Zeng L. 2013. Study on isolation and identification of the pathogen of Xiang lotus rot disease and coutrol of the di-
sease[D]. Changsha:Hunan Agricultural University.
张夕林,杨慕林. 2006. 莲藕腐败病的发病特点及其药剂防治技术研究初报[J]. 农药科学与管理, 27(4): 13-15.
Zhang X L, Yang M L. 2006. Study on the incidence characte-
ristics of lotus root rot disease and its chemical control techniques[J]. Pesticide Science and Administration,27(4): 13-15.
Komada H. 1975. Development of selective medium for quantitative isolation of Fusarium oxysporum from natural soil[J]. Review of Plant Protection Research, 8:114-125.
Smith L J, Smith M K, Tree D, OKeefe D, Galea V J. 2008. Development of a small-plant bioassay to assess banana grown from tissue culture for consistent infection by Fusarium oxysporum f. sp. cubense[J]. Australasian Plant Patho-
logy, 37(2): 171-179.
Sun E J, Su H J, Ko W H. 1978. Identification of Fusarium oxysporum f. sp. cubense race 4 from soil or host tissue by cultural characters[J]. Phytopathology, 68(11): 1672-1673.
(責任編辑 麻小燕)
