叶面镁营养促进妃子笑荔枝果皮着色的生理成因
2016-05-30周开兵周晓超苏阳高丹
周开兵 周晓超 苏阳 高丹
摘 要 以妃子笑荔枝(Litchi chinensis Sonn. cv. Feizixiao)成年树为试材,探讨叶面 Mg 营养调节妃子笑荔枝果皮着色的效果及其初步原因。以叶面喷Mg为处理,以喷清水为对照(CK),分别在坐果后1 d(2013 年5月5 日)和8 d进行叶面喷肥处理,观测果皮着色、内源激素含量和相关关键酶活性的动态变化。在坐果后15 d,Mg处理的果皮h值最低和果肉可溶性糖含量最高,克服了果皮“滞绿”现象。在果实生长发育过程中,Mg处理与CK的果皮生长素(IAA)和乙烯(Eth)含量、叶绿素单加氧酶(PaO)和叶绿素酶(Chlase)活性在同期间均无显著差异。在坐果后11 d后,Mg处理在果皮赤霉素(GA3)和脱落酸(ABA)含量及类黄酮糖基转移酶(UFGT)活性上均显著高于同期CK,并且Mg处理使果皮 ABA/GA3(含量比)高于CK。Mg处理在坐果后15 d和18 d使其果皮花色素苷含量显著高于CK,而使其叶绿素含量与CK无显著差异。可见,Mg处理克服果皮“滞绿”现象归功于果皮花色素苷含量的升高,其可能通过提高ABA/GA3值,进而刺激UFGT活性升高,从而促进果皮花色素苷合成。
关键词 妃子笑荔枝;Mg;果皮着色;内源激素;酶
中图分类号 S667.1 文献标识码 A
荔枝(Litchi Chinesis Sonn.)在中国主要分布于广东、广西、福建、海南和台湾等省区,是华南区栽培面积最大的果树[1],研究其果实品质发育问题对促进荔枝产业和华南区农村经济发展有重要的意义。荔枝果皮着色转红和果肉风味变佳均是果实成熟的重要标志,也分别是最重要的外观和内在品质因素。因此,商品价值高的荔枝果实应该是荔枝果皮转红和果肉风味变佳同步发育的,其中果肉风味品质变佳表现为果肉含糖量升高和总酸含量下降,糖酸比达到最高时果肉即已经成熟[2]。大多数荔枝品种果皮着色和果肉风味变佳同步发育,然而少数品种如妃子笑荔枝果肉含糖量最高时果皮未完全转红(即“滞绿”现象),果面全红时的果肉含糖量发生下降(即“退糖”现象)[3],存在果皮着色转红和果肉风味变佳发育不同步的现象,在果肉风味最佳时采收则出现所谓“果皮着色不良”的问题。妃子笑荔枝的果皮“滞绿”问题和果肉“退糖”问题均使生产者蒙受经济损失。因此,有必要开展妃子笑荔枝果实内在和外观品质发育不同步问题的理论成因和解决办法等研究。
由于荔枝果皮着色表现为果皮花色素苷含量升高,同时果皮叶绿素含量下降,而与果皮类胡萝卜素含量变化关系不明显[4-8]。妃子笑荔枝果皮花色素苷合成与类黄酮基转移酶(UFGT)活性变化有关,随着果皮中UFGT活性的增加,花青苷含量上升;套袋处理抑制UFGT活性的同时也抑制花青苷的合成,除袋后UFGT活性和花青苷含量都迅速增加;6-BA处理抑制UFGT酶活性的同时也抑制花青苷合成,ABA和茉莉酸处理提高了UFGT酶活性的同时也促进了花青苷的合成[9-10]。因此,要解决妃子笑荔枝果皮转红和果肉风味变佳发育不同步问题,可以通过调节妃子笑荔枝果皮色素代谢来使二者发育实现同步。由前人报道可见,对妃子笑荔枝果实套袋能解决其果皮“滞绿”问题,并且主要是套袋通过调节果皮UFGT活性而调节花色素苷合成和着色
笔者所在课题组最近已报道,对妃子笑荔枝在坐果后进行叶面喷施镁肥处理,可成功地克服了其果皮“滞绿”问题[11],然而其生理学机制又是怎样的?笔者从果皮激素含量和果皮色素代谢相关关键酶活性变化上对此问题展开初步探讨。
1 材料与方法
1.1 材料
试验地点为海南省农业科学院热带果树研究所永发科研示范基地,该基地位于澄迈县北部平原台地,属于热带季风气候区,年平均气温23.8 ℃,年平均日照时数2 059 h,年均降雨量1 786.1 mm,且热雨同季,终年无霜;土壤为肥沃的砖红壤。在该基地荔枝园选16年生、生长势一致和健壮的妃子笑荔枝/大丁香荔枝砧嫁接树10株作为试验材料。
1.2 方法
1.2.1 试验设计 以叶面喷清水为对照(CK),依据MgCl2在果树上用于叶面喷肥时的常用浓度,设置1.5%MgCl2溶液为处理(Mg),进行叶面喷肥处理时,喷施至叶面和叶背滴水。单株小区,5次重复。坐果后,在坐果后1 d(2013年5月5日)和坐果后5 d的上午9~10时进行叶面喷肥处理。
1.2.2 取样及样品处理 坐果后,果实生长发育即进入快速膨大期,此时假种皮刚刚包满种子,即2013年5月5日,视作坐果后1 d,在每株树树冠外围中部选5个大小基本一致的果实作为每次取样的标准果,并挂牌标记,此后在不同时期对各树动态采果样时均参照这5个标准果平均大小,采集与其平均果径一致的样果。从果实开始膨大时开始到果皮全红时为止,共取样5次,即在坐果后1、8、11、15、18 d各取样1次,其中坐果后1、8 d取样均在叶面喷肥处理之前完成。果样取自树冠中部外围,每次取样采果30个/株。在田间先测定果实着色指标值,再将样果剥皮,并将果皮和果肉分别及时用液氮速冻,带回实验室储存于-80 ℃超低温冰箱中备用。
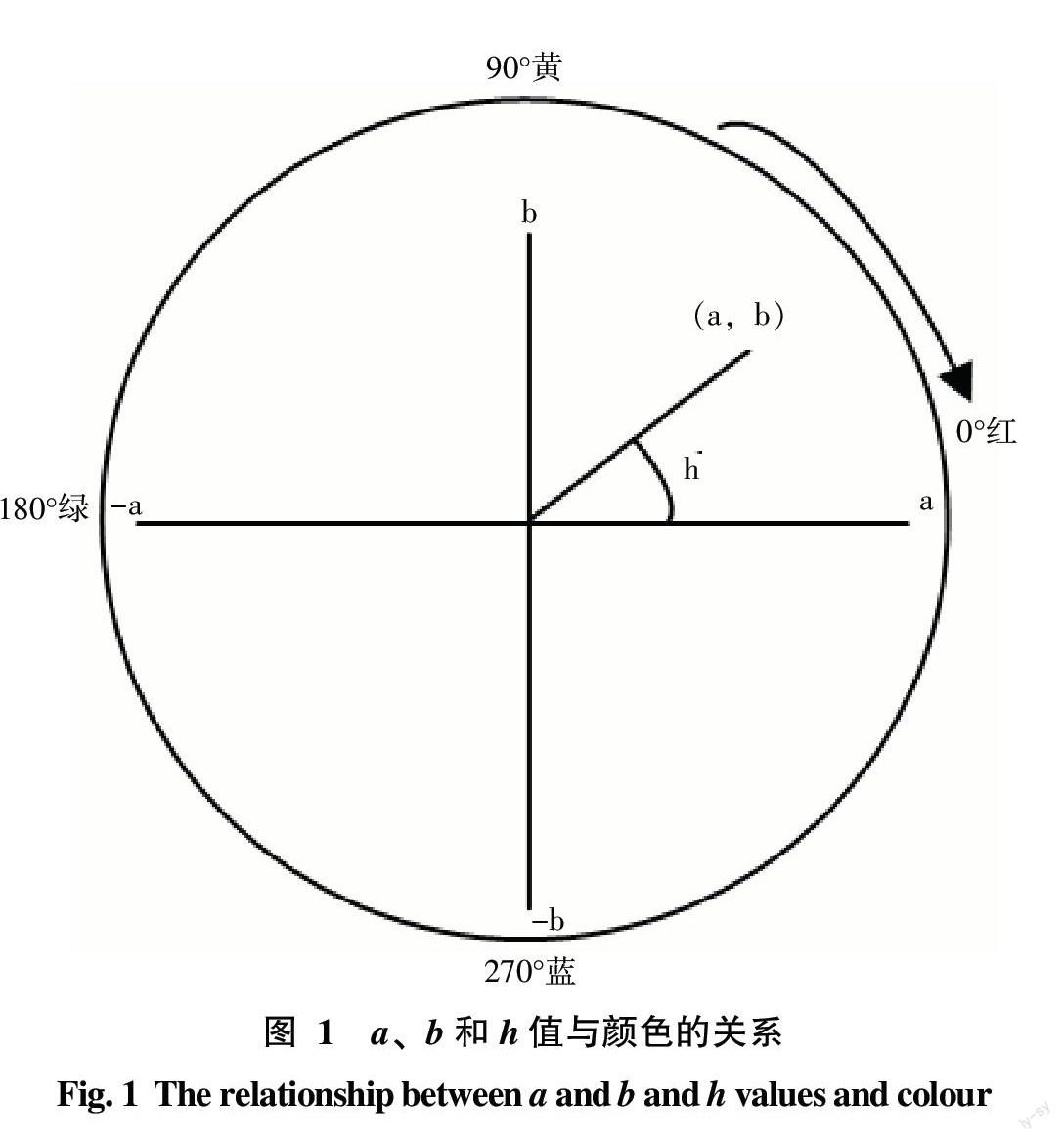
1.2.3 试验指标观测方法 采用日本产Minolta CR2300型全自动测色色差计测定荔枝果皮a、b值,换算出色度角(h),公式为h=tan-1(b/a),a、b和h值与颜色的关系如图1所示,其中h值越小则果皮综合色泽越红,各指标以每株样树上30个样果测定值的平均值作为该单株(重复)的观测值。以下各生理生化指标测定时,每株样树(重复)的果皮和果肉样品分别制备3个测样,取其平均值作为该株树(重复)的观测值。采用改良Arnon法测定荔枝果皮叶绿素含量[12];采用Pirie等[13]和张昭其等[14]提出的方法测定荔枝果皮花色素苷含量;采用蒽酮比色法测定荔枝果肉可溶性糖含量[15];果皮生长素(IAA)、赤霉素(GA3)、细胞分裂素(iPAs)和脱落酸(ABA)含量测定采用酶联免疫法(ELISA)法[16],结合南京农业大学提供试剂盒说明书测定;果皮乙烯(Eth)释放量测定采用庞学群等优化的GC法[17]。
脱镁叶绿酸单加氧酶(PaO)提取与活性测定参考Hortensteiner 等[18]的方法,加以改进。20 g黑暗处理5 d的荔枝果皮,放置在研钵中,加入液氮,研磨成粉,按3 mL/g FW加入提取液(0.4 mol/L蔗糖、25 mmol/L Tris-HCl 缓冲液pH8、10 mmol/L NaCl、2 mmol/L EDTA、1 mmol/L MgC12、3 mmol/L PEG600O),25 μm尼龙网过滤,滤液移进冰浴的80 mL 离心管,10 000 ×g、4 ℃ 离心5 min,弃上清液,沉淀1 mL/g FW 标准溶于上述溶液,10 000×g、4 ℃ 离心5 min,沉淀按0.5 mL/g FW标准溶解于25 mmol/L Tris-HCl pH 8缓冲液(内含1% Tritonx-100),暗中4 ℃振荡30 min,150 000×g、4 ℃离心60 min,上清液备用。加入25 μL酶液与下列溶液(20 mmol/L Pheide a、60 mmol/L NADPH、100 mmol/L Glc6P、10 mU/μL Glc6P-DH、10 μg/μL Fd)各1 μL混匀,暗中室温反应30 min,加入冷甲醇至终浓度70%终止反应,11 000×g离心2 min,取10 μL上清液进行HPLC分析。以HPLC色谱峰面积/min·g FW表示酶活力(或降解速率)。色谱条件:柱压2 MPa;pH范围:1;狭缝:10 nm;FD 激发波长320 nm,发射波长450 nm;流速0.8 mL/min;洗脱液为[67.5% 无水甲醇+32.5% PBS (pH7.0)]。
采用甘志军等[19]的方法测定荔枝果皮叶绿素酶(Chlase)活性。将荔枝果皮在冰浴中加入液氮碾磨成粉末,加入一定量的PVP,按照0.167mL/mg标准加入缓冲溶液(0.05 mol/L pH7.5磷酸盐缓冲液,含50 mmol/L KCl、0.24% TritonX-100),4 ℃ 抽提4 h,在4 ℃条件下10 000 r/min 离心15 min,取上清液,12 000 r/min 离心20 min,取上清液定容至一定体积,得到叶绿素酶粗酶液。用 80%丙酮从鲜绿菠菜叶片中提取色素,然后加入一定体积的石油醚萃取,叶绿体色素(主要是Chl),在醚相浓缩,醚相用冷风吹干后得到的Chl溶解于确定体积的丙酮中备用,取1 mL 色素提取液加入24 mL 丙酮,测定叶绿素OD值,然后按以下公式计算叶绿素含量:Chl含量(μmol/L)=805×OD652,Chl的分子量按900计。反应混合物3.5 mL,其中包括0.5 mL 50 mmol/L pH 7.5 PBS(内含 0.24% Triton X-100)、l mL Chl 液和2ml Chl 丙酮溶液,混合物放置40 ℃水浴中,反应30 min后,取0.5 mL混合物与4.5 mL提取液(丙酮 ∶ 石油醚=1 ∶ 2,V ∶ V)混合并充分振荡,然后8 000 g、4 ℃、离心l0 min(若不分层,可以加入适量NaCl),取下相测定665、667、 651 nm的A值,消光系数分别按54.1、74.9、47.0 mmol-1·cm-1计算 Chl、Chla、Chlb 的反应量,酶活力(或酶促反应速度)以μmol/(min·g FW)表示。以沸水浴加热失活的酶液同样处理为空白对照。
UFGT 酶液的提取采用Murray[20]的方法,其活性测定采用Lister等[21]的方法。取样品1 g,加液氮研磨后加入5 mL、20 ℃的丙酮混匀离心,弃去上清液,用4 mL -20 ℃丙酮再提取1次,沉淀用4 mL 溶液[0.1 mol/L 硼酸缓冲液(pH8.8)的5 mmol/L抗坏血酸]提取,上清液为UFGT酶的粗提液。取酶液0.5 mL加入0.5 mL的反应液[0.05 mol/L 二甘氨酸缓冲液(pH8.0)、1 mmol/L的栎精和2.5 mmol/L的UDP-葡萄糖],反应液在34 ℃水浴30 min后,用0.75 mL 20%三氯乙酸的甲醇溶液终止反应,于5 000 r/min离心5 min,上清液贮藏于-20 ℃待测。检测栎精的减少量并用其表示酶活性。360 nm处的紫外分光光度法测定栎精的含量,计算减少量,并用其表示酶活性。
1.3 数据统计分析
采用SAS软件ANOVA过程作方差分析;采用DUNCAN法作多重比较分析;采用 TTEST过程作处理与CK差异显著性分析;采用CORR过程作一元线性相关性分析。
2 结果与分析
2.1 Mg处理对果皮着色与果肉风味变佳发育同步性的影响
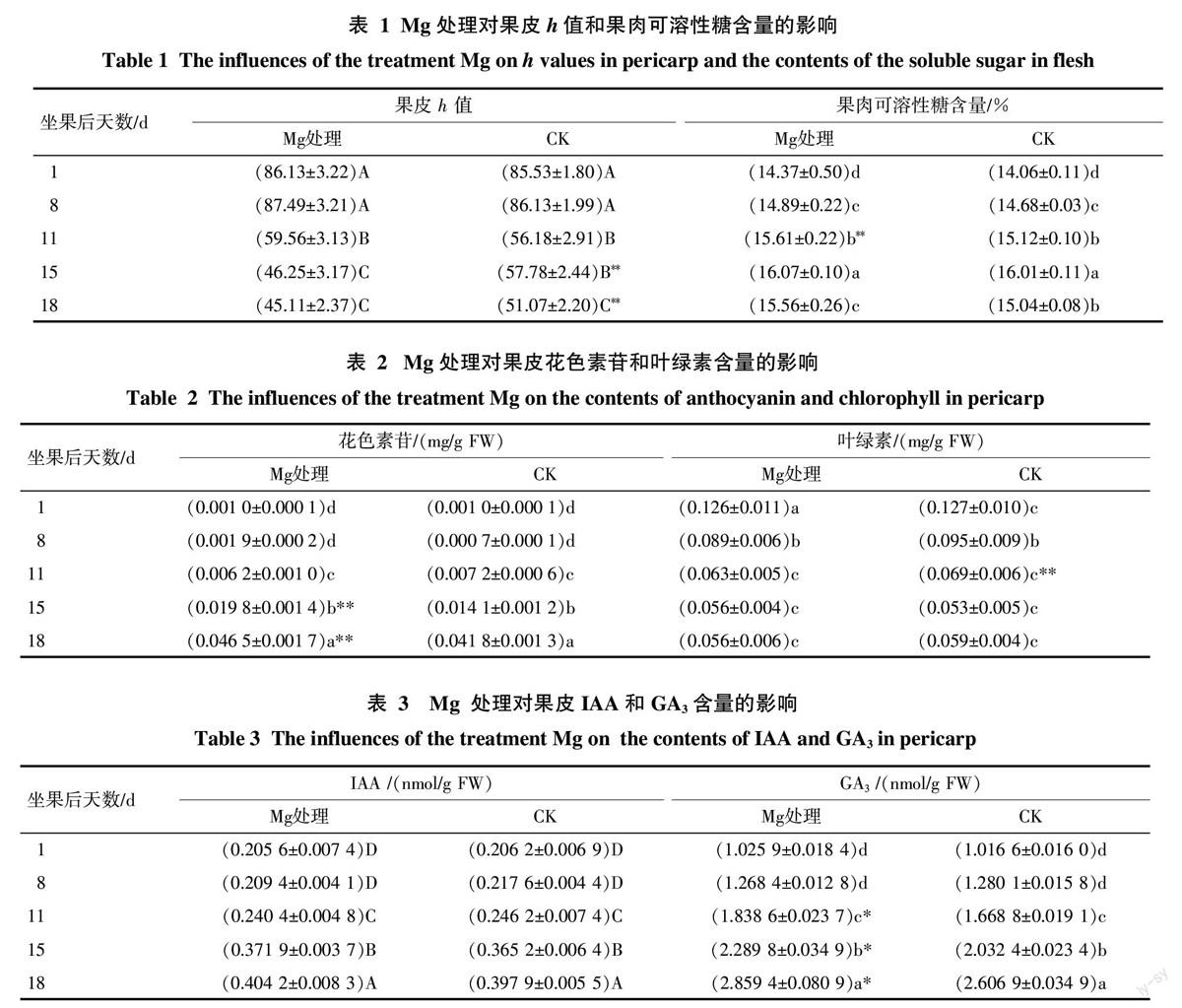
Mg处理对果皮着色和果肉可溶性糖含量的影响见表1。Mg处理与CK的果皮h值动态变化趋势相似。二者差异出现在坐果后11 d以后,即坐果后11 d到15 d,Mg处理极显著下降,CK则无显著变化;坐果后15 d到18 d,Mg 处理无显著变化,CK显著下降。Mg处理因在坐果后15 d时h值已经降至最低且此后无显著变化,即其已提前完全着色;CK在坐果后18 d完全着色。在坐果后15 d和18 d,Mg处理果皮h值极显著低于CK,说明在果实成熟期Mg处理可促进果皮提早着色和着色更加红艳。
Mg处理与CK的果肉可溶性糖含量总体变化趋势相似;Mg处理果肉可溶性糖含量一直与CK 均差异不显著。说明Mg处理不改变果肉可溶性糖的积累变化过程,基本上不影响在果皮全红时的果肉可溶性糖含量。
综上所述,表明Mg处理克服了果皮“滞绿”问题,且Mg处理果皮着色转红更佳,实现果皮着色转红和果肉风味变佳同步发育。
2.2 Mg处理对果皮色素含量的影响
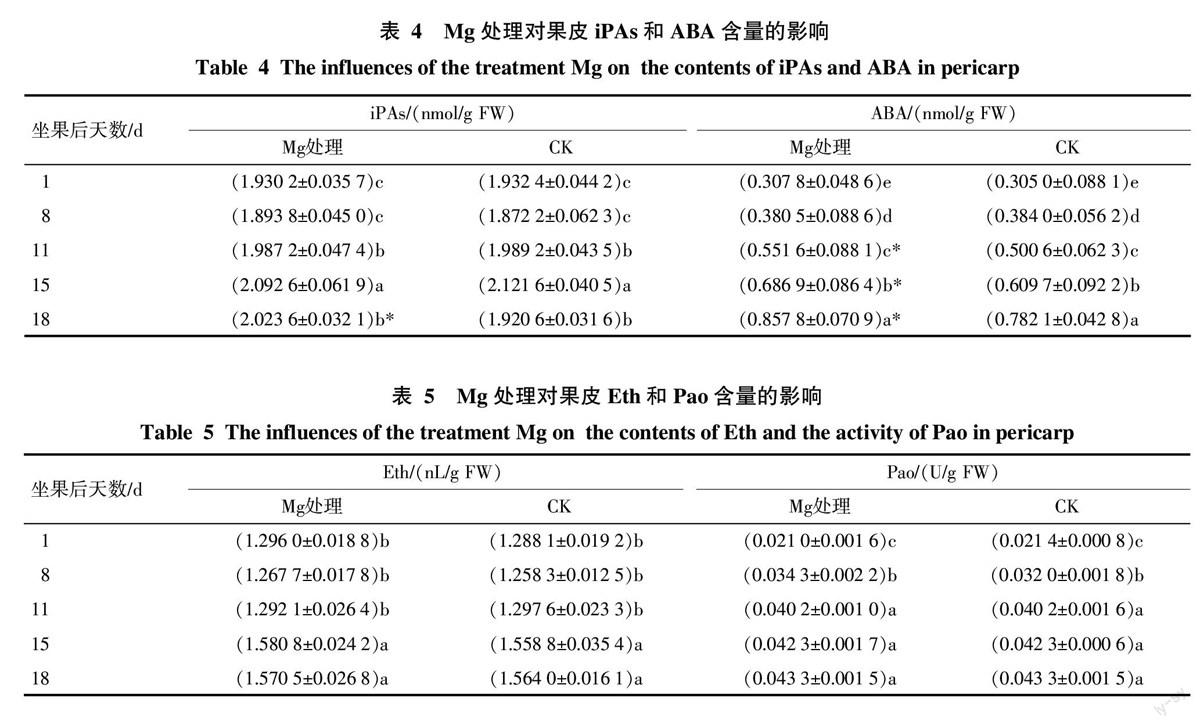
Mg处理对果皮果皮色素含量的影响见表2。Mg处理与CK的果皮花色素苷含量均呈上升趋势,且都在坐果后18 d达到最高;Mg处理与CK的果皮叶绿素含量都呈下降趋势。说明Mg处理不改变果皮着色的基本规律。
Mg处理与CK果皮花色素苷含量在同期间比较表明,在坐果后15 d和18 d,Mg处理极显著高于CK。可见,Mg处理在坐果后15 d以后促进果皮花色素苷积累,即其在果实成熟期促进果皮花色素苷积累,与上述Mg处理对果皮红色着色的影响结果一致。Mg处理果皮叶绿素含量除在坐果后11 d显著低于CK外,在其它日期均与CK差异不显著。说明Mg处理基本不影响果皮叶绿素代谢。总之,Mg处理调节果皮着色主要是通过调节果实成熟期时花色素苷的积累而克服“滞绿”问题。
2.3 Mg处理对果皮激素含量的影响
2.3.1 Mg处理对果皮IAA含量的影响 由表3 可见,Mg处理与CK的果皮的IAA含量都呈相似的上升趋势,Mg处理与CK在同期果皮IAA含量间比较均无显著差异。说明Mg处理不影响果皮IAA的代谢,即果皮IAA可能与Mg处理克服果皮“滞绿”现象无关。
2.3.2 Mg处理对果皮GA3含量的影响 由表3可见,Mg处理与CK的果皮GA3含量都呈相似的上升趋势;除在坐果后1 d 和8 d,Mg处理与CK差异不显著;在其余日期,Mg处理均显著高于CK。说明Mg处理不影响 GA3含量变化趋势,但其在果实成熟期时促进果皮GA3的积累,而此期是果皮快速转色的关键时期,即果皮GA3含量的提高与Mg处理克服果皮“滞绿”现象有关。
2.3.3 Mg处理对果皮iPAs含量的影响 由表4 可见,Mg处理与CK的果皮iPAs含量呈相似的先升后降趋势;Mg处理除在坐果后18 d显著高于CK外,在其余时间均与CK无显著差异。说明Mg处理基本上不改变果皮iPAs的代谢,即在本试验中果皮iPAs可能与Mg处理克服果皮“滞绿”现象无关。
2.3.4 Mg处理对果皮ABA含量的影响 由表4 可见,Mg处理与CK的果皮ABA含量呈相似的持续显著上升趋势;在坐果后1 d和8 d,Mg 处理与CK差异不显著,在其余日期,Mg处理显著高于 CK。说明Mg处理不影响ABA含量变化趋势,但其在果实成熟期时促进果皮ABA的积累,而此期是果皮快速转色的关键时期,即果皮ABA含量的提高与Mg处理克服果皮“滞绿”现象有关。
2.3.5 Mg处理对果皮Eth含量的影响 由表5可见,在果实生长发育过程中,Mg处理与CK的果皮Eth含量呈相似的上升趋势,Mg处理与CK在同期间比较均无显著差异。说明Mg处理不影响果皮Eth的代谢,即在本试验中果皮Eth可能与Mg 处理克服果皮“滞绿”现象无关。
2.4 Mg处理对与果皮着色相关的关键酶活性的影响
2.4.1 Mg处理对PaO活性的影响 由表5可见,Mg处理与CK的果皮的PaO活性呈相似的上升趋势,Mg处理与CK果皮PaO活性在同期间无显著差异。说明Mg处理不影响果皮PaO的活性变化,即在本试验中果皮PaO可能与Mg处理克服果皮“滞绿”现象无关。
2.4.2 Mg处理对Chlase活性的影响 由表6可见,Mg处理与CK的果皮的Chlase活性都呈相似的上升趋势,Mg处理与CK果皮Chlase活性在同期间比较均无显著差异。说明Mg处理不影响果皮Chlase的活性变化,即在本试验中果皮Chlase可能与Mg处理克服果皮“滞绿”现象无关。
2.4.3 Mg处理对UFGT活性的影响 由表6可见,Mg处理与CK的果皮的UFGT活性都呈上升趋势;在坐果后1 d 和8 d,Mg处理与CK差异不显著,在其余时间,Mg处理均显著高于CK。说明Mg处理不影响UFGT活性的变化趋势,但其在果实成熟期时促进果皮UFGT活性增强,而此期是果皮快速转色的关键时期,与上述果皮花色素苷含量在此期快速升高一致,即果皮UFGT活性的增强与Mg处理克服果皮“滞绿”现象有关。
3 讨论与结论
3.1 叶面Mg营养促进果皮花色素苷合成
对本试验结果作线性相关性分析表明,Mg处理和CK的果皮UFGT活性与其GA3含量和ABA含量分别呈显著正相关(GA3:Mg处理r=0.971 1*,CK r=0.995 2*;ABA:Mg处理r=0.966 1*,CK r=0.964 7*),同时其果皮花色素苷含量与果皮UFGT活性和果皮ABA含量也分别呈显著正相关(UFGT:Mg处理r=0.910 8*,CK r=0.948 3*;ABA:Mg处理r=0.849 5*,CK r=0.843 7*)。其中,果皮花色素苷含量与果皮UFGT活性和果皮ABA含量正相关,与前人在荔枝和苹果中的研究结果相同[9,22-,23];果皮UFGT活性与果皮GA3含量呈正相关,与苹果中的ABA含量较高抑制GA3含量上升的结果不一致[23],但在果实成熟期,Mg处理使其果皮 ABA/GA3比值大于CK(坐果后15 d,Mg处理的0.465,CK的0.436;坐果后18 d,Mg处理的0.400,CK的0.383)。因此,从激素代谢平衡上分析表明,果皮ABA含量升高促进其UFGT活性和花色素苷含量升高。总之,果皮可能通过提高其ABA/GA3比值而提高其UFGT活性,进而促进其花色素苷合成而促进着色转红。在坐果后15 d 以后,Mg处理使其果皮ABA/GA3 比值在同期高于CK,从而使其果皮UFGT活性显著高于CK,进而导致其果皮花色素苷含量显著高于CK,最终其着色好于CK,这可能是Mg处理促进果皮着色的生理成因,同时也对妃子笑荔枝施肥技术的创新研究有一定指导意义。至于Mg如何促进果皮ABA积累,目前关于Mg营养与ABA代谢的关系未见报道,还有待于作进一步的研究。
3.2 叶面Mg营养不影响叶绿素降解
对本试验结果作线性相关性分析还表明,Mg 处理和CK的果皮叶绿素含量与其PaO活性和Eth 含量分别均呈显著负相关(PaO:Mg处理r=-0.995 2*,CK r=-0.993 2*;Eth:Mg处理r=-0.821 6*,CK r=-0.819 1*),与其Chlase活性变化趋势相反。这说明果皮PaO可能也是果皮叶绿素降解的关键酶,与植物叶片叶绿素降解相似[24]。同时,果皮PaO和Chlase活性分别均与其Eth含量呈显著正相关(PaO:Mg处理r=0.8130*,CK r=0.8263*;Chlase:Mg处理r=0.9057*,CK r=0.9311*);这又与前人关于乙烯促进叶绿素降解的研究结果相同[25]。总之,果皮可能是通过提高其Eth含量而提高其 PaO和Chlase活性,进而促进其叶绿素的降解而导致其叶绿素含量下降。与CK相比,Mg处理未改变果皮Eth含量的动态变化,对果皮PaO、Chlase活性和果皮叶绿素含量的动态变化也无显著影响,这可能是果皮Eth、PaO和Chlase等与Mg处理克服果皮“滞绿”问题无关的原因。
参考文献
[1] 倪耀媛, 吴素芬. 荔枝栽培[M]. 北京: 中国农业出版社, 1990.
[2] 张 锐, 韩丽婷, 王 娟,等. 两个荔枝品种果皮着色和果肉糖酸积累特点的比较[J]. 福建农林大学学报, 2014, 43(4):374-378
[3] 王惠聪, 黄旭明,黄辉白. 妃子笑荔枝果实着色不良原因的研究[J]. 园艺学报, 2002, 29(5): 408-412.
[4] 张 锐, 杨 迎, 文亚迪,等. 三月红和白糖罂荔枝果皮着色动态差异的比较[J]. 福建农业学报, 2013, 28(9): 892-896.
[5] 周开兵, 苏 举, 徐远峰. 荔枝果皮着色与色素含量的关系[J]. 山地农业生物学报, 2007, 2(1): 30-33.
[6] 李 平, 陈大成, 胡桂兵,等. 荔枝果实发育过程中果皮色素的变化[J]. 热带亚热带植物学报, 1999, 71(1): 53-58.
[7] 高飞飞, 尹金华, 陈大成, 等. 荔枝果皮叶绿素、 类胡萝卜素、 花色苷的形成规律及对果色的影响[J]. 华南农业大学学报, 2000, 21(1): 16-18.
[8] 王家保, 刘志媛, 杜中军,等. 荔枝果实发育过程中果皮颜色形成的相关分析[J]. 热带作物学报, 2006, 27(2): 11-17.
[9] 王惠聪, 黄旭明, 胡桂兵,等. 荔枝果皮花青苷合成与相关酶的关系研究[J]. 中国农业科学, 2004, 37(12): 2 028 -2 032.
[10] 陈大成, 李 平, 胡桂兵,等. 套袋对妃子笑荔枝果实着色的影响[J]. 华南农业大学学报, 1999, 20(4): 65-69.
[11] 周晓超, 苏 阳, 张 锐, 等. 叶面喷布钾、钙和镁肥对妃子笑荔枝果皮着色的调节效果[J]. 西南农业学报, 2015, 28(4):1 713-1 718.
[12] 齐秀娟, 徐善坤, 李作轩,等. 山楂果实发育期矿质元素和色素含量的动态变化及相关关系[J]. 果树学报, 2006, 32(2):214-217.
[13] Pirie A, Mullins M G. Changes in anthocaynin and phenolic content of grapevine leaf and abscisic acid[J]. Plant Phys,1976, 58: 468-472.
[14] 张昭其, 庞学群, 段学武,等. 荔枝采后果皮花色素苷的降解与花色素苷酶活性变化[J]. 中国农业科学, 2003, 36(8): 945-949.
[15] 翁雪成, 袁 红. 蒽酮-硫酸法测定荔枝核中可溶性多糖含量[J]. 杭州师范学院学报, 2007(27): 1 007-1 008.
[16] 吴颂如, 陈婉芬, 周 燮. 酶联免疫法(ELISA)测定内源植物激素[J]. 植物生理学通讯, 1988(5): 53-57.
[17] 庞学群, 张昭其, 段学武, 等. 乙烯与1-甲基环丙烯对荔枝采后果皮褐变的影响[J]. 华南农业大学学报, 2001, 22(4): 11-14.
[18] Hortensteiner S, Vicentini F, Matile P. Chlorophyll breakdown in senescent cotyledons of rape, Brassica napus L.: enzymatic cleavage of phaeophorbide a in vitro[J]. New Phytol, 129: 237-246.
[19] 甘志军, 王晓云, 邹 琦. 小麦叶绿素酶生化动力学特性研究[J]. 西北植物学报, 2003, 23(5): 750-754.
[20] Murray J R, Hackett W P. Dihydroflavonol reductase activity in relation to differential anthocyanin accumulation in juvenile and mature phase Hedera helix L. [J]. Plant Physiology,1991, 97: 343-351.
[21] Lister C E, Lancaster J E. Developmental changes in enzymes of flavonoid biosynthesis in the skins of red and green apple cultivars[J]. Journal Science of Food Agriculture, 1996, 71:313-320.
[22] Ju Z G, Liu C L, Yuan Y B, et al. Coloration potential, anthocyanin accumulation, and enzyme activity in fruit of commercial apple cultivars and their F1 progeny[J]. Scientia Horticulturae, 1999, 79: 39-50.
[23] 李 明, 郝建军, 于 洋, 等. 脱落酸(ABA)对苹果果实着色相关物质变化的影响[J]. 沈阳农业大学学报, 2005, 36(2):189-193.
[24] Tanaka A, Tanaka R. Chlorophyll metabolism[J]. Curr Opin Plant Biol., 2006, 9(3): 248-255.
[25] Huicong Wang, Huibai Huang, Xuming Huang. Differential effects of abscisic acid and ethylene on the fruit maturation of Litchi chinensis Sonn[J]. Plant Growth Regul, 2007, 52: 189-198.
