亚洲韧皮杆菌在单株脐橙病树的分布情况
2016-05-30卢占军赵培娅刘映雪丁鹏苏华楠易龙钟八莲
卢占军 赵培娅 刘映雪 丁鹏 苏华楠 易龙 钟八莲


摘要:【目的】研究亚洲韧皮杆菌(CLas)在紐荷尔脐橙病树的分布情况,为柑橘黄龙病(HLB)的防控提供参考依据。【方法】以1~3个枝条表现斑驳黄化叶片症状的纽荷尔脐橙病树为研究对象,对主干发出的5个主枝(A、B、C为斑驳黄化枝条,D、E为无症状枝条)的叶片分别取样,运用PCR和实时荧光定量PCR(qPCR)分别检测,用2-ΔΔCt法分析树体各部分黄龙病菌含量。对于果树上表现典型HLB病果但叶片无症状的结果枝,分别检测典型病果和相应叶片的感病情况。【结果】PCR对A、B、C、D、E的阳性检出率分别为88.57%、61.11%、54.17%、6.67%和0,qPCR对A、B、C的阳性检出率均为100.00%,对D、E的阳性检出率分别为40.00%和13.33%;2-ΔΔCt法分析发现,斑驳黄化叶片中病原菌含量更高,病果的阳性检出率高于相应的无症状叶片样品。【结论】CLas在表现典型斑驳黄化症状的叶片和果实中的含量及阳性检出率均较高,病原菌在病树中分布不均匀。在进行HLB检测时,应选取典型或疑似症状样品,并运用qPCR进行检测,一旦发现树体局部发病,应当整株销毁。
关键词: 柑橘黄龙病;亚洲韧皮杆菌;实时荧光定量PCR;2-ΔΔCt法
中图分类号: S432.42 文献标志码:A 文章编号:2095-1191(2016)09-1512-05
Abstract:【Objective】Distribution of Candidatus Liberibacter asiaticus(CLas) in Newhall navel orange tree was investigeted, in order to provide reference for prevention and control of citrus Huanglongbing(HLB). 【Method】Newhall tree were used as research object, which had 1-3 branches with mottled yellow leaf symptoms. The leaves were collected from five main branches(A, B and C branches with mottled yellow leaves, D and E asymptomatic branches) on the trunk, respectively. Then samples were detected and analysed by using PCR and quantitative real-time PCR(qPCR), and CLas content in different parts of tree was analyzed by using 2-ΔΔCt method. For some branches with pathognomonic HLB-infected fruits but without symptomatic leaves, their fruits and leaves were detected, respectively. 【Result】The results showed that, using PCR method, the positive rates of A, B, C, D, E were 88.57%, 61.11%, 54.17%, 6.67% and 0, respectively, while using qPCR method, the positive rates of A, B, C, D, E were 100.00%, 100.00%, 100.00%, 40.00%, 13.33%, respectively. Furthermore, 2-ΔΔCt analysis showed that, CLas content was higher in mottled yellow leaves than asymptomatic leaves, and the positive rate of infected fruits was higher than corresponding asymptomatic leaves. 【Conclusion】Content and positive rate of CLas are higher in mottle yellow leaves and pathognomonic HLB-infected fruits than asymptomatic leaves, and CLas was distributed unevenly in the whole infected tree. In the detection, the samples with typical symptoms or suspected samples should be selected, and then detected by qPCR method. Furthermore, once partial branchs of tree are found to be infected, the whole tree should be destroyed immediately.
Key words: citrus Huanglongbing; Candidatus Liberibacter asiaticus; quantitative real-time PCR; 2-ΔΔCt method
0 引言
【研究意义】柑橘黄龙病(Citrus Huanglongbing,HLB)是近年来柑橘生产中最具毁灭性的病害,其流行范围广,无有效化学药剂可治疗,是世界柑橘产业面临的主要难题(Bové, 2014;Wang and Trivedi,2013)。目前应对HLB威胁的方法以防控为主,因此,了解柑橘黄龙病病原菌在寄主中的运动、扩散、分布等情况,对于开展柑橘黄龙病早期检测和疫情监控具有重要意义。【前人研究进展】Garnier等(1984)首次通过电镜观察到HLB病原菌是寄生于植物筛管的细菌,由于无法人工培养,尚未完成柯赫氏法则验证。该病原菌被暂定为韧皮杆菌属下3个种:亚洲种(Candidatus Liberibacter asiaticus, CLas)、非洲种(Ca. L. africanus, CLaf)和美洲种(Ca. L. americanus, CLam)(Jagoueix et al., 1994;Texeira et al., 2005),其中以CLas分布最广、危害最严重,我国目前主要为CLas(苏华楠,2013)。Tatineni等(2008)研究发现,HLB病原菌在病树体内分布不均匀;Teixeira等(2008)研究发现,美洲种在同一树体内斑驳黄化叶片的阳性检出率和含量最高,一般常规PCR即可检出,含量为107拷贝/g,其余依次为缺锌症状叶片、无症状叶片;Li等(2009)的研究结果表明,同一树体的不同组织CLas含量差异较明显,其中果实隔膜和中柱的病原菌含量最高。【本研究切入点】HLB病原菌早期检测最常用的是PCR技术,包括PCR和实时荧光定量PCR(qPCR),其中qPCR实时收集荧光信号,耗时短,灵敏度比常规PCR高两个数量级(Tatineni et al.,2008)。目前,运用qPCR相对定量法(2-ΔΔCt)研究柑橘黄龙病菌在病树中含量差异的研究鲜有报道。【拟解决的关键问题】以田间1~3个枝条表现叶片斑驳黄化的整株纽荷尔脐橙病树为主要研究对象,分别运用PCR和qPCR进行检测,分析亚洲韧皮杆菌(CLas)在病树中的含量分布;结合赣州章贡区一失管果园大量果树表现的同一枝条上出现无症状叶片和有症状果实的现象,采用常规PCR分别检测典型病果和相应叶片,以掌握CLas在病树、病果及相应无症状叶片中的分布情况,探索更佳的取样和检测方法,为柑橘黄龙病早期检测和防控提供理论依据。
1 材料与方法
1. 1 试验材料
试验于2014年11月在国家脐橙工程技术研究中心进行,阴、阳性对照均取自国家脐橙工程技术研究中心玻璃温室。
感病脐橙叶片样品采集:样品取自赣州市章贡区仪丰果园,树龄4年。田间选取初期观察到仅1~3个枝条出现典型斑驳黄化叶片的纽荷尔脐橙果树,病树主干发出5个主枝分别编号A、B、C、D、E(图1),取同一分支的叶片为1个样品,其中A(44份样品)、B(26份样品)、C(24份条样品)为斑驳黄化叶片主枝,D(30份样品)、E(30份样品)为无症状叶片主枝,共取样154份。
HLB病果和无症状叶片样品采集:田间选取赣州章贡区某失管果园不同果树表现典型HLB病果但叶片无症状的结果枝,每枝条取5~6个叶片作为1个样品,共取样96份,同时采集相应结果枝的病果96份(图2)。
1. 2 PCR及qPCR检测
样品总DNA提取采用改良CTAB-Triton法(苏华楠等,2014)。
PCR检测引物为Las606/LSS,序列见表1。PCR反应体系25.0 μL:DNA模板1.0 μL,10×Buffer缓冲液2.5 μL,10 mmol/L dNTPs 0.5 μL ,10 μmol/L上、下游引物各0.5 μL,5 U/μL rTaq DNA聚合酶0.3 μL,ddH2O,19.7 μL。扩增程序:95 ℃预变性3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,进行30个循环;72 ℃延伸7 min。
qPCR检测引物和内参引物分别为f-rplLAs/r-rplLAs和UPL7-F/UPL7-R,序列见表1,检测基因和内参基因的扩增效率基本一致。每个样品重复3次,每次反应均设置内对照和无模板混合液对照,以国家脐橙工程技术研究中心玻璃温室保存的阳性样品为内对照。qPCR反应体系15.0 μL:iTaqTM Universal SYBR Premix(2×conc.)7.5 μL,ddH2O 5.3 μL,10 μmol/L上、下游引物各0.6 μL,模板1.0 μL。扩增程序:95 ℃预变性30 s;95 ℃ 5 s,64 ℃ 30 s,采集荧光信号,进行40个循环;融解曲线:95 ℃ 10 s,67 ℃ 5 s,每加0.5 ℃ 5 s,95 ℃ 15 s。反应在ABI Step-One仪器上运行。
1. 3 CLas相对定量分析
qPCR数据运用2-ΔΔCt法分析。3个重复达到设定阈值的循环数即Ct差距在1以内的取平均值;若3个重复均无扩增或两次未扩增,一次Ct>35,均视为阴性;否则重新进行试验。以CLas含量最低的样品为参照,用Excel 2003进行数据处理,参照Livak和Schmittgen(2001)对qPCR分析基因表达的相对定量采用2-ΔΔCt进行分析,为使结果更直观取lg2 (-ΔΔCt)为纵坐标表示各检测样品的相对含菌量制图,即纵坐标轴的数值n相当于病原菌CLas相对含量为10n,并用Adobe Illustrator CC绘制各枝条叶片病菌分布图。
1. 4 病果与无症状叶片CLas检测
运用PCR對96份病果和相应的96份无症状叶片进行检测,引物为Las606/LSS,反应程序和体系同1.2。
2 结果与分析
2. 1 PCR和qPCR对病树样品的检测效果比较
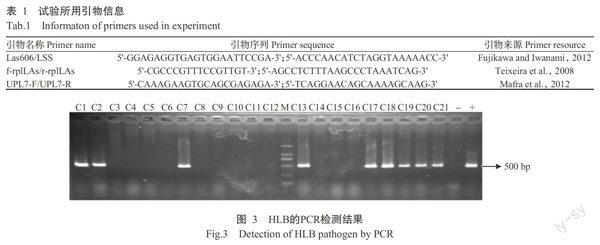
PCR对A、B、C 3个斑驳黄化枝条阳性检出率分别为88.57%、61.11%和54.17%,而qPCR对A、B、C 3个枝条的阳性检出率均为100.00%;PCR对D、E 2个枝条的阳性检出率分别为6.67%和0,而qPCR对二者的阳性检出率分别为40.00%和13.33%。此外,qPCR检测结果覆盖了PCR的检测结果,如样品C1~C21,PCR检测结果仅C1、C2、C7、C13、C17~C21呈阳性(图3),而qPCR检测结果为C1~C21均呈阳性(图5),说明qPCR较PCR更灵敏。
2. 2 感病树体CLas相对含量分析
由图4可知,A、B和C枝条所有样品中均能检测到CLas存在,A枝条叶片整体相对含菌量高于B和C枝条, D、E枝条只有部分叶片检出有CLas存在,其中E枝条30个样品中仅有4个检测到CLas,各枝条的CLas最高含菌量与最低含菌量相差104~1010倍。说明CLas主要分布在下部有斑驳黄化枝条样品中,在上部无症状枝条样品中分布较少。
对照图4和图5中各枝条的采样点整体上分析,发现主枝A、B近主干端的样品CLas相对含量更高,树冠外围含量稍低,主枝C中C17~C24所在侧枝的整体CLas相对含量高于该主枝的其他样品,主枝D、E也有部分样品检测到CLas,说明CLas普遍存在于感病树体内。
2. 3 病果及无症状叶片感病情况
经PCR检测发现,HLB病果阳性检出率为100.00%,无症状叶片阳性检出率为60.40%。HLB病果阳性率高于无症状叶片,且看似无症状的叶片,实则已感染HLB。
3 讨论
(1)斑驳黄化样品病原菌含量比无症状样品高。斑驳黄化枝条A、B、C病原菌相对含量比无症状枝条D、E相对含量高,同一结果枝上的病果比无症状叶片阳性检出率约高40.00%。由此可见,表现典型症状样品的病原菌相对含量和阳性检出率均高于无症状样品,与Teixeira等(2008)的研究结果一致。本研究将整株树分为5个部分,A、B、C为近地面枝条,D、E为远地面枝条,前者斑驳黄化症状明显,后者无症状,荧光定量检测表明前者样品全部感病,后者样品部分感病,前者的整体病原菌相对含量高于后者。
(2)病原菌分布不均匀。病树样品病原菌相对含量相差达104~1010倍,与Li等(2009)的研究结果相似。Li等(2009)发现田间自然感染CLas的果树地上部分和根部组织病原菌相对含量可达1010个/g,同一树体的不同组织含量差异较明显。本研究中,D、E枝条有少部分样品感病,其中D22和E21的病原菌相对含量甚至高于A、B、C中的大部分样品,说明CLas在病树体内分布不均匀,与Tatineni等(2008)的研究结果一致。分析A、B、C的病原菌相对含量发现,近主干端比远主干端含量更高,推测这些枝条的病原菌可能由根部移动而来。Johnson等(2014)发现树体经带菌木虱刺吸取食后会在根部有相对较高的病原菌含量,在HLB症状严重的病树上发现根部组织已大部分死亡,因此推测CLas由根部传向其他部位。但Ding等(2015)用DTBIA方法研究了CLas在柑橘和长春花中的含量,结果表明叶柄含菌量最高、根部最低,与陈传武等(2015)的研究结果一致。因此,CLas在同一树体不同组织或不同部位含量差异很明显,且分布不均匀,而关于根部病原菌含量高低及传播机制等问题尚有待进一步探索。
(3)对未显症叶片原因的探讨。2014年脐橙采摘期,在赣南地区的果园发现一些果树叶片无HLB症状,但果实表现典型症状现象。对兼有HLB病果和无症状叶片的结果枝的研究发现,无症状叶片有高达60.40%的阳性检出率,无症状叶片阳性叶片可能早期已经感病,但处于潜伏期,直到果实成熟后才在果实表现症状。Faghihi等(2009)和García-Pérez等(2013)的研究结果表明,HLB在田间感染大树后,潜伏期可能长达5年以上,通过柑橘木虱传播的CLas潜伏期阶段存在很大不确定性。因此,叶片是否表现症状与潜伏期长短有关,但CLas普遍存在于染病树体内。在柑橘生产中,对于病树不能只砍病枝,应完全砍除病株销毁,以绝后患。
(4)病原菌含量随季节而变化。有关CLas含量随季节变化的研究也有报道,不同月份病树体内CLas含量变化较大,一年中CLas含量最高的季节是秋季,此时Ct最低,斑驳症状最明显(Sauer et al., 2015)。胡浩(2007)的研究结果表明,CLas在病树体内10月含量最高,之后随时间的推移而降低,推测冬季低温对CLas的繁殖和木虱的传播有明显的抑制作用。
4 结论
本研究结果表明,HLB侵染脐橙果树后病原菌普遍存在于病树体内,但分布不均匀,在有症状的样品中病原菌相对含量整体上比无症状的样品高。在早期检测时,应选取典型或疑似症状样品采用qPCR进行检测,若检测结果为感染HLB,则应将病株整株销毁。
参考文献:
陈传武, 付慧敏, 邓崇岭, 李贤良, 邓光宙, 娄兵海. 2015. 柑橘和黄皮中黄龙病菌含量动态变化[J]. 南方农业学报,46(6): 1024-1028.
Chen C W, Fu H M, Deng C L, Li X L, Deng G Z, Lou B H.2015. Dynamic variation of Huanglongbing pathogen content in citrus and wampee[J]. Journal of Southern Agriculture, 46(6): 1024-1028.
胡浩. 2007. 应用荧光定量PCR技术研究亚洲韧皮部杆菌在寄主体内的动态变化及分布[D]. 重庆:重庆大学.
Hu H. 2007. Research on dynamic change and distribution of Candidatus Liberibacter asisticus in hosts with real-time PCR[D]. Chongqing: Chongqing University.
苏华楠. 2013. 中国柑橘黄龙病病原调查、种群遗传分化及其原噬菌体溶菌酶蛋白原核表達[D]. 重庆: 西南大学.
Su H N. 2013. HLB etiology survey, population differentiation of ‘Candidatus Liberibacter asiaticus in China and Lysozyme protein prokaryotic expression of its prophage[D]. Chongqing: Southwest University.
苏华楠, 王雪峰, 黄爱军, 李中安, 唐科志,周常勇. 2014. 高质量提取柑橘样品中病原总核酸方法的建立[J]. 园艺学报, 41(11): 2342-2352.
Su H N, Wang X F, Huang A J, Li Z A, Tang K Z, Zhou C Y. 2014. High quality total nucleic acid extraction method from citrus for disease detection[J]. Acta Horticulturae Sinica, 41(11): 2342-2352.
Bové J M. 2014. Huanglongbing or yellow shoot, a disease of Gondwanan origin: Will it destroy citrus worldwide?[J]. Phytoparasitica,42(5): 579-583.
Ding F, Duan Y, Paul C, Brlansky R H, Hartung J S. 2015. Localization and distribution of ‘Candidatus Liberibacter asiaticus in citrus and periwinkle by direct tissue blot immuno assay with an anti-ompa polyclonal antibody[J]. PLoS One,10(5): 3466-3480.
Faghihi M M, Salehi M, Bagheri A, Izadpanah K. 2009. First report of citrus huanglongbing disease on orange in Iran[J]. Plant Pathology,58(4):793-793.
Fujikawa T, Iwanami T. 2012. Sensitive and robust detection of citrus greening(huanglongbing) bacterium “Candidatus Li-
beribacter asiaticus” by DNA amplification with new 16S rDNA-specific primers[J]. Molecular and Cellular Probes,26(5): 194-197.
García-Pérez F,Ortega-Arenas L D,López-Arroyo J I,González-Hernández A,Lomeli-Flores J R,Romero-Nápoles J. 2013. Morphometry of diaphorinacitri(hemiptera: liviidae) on six rutaceae from veracruz, Mexico[J]. Florida Entomology, 96(2):529-537.
Garnier M, Danel N, Bové J M. 1984. The greening organism is a gram negative bacterium[C]//Proc. 9th Conference of the International Organization of Citrus Virologists. California:University of California, Riverside:115-124.
Jagoueix S, Bové J M, Garnier M. 1994. The phloem-limited bacterium of greening disease of citrus is a member of the alpha subdivision of the Proteobacteria[J]. International Journal of Systematic Bacteriology,44(3): 379-386.
Johnson E G, Wu J, Bright D B, Graham J H. 2014. Association of ‘Candidatus Liberibacter asiaticus root infection, but not phloem plugging with root loss on huanglongbing-affected trees prior to appearance of foliar symptoms[J]. Plant Pathology,63(2):290-298.
Li W, Laurene L, Johns H. 2009. Quantitative distribution of ‘Candidatus Liberibacter asiaticus in citrus plants with citrus huanglongbing[J]. Phytopathology,99(2): 139-144.
Livak K J, Schmittgen T D. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 25(4):402-408.
Mafra V, Kubo K S, Alves-Ferreira M, Ribeiro-Alves M, Stuart R M, Boava L P, Rodrigues C M, Machado M A. 2012. Reference genes for accurate transcript normalizatioin in citrus genotypes under different experimental conditions[J]. PLoS One, 7(2):e31263.
Sauer A V, Zanutto C A, Nocchi P T R, Machado M A, Bock C H, Nunes W M D C. 2015. Seasonal variation in populations of ‘Candidatus Liberibacter asiaticus in citrus trees in Paraná state, Brazil[J]. Plant Disease,99(8): 1125-1132.
Tatineni S, Sagaram U S, Gowda S, Robertson C J, Dawson W O, Iwanami T, Wang N. 2008. In planta distribution of ‘Candidatus Liberibacter asiaticus as revealed by polymerase chain reaction(PCR) and real-time PCR[J]. Phytopathology, 98(5): 592-599.
Teixeira D C, Saillard C, Couture C, Martins E C, Wulff N A, Eveillard-Jagoueix S, Yamamoto P T, Ayres A J, Bové J M. 2008. Distribution and quantification of Candidatus Liberibacter americanus, agent of huanglongbing disease of citrus in sao paulo state, brasil, in leaves of an affected sweet orange tree as determined by PCR[J]. Molecular and Cellular Probes,22(3): 139-150.
Texeira D C, Ayres J, Kitajima E W, Danet L, Jagoueix-Eveillard S, Saillard C, Bové J M. 2005. First report of a Huanglongbing-like disease of citrus in Sao Paulo State, Brazil and association of a new Liberibacter species,“Candidatus Liberibacter americanus”, with the disease[J]. Plant Disease, 89(1): 107.
Wang N, Trivedi P. 2013. Citrus Huanglongbing: a newly relevant disease presents unprecedented challenges[J]. Phytopathology, 103(7): 652-665.
(責任编辑 麻小燕)
