水稻GS3蛋白及其与Gβ蛋白复合物的表达及结晶初筛
2016-05-30罗秋琦曾志雄
罗秋琦 曾志雄

摘要:【目的】阐明GS3蛋白在水稻中的调控机制,为解析植物G蛋白的结构及完善G蛋白的调控网络打下基础。【方法】分别采用表达载体pGEX-6p-1和pET-28b-sumo诱导表达GS3蛋白N端结构域OSR和GS3蛋白C端结构域,再使用凝胶过滤柱Superdex 200/75 10/300和阴例子交换层析柱Mono Q 5/50纯化表达蛋白,通过筛选优化晶体和X射线衍射的方法对GS3及GS3与Gβ共表达复合物的结构进行研究。【结果】将构建的重组蛋白OSR-pGEX-6p-1与GβN- pET-28b-sumo转入大肠杆菌BL21(DE3)中共表达,经GST beads亲和层析可获得2条条带,分别为OSR-GST(31 kD)和GβN-sumo(26 kD),再过Ni2+ beads亲和层析同样有2条条带,而SDS-PAGE凝胶电泳结果显示有4条条带,分别为GST(26 kD)、sumo(17 kD)、GβN(9 kD)和OSR(5 kD)。经阴例子交换层析柱Mono Q 5/50分离纯化可获得GβN(9 kD)和OSR(5 kD)二者的复合物。将纯化后的复合物浓缩至12 mg/mL进行晶体初筛,但未获得结晶。【结论】GS3和Gβ互作是通过GS3蛋白N端结构域OSR与Gβ N端结构域的结合而实现,其结果符合经典的G蛋白异源三聚体模型。
关键词: 水稻;GS3蛋白;Gβ蛋白;原核表达;结晶初筛
中图分类号: S511;Q518.2 文献标志码:A 文章编号:2095-1191(2016)09-1450-07
Abstract:【Objective】Regulation mechanism of GS3 protein in rice was investigated, in order to lay foundation for analyzing structure of plant G protein and perfecting regulation network of G protein. 【Method】N-terminal domain of GS3 protein OSR and C-terminal domain of GS3 protein were expressed by inducing expression vectors pGEX-6p-1 and pET-28b-sumo, respectively. Then the gel filtration columns superdex 200/75 10/300 and ion exchange column Mono Q 5/50 were used to purify protein. The structures of GS3 and co-expression complex of GS3 and Gβ were studied by optimizing crystal and X-ray diffraction. 【Result】The constructed recombinant proteins OSR-pGEX-6p-1 and GβN-pET-28b-sumo were co-expressed in Escherichia coli BL21(DE3). Then two bands were obtained by GST beads affinity chromatography, which were OSR-GST(31 kD) and GβN-sumo(26 kD), respectively. After Ni2+ beads affinity chromatography, two bands were still found. However, SDS-PAGE results showed that, four bands were found, including GST(26 kD), Sumo(17 kD), GβN(9 kD) and OSR(5 kD). The complex of GβN(9 kD) and OSR(5 kD) were obtained by separation and purification with ion exchange column Mono Q 5/50. The purified complex was concentrated to 12 mg/mL for crystal screening, but no crystal was obtained. 【Conclusion】G protein in rice is consistent with the classical heterotrimeric G protein model due to interaction of GS3 and Gβ that GS3 N-terminal domain OSR was integrated with Gβ N-terminal.
Key words: rice; GS3 protein; Gβ protein; prokaryotic expression; crystal screening
0 引言
【研究意义】水稻是世界最重要的粮食作物之一,也是单子叶植物基因组研究的重要模式植物。虽然杂交育种的成功促使水稻产量得到较大提高,但随着人口的增长和人民生活水平的提高,水稻产量和品质在未来很长一段时间内仍需继续提高和改良。水稻产量是一个复杂的数量性状,衡量水稻产量主要有3个因素,即单株穗数、每穗粒数和粒重(Botella,2012),其中粒重又与谷物的大小和形状密切相关。近二十年来,研究人员一直在开展关于控制水稻产量基因的克隆工作,如Fan等(2006)通过图位克隆的方法克隆出控制水稻粒型的基因GS3,Mao等(2010)从DNA水平证明了GS3蛋白是水稻粒型的负调控因子。GS3蛋白是G蛋白家族中的一员,参与调控多种生理作用,因此,探明GS3蛋白的具体作用机制,对控制水稻产量基因的深入研究具有重要意义。【前人研究进展】异源三聚体G蛋白是一种非常保守的膜信号转导蛋白,由α、β和γ三个亚基组成。目前,在哺乳动物中已发现有23个Gα、6个Gβ和12个Gγ;在植物中仅发现1个Gα、1个Gβ和3个Gγ(Mason and Botella,2001)。GS3为水稻Gγ中的一员,与另外两个γ亚基的不同在于除了N端传统的γ-like结构域外,其C端还有一段100~200个氨基酸组成的富含半胱氨酸区域。动物G蛋白可在GPCR的作用下被激活,异源三聚体分解成两个有功能的部分Gα和Gβγ二聚体(Fukuoka et al.,1998),在该反应中Gβ与Gγ在细胞内是共同以一个功能单位来发挥作用,是不可分割的单元(Li et al.,2004;Kovach et al.,2007;Jones et al.,2011)。但也有研究发现植物G蛋白的激活不需要GPCRs,能够自发地结合GTP分解成两个有功能的部分(Kovach et al.,2007)。Gα亞基及Gβγ二聚体两部分既协同又独立地调控植物的生命进程。利用功能缺失突变体发现Gα与植物气孔关闭、种子萌发、氧压等一系列活动有关,而Gβγ参与花叶果实的生长、真菌防御、离子通道、根的萌发等过程(Takeuchi et al.,2000;Trusov et al.,2007)。【本研究切入点】至今,有关GS3蛋白结构的研究鲜有报道,植物中GS3与Gβ蛋白的结合是否符合经典的G蛋白激活机制也有待进一步验证。【拟解决的关键问题】通过对GS3蛋白N端OSR结构域及Gβ蛋白N端结构域进行共表达纯化,并对纯化到的蛋白进行晶体初筛,旨在初步验证植物中GS3与Gβ蛋白的结合机制,为解析植物G蛋白的结构及完善G蛋白的调控网络打下基础。
1 材料与方法
1. 1 试验材料
大肠杆菌(Escherichia coli)DH5α用于普通克隆;大肠杆菌BL21(DE3)用于原核表达;载体pGEX-6P-1(GST标签)用于构建表达蛋白载体;pET-28b-sumo(His标签)用于构建表达蛋白载体。限制性内切酶购自TaKaRa和Thermo公司;T4 DNA连接酶购自Thermo公司;DNA Marker购自北京全式金生物技术有限公司; PageRulerTM Prestained Protein Ladder购自Thermo公司;卡那霉素(Kan)和氨苄青霉素(Amp)及异丙基-
β-D-硫代吡喃半乳糖苷(IPTG)购自生工生物工程(上海)股份有限公司;PCR EsTaq Mix及快速琼脂糖凝胶DNA回收试剂盒和质粒小提试剂盒购自北京康为世纪生物科技有限公司;引物合成及测序由北京擎科新业生物技术有限公司和英潍捷基(上海)贸易有限公司完成。
1. 2 生物信息学分析
氨基酸的保守性结构域、同源性和理化性质分别利用SMART(http://smart.embl-heidelberg.de/)、NCBI(http://blast.ncbi.nlm.nih.gov/Blast.cgi)和PROTPARAM(http://web.expasy.org/protparam/)进行预测;利用Clus-talOmega(http://www.ebi.ac.uk/Tools/msa/clustalo/)进行氨基酸的多序列比对;利用PHYRE2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)对氨基酸的二级结构进行预测。
1. 3 载体构建
根据cDNA序列及二级结构分析预测结果设计引物,引物前端含有Bgl Ⅱ酶切位点(AGATCT),后端引物含Not Ι酶切位点(GCGGCCGC),并在后端引物酶切位点之前加入终止子(TAA)(表1)。以cDNA为模板进行PCR扩增,用BglⅡ和Not Ι限制酶双酶切扩增片段。用BamH Ι和Not Ι限制酶双酶切表达载体pGEX-6p-1和pET-28b-sumo。将酶切后的片段与酶切后的载体用T4连接酶连接。转化DH5α菌株,挑单克隆培养后,提质粒进行酶切验证,最后测序获得正确的质粒。
1. 4 蛋白表达
1. 4. 1 蛋白表达和纯化 将成功重组且测序正确的质粒转化至大肠杆菌BL21(DE3)中,挑取单菌落,接种于含有相应抗性的的LB液体培养基(100 μg/mL Amp或50 μg/mL Kan)中。37 ℃振荡培养至OD600=0.6~0.8,加入IPTG至终浓度0.1 mmol/L,诱导蛋白表达,20 ℃培養12~16 h,4000 r/min离心15 min后收集菌体。将获得的菌体用裂解液[50 mmol/L Tris(pH 8.0)、400 mmol/L NaCl和10%(v/v)甘油]重悬,随后用超声破碎仪(SONICS)破碎细胞,离心去除细胞碎片。收集上清液,将其加入用裂解液平衡好的树脂。亲和纯化带His标签的蛋白所用树脂为Qiagen的Ni-NTA agarose,亲和纯化带GST标签的蛋白所用树脂为GE Healthcare的Glutathione Sepharose 4B。纯化得到带标签的目的蛋白后, 加入U1p1和3C酶于4 ℃过夜酶切,分别切除His标签蛋白和GST标签蛋白。随后将洗下的蛋白用超滤管(Millipore)浓缩至适当体积,使用凝胶过滤柱Superdex 200/75 10/300(GE Healthcare)和阴例子交换层析柱Mono Q 5/50(GE Healthcare)在AKTA Avant(GE Healthcare)蛋白纯化仪上对蛋白进行进一步纯化。
1. 4. 2 蛋白共表达亲和层析 将构建的两个或多个具有相容性的表达载体转入同一大肠杆菌BL21(DE3)中,借助不同的蛋白标签,通过两步亲和纯化,SDS-PAGE检测,直观验证蛋白间的是否存在相互作用,减少或避免酵母双杂交等方法中的假阳性。
1. 5 结晶条件初筛与晶体优化
使用Hampton Research和EMERALD BIO公司的Crystal Screen、Crystal Screen2、Index、Wizard等稀疏矩阵结晶筛选试剂盒进行晶体条件的初筛。采用座滴气相扩散法,将各条件的试剂分别取50.0 μL分装到96孔板中,用微量移液器吸取0.4 μL蛋白样品和0.4 μL结晶试剂于座滴孔中,用封口膜(Hampton)密封,于4 ℃或16 ℃环境下生长。在得到初始结晶条件后,采用沉淀剂浓度梯度、pH梯度、结晶温度、添加剂筛选及去垢剂筛选等方法对该条件进行调整和优化,以得到最佳衍射能力的晶体。
1. 6 X射线衍射数据收集
初筛晶体在上海同步辐射中心(SSRF,上海)的BL18U1、BL19U1等线站进行衍射及数据收集。
2 结果与分析
2. 1 GS3基因与Gβ基因的序列分析及克隆
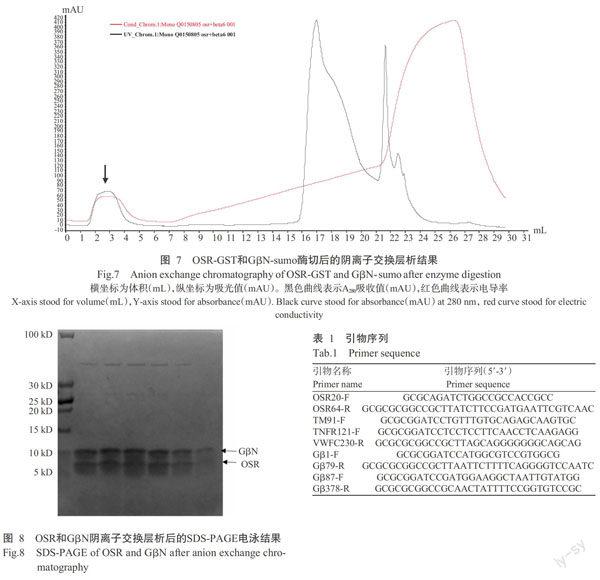
2. 1. 1 GS3蛋白、Gβ蛋白保守结构域的预测结果 在SMART保守结构域的预测网站上,输入GS3和Gβ的氨基酸序列,将GS3全长蛋白划分为OSR20-64、TM91-118、TNFR121-155和VWFC156-230共4个结构域;将Gβ全长蛋白划分为GβN1-79和GβC87-374 2个结构域。
2. 1. 2 GS3基因与Gβ基因克隆结果 依据2.1.1中的分析预测结果设计引物,进行PCR扩增。各片段理论如下:OSR20-64 132 bp,TM+TNFR+VWFC 417 bp,TNFR+VWFC 327 bp,Gβ1-378 1134 bp,Gβ1-79 237 bp,Gβ87-378 873 bp。PCR产物经1.0%琼脂糖凝胶电泳,结果显示扩增出的DNA片断与片断理论大小一致。
2. 2 表达载体的构建
PCR产物经快速琼脂糖凝胶DNA回收试剂盒纯化后,进行Bgl Ⅱ和NotⅠ双酶切,空载pGEX-6P-1和pET-28b-sumo分别进行BamHⅠ和NotⅠ双酶切处理,分别纯化后利用T4连接酶23 ℃连接30 min,转化大肠杆菌DH5α,挑取单个菌落,37 ℃培养过夜后利用质粒小提试剂盒提取质粒,进行PCR鉴定。质粒测序结果与理论序列比对,结果完全一致。将测序正确的质粒转化至大肠杆菌BL21(DE3)中进行蛋白诱导表达。
2. 3 GS3蛋白N端结构域OSR的原核表达、纯化及结晶
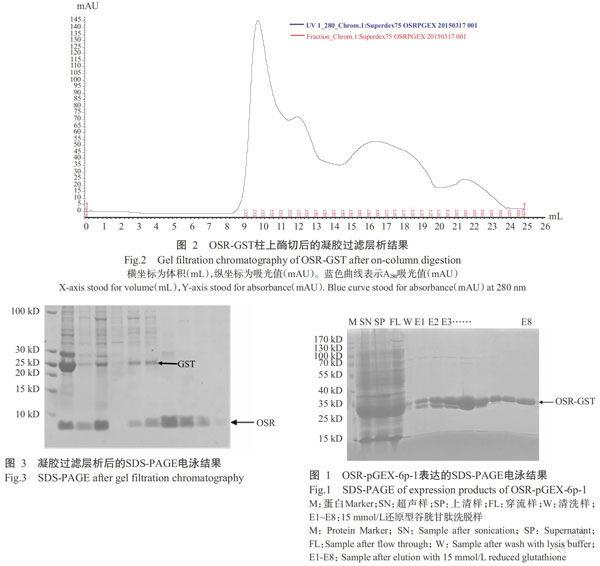
將构建好的OSR-pGEX-6p-1重组蛋白进行大量表达。用GST beads进行亲和层析后,OSR-GST达到较高纯度,但目的条带下方仍有一部分杂带(图1)。采用柱上酶切的方法,在清洗完杂蛋白后,用裂解液重悬beads,加入3C酶,混匀,4 ℃过夜酶切。随后穿留下目的蛋白,用3 kD超滤管浓缩至1 mL。1 mL蛋白样品经过Superdex 200 10/300凝胶过滤层析进一步纯化(图2)。取样进行SDS-PAGE凝胶电泳。从图3可看出,经过柱上酶切和凝胶过滤层析后,目的蛋白OSR和标签GST已经分开,最后得到较纯的OSR蛋白。浓缩至15 mg/mL,进行晶体初筛。
在72 h内,有两个条件出现了晶体,分别为:(1)10% PEG-8000(沉淀剂),200 mmol/L NaCl,100 mmol/L磷酸二氢钾/磷酸氢二钠,pH 6.2;(2)30% PEG-4000(沉淀剂),200 mmol/L氯化铵/10 mmol/L二水氯化钙(盐),50 mmol/L Tris-HCl,pH 8.5。
将初筛晶体在上海同步辐射中心(SSRF,上海)的BL18U1线站进行衍射。结果显示:(1)中的晶体是盐晶,而非蛋白晶体;(2)中的晶体无衍射点,后续对结晶条件进行进一步优化,但未能获得较好衍射的晶体。
2. 4 GS3蛋白C端结构域的表达及纯化结果
将构建的TM+TNFR+VWFC-pET-28b-sumo和TNFR+VWFC-pET-28b-sumo重组蛋白进行大量表达。用Ni2+ beads进行亲和层析,TM+TNFR+VWFC-sum蛋白表达,但sumo标签有断裂脱落情况,TNFR+VWFC- sumo也存在相同的情况(图4)。洗脱下来的蛋白加入Ulp1酶,4 ℃过夜酶切后,蛋白大量沉淀。说明这两个蛋白在有sumo融合蛋白存在的情况下,表达比较稳定;但切掉sumo标签后,蛋白性质发生变化,不稳定且出现沉淀。
2. 5 Gβ全长及截短片段的表达及纯化结果
2. 5. 1 Gβ蛋白全长表达 将构建好的Gβ-pGEX- 6P-1重组蛋白进行大量表达。用GST beads进行亲和层析后,目的蛋白有表达,但形成包涵体。
2. 5. 2 Gβ蛋白结构域的表达 将构建好的GβN-pET- 28b-sumo和GβC-pET-28b-sumo重组蛋白进行大量表达。用Ni2+ beads进行亲和层析后,如图5-B中箭头所示,GβC-sumo目的蛋白表达,但形成包涵体;GβN- sumo有蛋白被洗脱下来,但sumo标签有断裂脱落的情况,推断GβN-sumo蛋白性质也不稳定。
2. 6 Gβ蛋白N端结构域(GβN)与OSR共表达及复合物纯化
2. 6. 1 GβN与OSR共表达 已有研究表明,OSR是通过与Gβ的N端结合形成Gβγ二聚体而行使功能(Pellegrino et al.,1997)。故将OSR-pGEX-6p-1与GβN-pET-28b-sumo转入大肠杆菌BL21(DE3)中共表达。用GST beads进行亲和层析,可看到洗脱液中有2条条带,分别符合OSR-GST(31 kD)和GβN-sumo(26 kD)的理论分子量(图6-A)。将洗脱的样品再过Ni2+ beads亲和层析,再次洗脱下来的样品同样有这2条条带(结果未显示)。在洗脱的样品中,加入Ulp1和3C酶,切除标签。取样进行SDS-PAGE凝胶电泳,如图6-B中显示,4条泳带分别为GST(26 kD)、sumo(17 kD)、GβN(9 kD)和OSR(5 kD)。
综上所述,通过OSR与Gβ的共表达,穿流GST beads时,不带有GST标签额GβN-sumo也可以被捕获;穿流Ni2+ beads时,同样,不带有His标签的OSR也被捕获。这一结果可验证OSR与GβN存在互作。
2. 6. 2 GβN与OSR复合物的纯化 将2.6.1中酶切后的蛋白样品,换Buffer至盐浓度为100 mmol/L的NaCl。4 ℃离心10 min,上样至阴例子交换层析柱Mono Q 5/50(GE Healthcare),结果如图7所示,黑色曲线为A280吸收曲线,图中有3个明显的峰型。收集各峰型的样品进行SDS-PAGE电泳,如图8所示,GβN与OSR的复合物在上样时不挂柱,出峰(图7箭头所示处)。将得到的复合物浓缩至12 mg/mL,进行晶体初筛,但未获得结晶。后续将调整蛋白浓度及结晶温度等,对结晶条件进行优化。
3 讨论
继动物和真菌系统之后,拟南芥和水稻已成为研究G蛋白及其信号系统的重要模式系统(Urano et al.,2013)。植物的G蛋白调控系统和真菌及动物不同,为研究G蛋白的信号和网络构架的进化提供了方向和线索。水稻的谷物粒型与水稻的产量和品质密切相关。前人已克隆获得与水稻粒型相关的基因GS3,从DNA水平证明了GS3蛋白是水稻粒型的负调控因子,但对GS3蛋白的调控机制、作用位点及结合的底物仍了解甚少。对于植物G蛋白的结构及其与动物G蛋白的异同,目前还有待进一步了解。GS3相对于传统的Gγ,多了一端富含半胱氨酸的区域。从GS3的生理功能来看,主要起着调控作用的区域是OSR,而富含半胱氨酸的区域对其可能存在负调控作用。本研究利用原核表达系统,对OSR进行表达,获得蛋白之后进一步除标签纯化,最后得到纯度较高、均一性较好的蛋白用于结晶,为GS3蛋白的结构研究打下了良好的基础。
在已知的异源三聚体G蛋白中,Gβ和Gγ一直作为一个整体来行使功能,Gβ与不同的Gγ结合能够调控不同的生命进程。本研究通过共表达的方法,初步验证了Gβ的N端和OSR存在互作,符合经典的G蛋白三聚体模型。通过阴离子交换层析,将GβN和OSR的复合物与GST和Sumo标签分离,得到了纯度较高且均一性较好的蛋白用于结晶。虽然通过结晶初筛未能获得晶体,但结果已验证了G蛋白异源三聚体结构的高度保守性,为后续的功能验证提供了结构基础。
4 结论
GS3和Gβ互作是通过GS3蛋白N端结构域OSR与Gβ N端结构域的结合而实现,结果符合经典的G蛋白异源三聚体模型。
參考文献:
Botella J R. 2012. Can heterotrimeric G proteins help to feed the world?[J]. Trends in Plant Science,17(10):563-568. Fan C,Xing Y,Mao H,Lu T,Han B,Xu C,Li X,Zhang Q. 2006. GS3,a major QTL for grain length and weight and minor QTL for grain width and thickness in rice,encodes a putative transmembrane protein[J]. Theoretical & Applied Genetics,112(6):1164-1171.
Fukuoka S,Namai H,Okuno K. 1998. RFLP mapping of the genes controlling hybrid breakdown in rice(Oryza sativa L.)[J]. Theoretical & Applied Genetics,97(3):446-449.
Jones J C,Temple B R S,Jones A M,Dohlman H G. 2011. Functional reconstitution of an atypical G protein hete-
rotrimer and regulator of G protein signaling protein(RGS1)from Arabidopsis thaliana[J]. Journal of Biological Chemistry,286(15):13143-13150.
Kovach M J,Sweeney M T,McCouch S R. 2007. New insights into the history of rice domestication[J]. Trends in Genetics,23(11):578-587.
Li J,Xiao J,Grandillo S,Jiang L,Wan Y,Deng Q,Yuan L,McCouch S R. 2004. QTL detection for rice grain quality traits using an interspecific backcross population derived from cultivated Asian(O. sativa L.)and African(O. glaberrima S.)rice[J]. Genome,47(4):697-704.
Mao H,Sun S,Yao J,Wang C,Yu S,Xu C,Li X,Zhang Q. 2010. Linking differential domain functions of the GS3 protein to natural variation of grain size in rice[J]. Proceedings of the National Academy Science of the United States of America,107(45):19579-19584.
Mason M G,Botella J R. 2001. Isolation of a novel g-protein γ-subunit from Arabidopsis thaliana and its interaction with Gβ[J]. Biochimica et Biophysica Acta ,1520(2):147-153.
Pellegrino S,Zhang S,Garritsen A,Simonds W F. 1997. The coiled- coil region of the G protein β subunit[J]. Journal of Biological Chemistry ,272(40):25360-25366.
Takeuchi Y,Abe T,Sasahara T. 2000. RFLP mapping of QTLs influencing shoot regeneration from mature seed-derived Calli in rice[J]. Crop Science,40(1):245-247.
Trusov Y,Rookes J E,Tilbrook K,Chakravorty D,Mason M G,Anderson D,Chen J G,Jones A M,Botella J R. 2007. Hete-
rotrimeric G protein subunits provide functional selectivity in Gβγ dimer signaling in Arabidopsis[J]. Plant Cell,19(4):1235-1250.
Urano D,Chen J G,Botella J R,Jones A M. 2013. Heterotrimeric G protein signalling in the plant kingdom[J]. Open Biology,3(3):142-150.
(责任编辑 王 晖)
