雷贝拉唑钠树脂复合物的制备及评价
2016-05-28陈丽丽安杉杉陈燕忠吕竹芬谢清春
陈丽丽,安杉杉,陈燕忠,吕竹芬,谢清春
(广东药学院药物研究所/广东省药物新剂型重点实验室,广州510006)
雷贝拉唑钠树脂复合物的制备及评价
陈丽丽,安杉杉,陈燕忠*,吕竹芬,谢清春
(广东药学院药物研究所/广东省药物新剂型重点实验室,广州510006)
摘要:目的制备雷贝拉唑钠树脂复合物,探讨其形成机理并考察其稳定性。方法用静态离子交换法制备雷贝拉唑钠树脂复合物,通过正交设计法优化处方制备工艺;通过光学显微镜观察药物树脂复合物的形态外观;通过X-ray衍射分析、差示扫描量热分析以及红外光谱分析探讨药物树脂复合物的形成机理;通过吸湿平衡曲线评价雷贝拉唑钠树脂复合物的防潮性能;通过破坏性实验评价雷贝拉唑钠树脂复合物的耐酸性能。结果优化所得最佳制备工艺:药物初始浓度为1.0 g·L-1,药物树脂质量比为1︰3,溶液介质离子强度为0.001 mol·L-1的氢氧化钠溶液,制备温度为30 ℃。经红外光谱分析、X-ray衍射和DSC分析,药物树脂复合物所载药物是以化学键的形式结合到离子交换树脂上的。雷贝拉唑钠树脂复合物也具有一定的防潮和耐酸性能。结论雷贝拉唑钠树脂复合物是通过化学键形成的,且在一定程度上能够提高药物的稳定性。
关键词:雷贝拉唑钠;离子交换树脂;药物树脂复合物;稳定性
雷贝拉唑钠(rabeprazole sodium,RAB)作为新一代质子泵抑制剂[1],治疗反流食管炎、胃溃疡和十二指肠溃疡有良好的疗效[2-4]。但雷贝拉唑钠对湿、热和光不稳定,尤其是遇酸降解更快[5],因此,研究提高雷贝拉唑钠稳定性的剂型和技术尤为重要。
离子交换树脂(ion exchange resin,IER)分子中含有活性基团,能与其他物质进行离子交换,形成树脂复合物[6],并可进一步制备成混悬剂、透皮制剂和气雾剂等多种递药系统[7]。IER的离子交换能力及微孔吸附能力可被应用于改善药物的理化性质[8-10]。IER通过其离子交换和微孔吸附作用将药物分散在其高分子骨架体系中,避免环境因素对药物的影响。因此,将性质不稳定的药物制备成药物树脂复合物后通常会比药物本身更稳定[11]。
本文采用静态离子交换法,制备了雷贝拉唑钠树脂复合物,考察了其制备的工艺参数,评价了树脂复合物的稳定性。
1仪器与试药
1.1仪器e2695系列高效液相色谱仪(2489 UV
检测器,美国Waters公司);THZ-82型水浴恒温振荡器(江苏省金坛市宏华仪器厂);KQ-300DA型数控超声波清洗器(昆山市超声仪器有限公司);DV130光学显微镜(重庆奥特光学仪器有限公司);FTIR NICOLET 6700型红外光谱测定仪(美国Nicolet公司);DSC4000型热分析仪(美国Perkin Elmer公司);Delsa Nano C粒度测定仪(美国BECKMAN COULTER公司)
1.2试药雷贝拉唑钠(批号RAD20131201,常州康丽制药有限公司);离子交换树脂Duolite AP143(Rohm and Haas,陶氏化学公司);氯化钠、氢氧化钠、氯化镁、溴化钠、硝酸钾等试剂均为分析纯。
2方法与结果
2.1药物树脂复合物的含量测定方法
2.1.1色谱条件以Kromasil 100-5 C18(250 mm×4.6 mm,5 μm) 为色谱柱;流动相为甲醇-磷酸盐缓冲盐(pH值为7.0)= 60∶40混合溶液;检测波长为292 nm;柱温为30 ℃;流速为1 mL·min-1;进样量为10 μL。
2.1.2含量测定方法雷贝拉唑钠:精密称取雷贝拉唑钠10 mg,置于10 mL量瓶中,甲醇:0.05 mol·L-1氢氧化钠溶液(3∶2)溶解并稀释至刻度。精密量取1 mL该溶液置于10 mL量瓶中,用流动相稀释并定容至刻度,用0.22 μm滤膜滤过,精密量取10 μL,注入液相色谱仪。
雷贝拉唑钠树脂复合物:精密称取雷贝拉唑钠树脂复合物适量(约相当于雷贝拉唑钠10 mg),置于100 mL量瓶中,加入1 mol·L-1的氯化钠溶液(用氢氧化钠溶液调至pH值为9)为解离介质,涡旋1 min后,置于100 W下超声30 min,摇匀,移取适量置于10 mL离心管中,以5 000 r·min-1离心5 min,取2 mL上清液,加入0.5 mol·L-1的氢氧化钠溶液2 mL ,用0.22 μm滤膜滤过,精密量取10 μL,注入液相色谱仪。
2.2雷贝拉唑钠复合物的制备精密称取雷贝拉唑钠适量,置于锥形瓶中,加入一定体积0.001 mol·L-1的氢氧化钠溶液适量,搅拌溶解,然后加入适量的离子交换树脂,在一定温度下水浴振荡12 h,静置、滤过,用0.001 mol·L-1的氢氧化钠溶液洗涤滤留物,干燥,即得雷贝拉唑钠树脂复合物。
2.3制备工艺的筛选
2.3.1正交实验设计在单因素考察的基础上可知,影响药物利用率和树脂交换药量的主要因素为药物浓度、药物与树脂质量比(简称药脂比)、氢氧化钠溶液浓度和制备温度,对这4个因素进行考察,每个因素设置3个水平,按照L9(34)正交表进行正交实验,以药物利用率(E)和树脂交换药量(Q)为评价指标,采用加权评分法进行数据分析筛选最佳处方(设E、Q权重系数分别为0.7和0.3)。因素水平见表1,正交实验结果和方差分析见表2~3。
表1正交实验因素与水平
Tab.1 Factors and levels in the orthogonal design

水平因素A,药物质量浓度/g·L-1B,氢氧化钠溶液浓度/mol·L-1C,药脂比D,温度/℃10.250.001 1︰12020.500.010 1︰23031.000.100 1︰340
表2正交实验结果
Tab.2 Results of orthogonal test
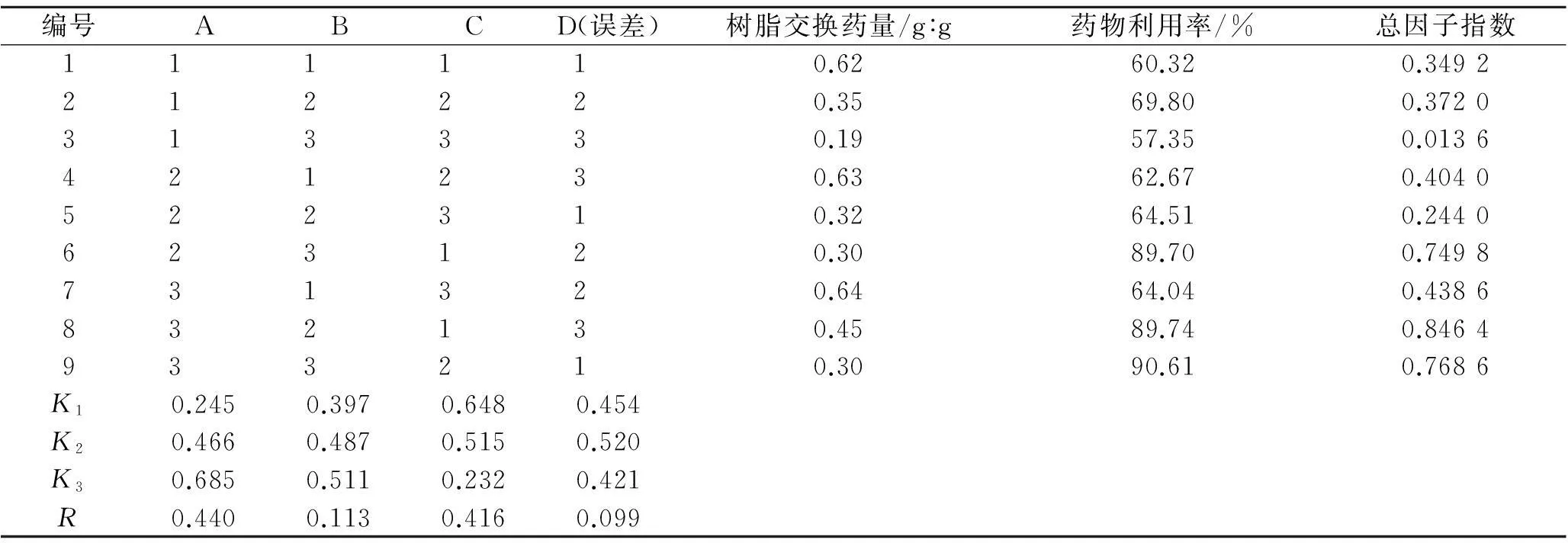
编号ABCD(误差)树脂交换药量/g︰g药物利用率/%总因子指数11 1 1 1 0.6260.320.349221 2 2 2 0.3569.800.372031 3 3 3 0.1957.350.013642 1 2 3 0.6362.670.404052 2 3 1 0.3264.510.244062 3 1 2 0.3089.700.749873 1 3 2 0.6464.040.438683 2 1 3 0.4589.740.846493 3 2 1 0.3090.610.7686K10.2450.3970.6480.454K20.4660.4870.5150.520K30.6850.5110.2320.421R0.4400.1130.4160.099
表3方差分析结果
Tab.3 Results of analysis of variance

因素SSfFF临界值显著性(P)A0.290219.33319.000*B0.02221.46719.000C0.271218.06719.000D(误差)0.01521.00019.000
注:F0.05(2,2)=19。
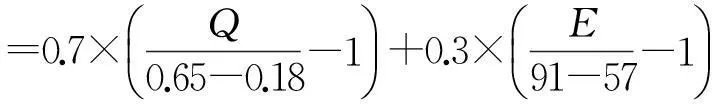
由表2可知,因素A和C是主要影响因素。各因素对药物利用率和树脂交换药量的影响顺序依次是A>C>B>D。由表3可知,A因素对药物利用率和树脂交换药量有显著性影响。优化后的最佳处方工艺为A3B3C1D2,即药物初始质量浓度为1.0 g·L-1,药物与树脂质量比为1︰3,溶液介质离子强度为0.001 mol·L-1的氢氧化钠溶液,制备温度为30 ℃。
2.4药物树脂复合物的表征
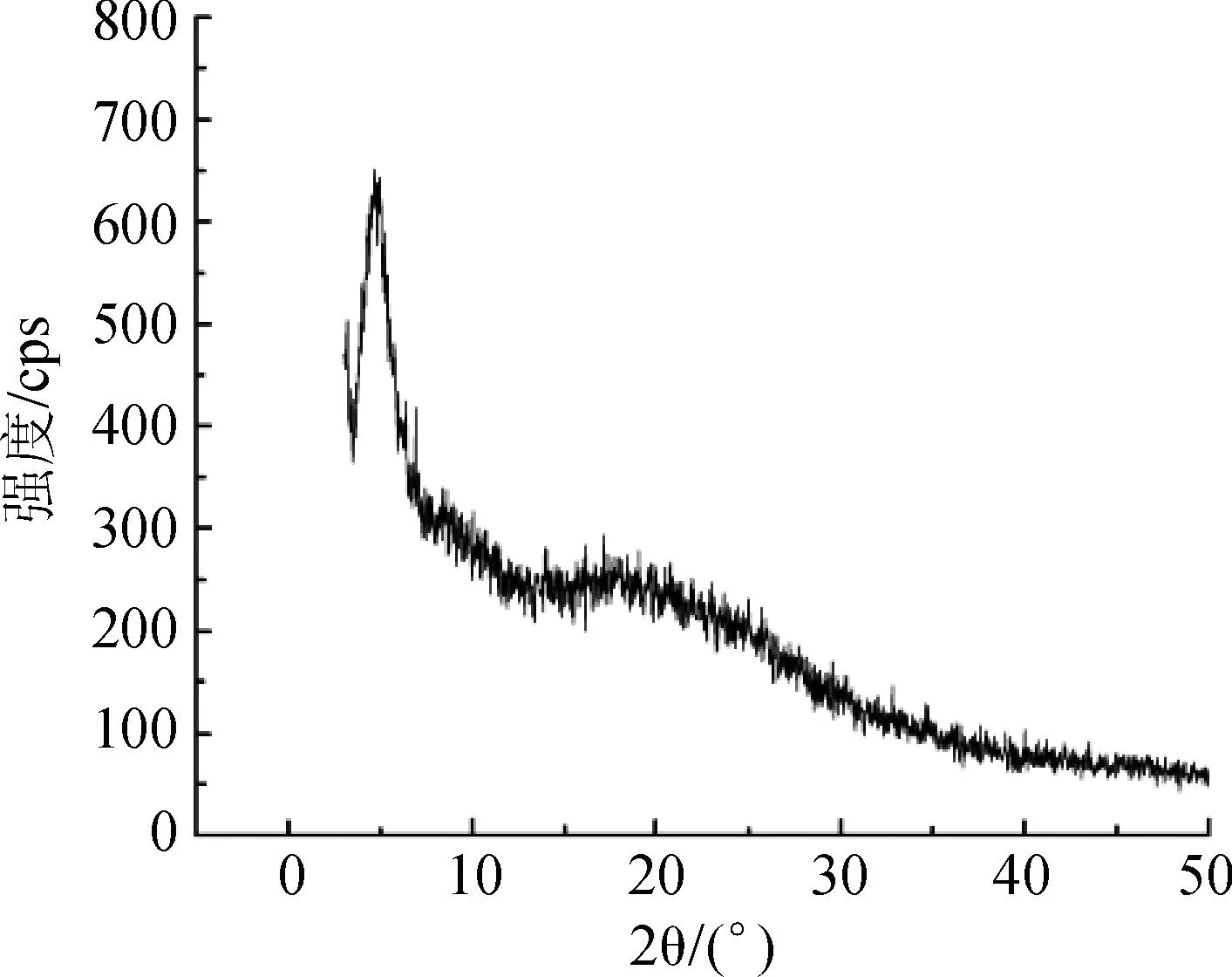
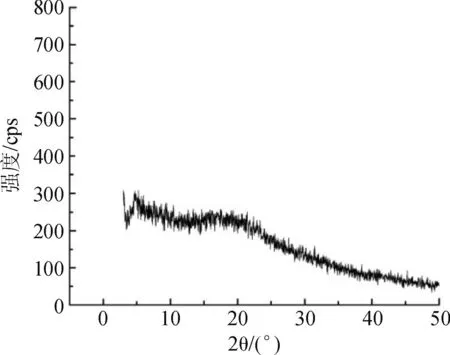
2.4.1雷贝拉唑钠树脂复合物的X-ray衍射分析取雷贝拉唑钠、空白树脂、两者的物理混合物和雷贝拉唑钠树脂复合物适量,分别进行X-ray衍射。分析测试条件:Cu靶,管压为40 kV,管流为50 μmA,狭缝宽度DS=SS=1°,接受狭缝为0.3 mm,扫描范围为2°~50°,扫描速度为3°·min-1,步宽为0.01°。X-ray分析图谱见图1。

A
B
C

D
图1雷贝拉唑钠树脂复合物确证的 X-ray 图谱
A.空白树脂;B.雷贝拉唑钠;C.雷贝拉唑钠树脂物理混合物;D.雷贝拉唑钠树脂复合物
Fig.1X-ray curves of different samples for validation of sodium rabeprazole -resin complex
A.blank resin;B.sodium rabeprazole;C.physical mixture;
D.rabeprazole-resinate complex
由图1可知,雷贝拉唑钠是以结晶形式存在的;物理混合物中雷贝拉唑钠的特征峰仍存在,但强度有所减弱。而雷贝拉唑钠树脂复合物中药物的特征峰消失,表明雷贝拉唑钠是以离子键结合至离子交换树脂上,而不是简单的物理吸附。
2.4.2雷贝拉唑钠树脂复合物的DSC分析取雷贝拉唑钠、空白树脂、两者的物理混合物和雷贝拉唑钠树脂复合物适量,以空白铝皿为对照,升温速率10 ℃·min-1,温度范围为20~200 ℃,分别进行差示扫描量热法分析。见图2。 由图2可知,物理混合的树脂和雷贝拉唑钠的DSC图出现各自的独立吸收峰,而形成药物树脂复合物后,仅出现一个峰,雷贝拉唑钠的吸收峰消失,表明雷贝拉唑钠树脂复合物中的药物是以离子键交换至树脂上,而不是简单的物理吸附。

图2差示扫描热分析图
a.空白树脂;b.雷贝拉唑钠;c.物理混合物;d.雷贝拉唑钠树脂复合物
Fig.2DSC thermograms
a.blank resin;b.sodium rabeprazole;c.physical mixture;
d.sodium rabeprazole-resinate complex
2.4.3雷贝拉唑钠树脂复合物的红外光谱分析取雷贝拉唑钠、空白树脂、两者的物理混合物和雷贝拉唑钠树脂复合物适量,与溴化钾晶体共同研磨后压片,在400~4 000 cm-1范围内扫描图谱。见图3。
由图3可知,在雷贝拉唑钠结构中,746 cm-1是咪唑环上C-H的特征峰。雷贝拉唑钠与树脂结合后,C-H特征峰消失,其他特征峰发生一定的位移和强度减弱,而物理混合物的红外光谱为雷贝拉唑钠与树脂特征峰的简单叠加。空白树脂结构中季铵基在1 020~1 250 cm-1范围内有中等及弱的吸收特征峰,但与雷贝拉唑钠结合后,这些特征峰都发生了一定的位移,而在二者的物理混合物中却无类似变化。以上变化均源于离子交换树脂中季铵基与药物以离子键结合,从而导致红外光谱谱带频率变化或谱带数目的增减。
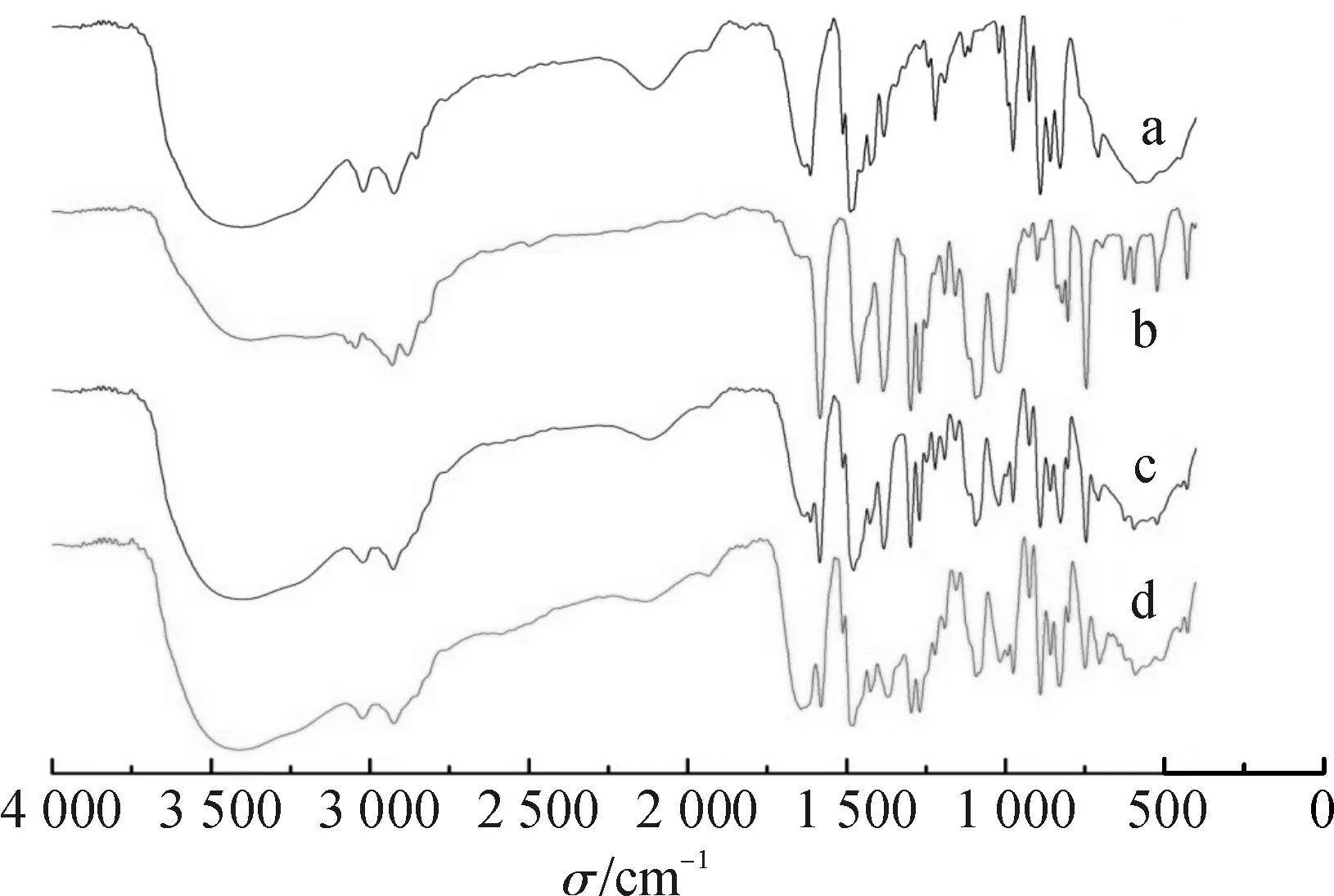
图3红外光谱图
a.空白树脂;b.雷贝拉唑钠;c.物理混合物;d.雷贝拉唑钠树脂复合物
Fig.3Infrared spectrogram
a.blank resin;b.sodium rabeprazole;c.physical mixture;
d.sodium rabeprazole-resinate complex
2.5稳定性研究

从第10天来看,雷贝拉唑钠原料药的吸湿率高达50.7%,而空白树脂和雷贝拉唑钠树脂复合物的吸湿率分别为39.2%和35.7%。结果表明,雷贝拉唑钠原料药容易吸湿,而雷贝拉唑钠树脂复合物吸湿率明显低于雷贝拉唑钠。
2.5.2破坏性实验分别准确称取雷贝拉唑钠原料药5 mg和适量雷贝拉唑钠树脂复合物,置于10 mL量瓶中,分别加入适量盐酸溶液、氢氧化钠溶液和过氧化氢溶液。在20 ℃室温条件下放置0.5 h,加入1 mol·L-1的氯化钠溶液(用氢氧化钠溶液调至pH值为9)至刻度,摇匀,滤过,按照2.1.2项下HPLC法测定含量。结果见表4。
表4破坏性实验结果
Tab.4 The results of destructive test

破坏介质含量/%原料药复合物0.01mol·L-1盐酸溶液18.7878.630.01mol·L-1氢氧化钠溶液99.4999.800.043mol·L-1过氧化氢溶液95.3597.82
由表4可知,雷贝拉唑钠在酸性条件下极不稳定,而雷贝拉唑钠树脂复合物具有一定的耐酸性,可以在一定程度上提高其耐酸性能。
2.5.3影响因素实验称取适量的雷贝拉唑原料药和雷贝拉唑钠树脂复合物各3份,分别平铺于培养皿中,在高温(60 ℃)、高湿(92.5%)和光照(4 500±500 lx)条件下进行实验,在第0,5和10天取样,按照2.1.2项下方法测定药物含量。结果见表5。
表5影响因素实验结果
Tab.5 The results of influence factor test

样品0d含量/%5d含量/%10d含量/%原料药高温实验10099.4398.49光照实验10098.3892.88高湿实验10094.9682.30药物树脂复合物高温实验 10099.7999.12光照实验 10099.6798.24高湿实验 10098.5395.43
由表5可知,雷贝拉唑原料药在光照和高湿条件下含量都有明显下降,而药物树脂复合物在上述条件下都比原料药更为稳定,表明其在一定程度上能提高药物在高湿和光照条件下的稳定性。
2.6雷贝拉唑钠树脂复合物的体外释放取雷贝拉唑钠树脂复合物供试品适量,按照《中国药典》2015年版释放度测定法,采用桨法装置,将0.15 mol·L-1氯化钠溶液(用1 mol·L-1氢氧化钠溶液调至pH 值为7.4)作为释放介质,转速:50 r·min-1,温度:37±0.5 ℃。分别于第10,20,30,40,50,60,90和120 min在各取样点取样5 mL,并及时补充相应体积的释放介质,经0.45 μm微孔滤膜滤过,精密量取续滤液2 mL,加入0.5 mol·L-1的氢氧化钠溶液适量。按照含量测定方法测定样品中雷贝拉唑钠在不同时间的释放量。雷贝拉唑钠树脂复合物在20 min时释放度大于90%。将该体外释放曲线数据用Viswanathan方程进行拟合,其拟合效果良好(r= 0.991 4)。
3讨论
本文采用静态离子交换法制备药物树脂复合物,并以药物利用率和树脂交换药量为评价指标,优选出制备的最佳条件。按照下式计算树脂交换药量Q和药物利用率E。
Q为t时刻单位质量树脂的交换药量(mg·g-1),C0为初始药物质量浓度(mg·mL-1),Ct为t时刻药物质量浓度(g·L-1), V为药物溶液体积(mL),WR为干态树脂质量(g)。
药物树脂复合物的释药行为不仅受释药环境的pH和离子浓度的影响,还受树脂的交联度以及其粒径大小等因素的影响。目前有关药物树脂复合物的释药动力学的研究主要采用指数方程,粒扩散方程(Boyd方程)及对数方程(Viswanathan)[12]。其中,对数方程适合所有药物树脂复合物的体外释药过程,因而被普遍采用:
其中,F为t时间药物从树脂复合物中释放的分数,Q0为0时刻树脂复合物的药物含量(g/g);Qt为t时刻药物树脂复合物中的药物含量(g/g);Dr为药物在树脂中的扩散系数(m2·h-1);dp为树脂平均粒径(m);其中1.59和0.65为常数。
雷贝拉唑钠不稳定,容易受到环境因素(如光照、湿度、pH等)的影响而降解。将其制成药物树脂复合物中间体,雷贝拉唑钠以离子键形式与树脂结合,分散于IER的高分子骨架体系中,减少了其与外界水气键合的机会,从而提高了药物的稳定性[11];将药物树脂复合物进一步制备其他剂型,如混悬剂,由于药物从该类体系中释放必须存在外源离子,当混悬介质中离子浓度较低时,药物就很难被交换下来,从而能够防止药物渗漏,提高混悬剂的稳定性[12]。
参考文献:
[1]杨东林,刘毓梅.质子泵抑制剂临床应用浅析[J].西北药学杂志,2010,25 (4):295-296.
[2]刘波,姚鸿萍.临床常用质子泵抑制剂的研究进展[J].西北药学杂志,2014,29(3):328-332.
[3]盛金峰.雷贝拉唑的研究进展[J].中国药业,2010,19(3):63-64.
[4]肖扬帆.雷贝拉唑钠肠溶微丸片的研究[D] .济南:山东大学,2011.
[5]郭利民,钟世华.高效液相色谱法测定雷贝拉唑钠血药浓度[J].中国医药导报,2008,5(3):29-30.
[6]曾环想.离子交换树脂复合物的药物传递系统与药物动力学研究[D] .沈阳:沈阳药科大学,2008.
[7]车鑫.盐酸奈福泮药物树脂的研究[D].沈阳:沈阳药科大学,2005.
[8]Mehta K,Tu Y H. Modified release formulations containing drug-ion exchange resin complexes: USA,11 /724966[P].2011-11-22.
[9]Hughes L Ion exchange resins unique solutions to formulation problems [J] .Pharm Technol,2004,28(6):20-25.
[10]Khan S N.Therapeutic applications of ion exchange resins [M] .Heidelberg: Springer Science,2012: 149-168.
[11]Hansson H. Physically and chemically stable nicotine-containing particulate material: USA,10 /742580[P].2004-09-30.
[12]吴静.双氯芬酸钠药物树脂液体缓释制剂的研究[D].沈阳:沈阳药科大学,2007.
Preparation and evaluation of sodium rabeprazole-resinate complex
CHEN Lili,AN Shanshan,CHEN Yanzhong*,LÜ Zhufen,XIE Qingchun
(Institute of Material Medica/Guangdong Provincial Key Laboratory of Advanced Drug Delivery,Guangdong Pharmaceutical College, Guangzhou 510006,China)
Abstract:ObjectiveTo confirm the formation mechanism of the sodium rabeprazole-resinate complex,and assess its stability. Methods The sodium rabeprazole-resinate complex was prepared by using ion exchange resin (IER) as a carrier,and the formulations were optimized by an orthogonal design. The sodium rabeprazole-resinate complex was characterized by morphology which was observed using an optical microscope. X-ray diffraction,differential scanning calorimetry and FTIR were employed to confirm the formation mechanism of the sodium rabeprazole-resinate complex. Under different humidity environments, the moisture proof capability of the sodium rabeprazole-resinate complex was investigated. Under the conditions of different acid and alkali,the acid resistance of the sodium rabeprazole-resinate complex was investigated. Result The drug concentration that prepared the sodium rabeprazole-resinate complex was 1.0 g·L-1,and the ratio of drug and resin was 1︰3. The ion strength of NaOH was 0.001 mol·L-1,and the preparation temperature was 30 ℃. By X-ray diffraction analysis, differential scanning calorimetry and FTIR,the drug in sodium rabeprazole-resinate complex was combined with ion-exchange resins by chemical bond. The moisture absorption-liquefaction problem of sodium rabeprazole was alleviated to some extent. Conclusion The drug in sodium rabeprazole-resinate complex was combined with ion-exchange resins by chemical bond,and the stability of sodium rabeprazole was alleviated.
Key words:sodium rabeprazole;ion exchange resin;drug-resinate complex;stability
(收稿日期:2015-11-28)
中图分类号:R944.9
文献标志码:A
文章编号:1004-2407(2016)03-0297-06
doi:10.3969/j.issn.1004-2407.2016.03.023
*通信作者:陈燕忠,男,博士,教授
作者简介:陈丽丽,女,硕士研究生
