G/TiO2/CoFe2O4磁性复合光催化材料的制备及光催化降解亚甲基蓝
2016-05-27毛蜜周建刚何瑜葛伊丽宋功武
毛蜜,周建刚,何瑜,葛伊丽,宋功武
(有机功能分子合成与应用教育部重点实验室(湖北大学),有机化工新材料湖北省协同创新中心(湖北大学),湖北 武汉 430062)
G/TiO2/CoFe2O4磁性复合光催化材料的制备及光催化降解亚甲基蓝
毛蜜,周建刚,何瑜,葛伊丽,宋功武
(有机功能分子合成与应用教育部重点实验室(湖北大学),有机化工新材料湖北省协同创新中心(湖北大学),湖北 武汉 430062)
摘要:以天然鳞片石墨为原料,用改进的Hummers法氧化制备氧化石墨烯;以FeCl2,FeCl3为原料,用共沉淀法合成CoFe2O4;再用一步水热合成法制备G/TiO2/CoFe2O4三元纳米复合材料.用FT-IR、XRD、AFM、TEM对氧化石墨烯和G/TiO2/CoFe2O4复合材料进行表征,并在紫外光照下对比G/TiO2,TiO2/CoFe2O4,G/TiO2/CoFe2O4复合材料对亚甲基蓝的降解效果.结果表明,在紫外光照射下,G/TiO2/CoFe2O4复合材料光催化降解亚甲基蓝的催化效率明显大于单纯G/TiO2,TiO2/CoFe2O4,光催化40 min后,脱色率达90%.G/TiO2/CoFe2O4复合材料不失为一种有潜力的光催化降解染料废水催化材料.
关键词:氧化石墨烯;二氧化钛;钴铁氧体;复合材料;光催化;亚甲基蓝降解
0引言
随着印染工业的迅速发展,染料废水已成为当前水体污染主要的污染源之一.光催化降解这些污染物是目前材料科学及环境工程科研人员关注的热点之一[1].在众多的光催化剂中,TiO2因其具有稳定的化学性质、较好的耐酸碱性、成本低、对环境无污染等特性,而成为最佳的光催化材料之一[2-4].但TiO2是一种宽带隙半导体(3.2 eV)只能吸收占太阳光谱大约4%的紫外辐射(=387.5 nm);另外光激发TiO2所产生的光生电子一空穴复合率高,导致光量子效率低,光催化性能不突出,这也是半导体类光催化剂在实际应用中受到限制的主要原因.为了解决上面的问题,对TiO2进行金属阳离子掺杂、贵金属修饰、半导体复合、有机染料分子或者窄带隙半导体敏化以及表面还原处理等方法,可以引入杂质或缺陷,使半导体的禁带内尝试施主能级从而改善TiO2半导体材料其光催化活性[5-8].其中,非金属C掺杂离子进入锐钛矿型TiO2晶格,占据氧位置,或成为间隙离子,降低带隙宽度,或形成杂质能级,使掺杂后TiO2的光吸收扩展至可见光区域.而石墨烯是一种由碳原子堆积构成的二维晶体材料,具有比碳纳米管更为优异的电学性质,以及良好的导电性和化学稳定性[9-10],是近几年来化学,材料科学及物理学领域的研究热点之一.通过对复合材料应用作为研究对象和领域有助于深入了解石墨烯特殊的二维晶体结构与优异的特殊性能之间的关系,对于氧化石墨烯广泛应用具有重要的学术科研价值和商业应用前景.
另一方面,因为TiO2粉末颗粒细小,造成回收困难,而易随水流失造成浪费及环境的二次污染,这种悬浮光催化体系中光催化剂的分离回收再利用问题也就成为制约其实际应用的重要因素.因此,研发易于分离再利用的高活性光催化剂材料成为目前的研究热点.近年来出现的采用超顺磁性和耐腐蚀的铁磁性颗粒作为载体,研制的磁性悬浮负载型光催化剂,既具备悬浮相光催化剂的高比表面积和高传质效率的特点,同时又可利用其磁性加以回收再利用,应用前景十分广阔.可作磁性材料的物质有很多,如Ni、Fe、Co、Fe2O3、Fe3O4、Co3O4、NiFe2O4、MnFe2O4、CoFe2O4等.由TiO2与Fe2O3、Fe3O4、NiFe2O4、MnFe2O4等磁性材料形成的复合光催化剂已相继被报道[11-16].但对具有高饱和磁性强度、高矫顽力、高的磁晶各项异化和化学稳定性等优点的钴铁氧体CoFe2O4与TiO2的复合材料鲜有报道.
故本工作以磁性纳米CoFe2O4为核,以钛酸四丁酯为原理,以氧化石墨烯为载体,采用一步水热合成法制备出高矫顽力和高催化性能的磁性G/TiO2/CoFe2O4三元纳米复合材料.研究该复合物在紫外光及可见光下对亚甲基蓝(MB)溶液的光催化降解性能,并与TiO2半导体材料的光催化活性进行比较分析.
1实验部分
1.1实验仪器D/max-IIIC X线衍射仪(岛津制作所);红外分光光度计(Perkin-Elmer,美国);Nanoscope NanoscopeⅢa 扫描探针显微镜;λ-17型紫外-可见分光光度计(Perkin Elmer,美国);PHS-型数字式酸度计(杭州雷磁分析仪器厂);KQ-100DE型数控超声波清洗器(昆山市超声仪器有限公司);79-1型磁力加热搅拌器(江苏姜堰市天力医疗器械有限公司);DHG-9240A型电热鼓风干燥箱(上海一恒科学仪器有限公司).
1.2实验试剂石墨粉;硝酸钠;浓硫酸;高锰酸钾;过氧化氢;盐酸;碳酸钠;乙二醇;钛酸四丁酯;氯化钴;氯化铁;醋酸钠;聚醚酰亚胺等,所用试剂均为分析纯,实验用水均为二次去离子水.
1.3实验方法
1.3.1GO的制备1) 由石墨制备氧化石墨:将1.0 g石墨、0.5 g硝酸钠与23 mL的质量浓度98%的浓硫酸混合搅拌,加入3.0 g KMnO4,冰水浴反应2 h,将其转移至35 ℃水浴逐步加入50 mLH2O反应0.5 h,升温至98 ℃继续反应0.5 h,反应物由棕褐色变成亮黄色;进一步加85 mL水稀释,并用4 mL质量浓度为30%的H2O2中和过量的KMnO4;将上述溶液趁热抽滤,滤饼用质量浓度为5% HCl溶液中洗涤,再将其放入透析袋中,透析至中性,将透析产物放入80 ℃烘箱中干燥待用.
2) 用超声剥离法将氧化石墨制备氧化石墨烯:将100 mg氧化石墨溶于30 mL H2O中,用功率为100 W的超声处理5 h至澄清,得到氧化石墨烯的分散液.
1.3.2CoFe2O4的制备将1.35 g FeCl3·6H2O、0.595 g CoCl2·6H2O置于35 mL乙二醇中,室温搅拌0.5 h,加入3.6 g NaAc,1.1 g PEI,室温搅拌0.5 h,将混合溶液置于50 mL聚乙烯内胆的反应釜中,200 ℃并反应10 h,反应完成后用去离子水清洗3次,分离收集CoFe2O4并放入80 ℃烘箱中干燥待用.
1.3.3G/TiO2/CoFe2O4的制备将25 mg氧化石墨烯溶于30 mL 乙二醇中,用功率为100 W的超声处理4 h至澄清,得到氧化石墨烯的分散液,加入80 mg CoFe2O4磁性纳米微粒,用功率为100 W的超声处理5 min,室温搅拌0.5 h,加入2.5 mL钛酸四丁酯,室温搅拌0.5 h,滴加1 mL H2O,室温搅拌0.5 h,将混合溶液置于50 mL聚乙烯内胆的反应釜中,180 ℃并反应8 h,反应完成后用去离子水清洗3次,分离收集G/TiO2/CoFe2O4并放入80 ℃烘箱中干燥得到G/TiO2/CoFe2O4光催化磁性纳米复合材料.
2结果与讨论
2.1XRD分析利用天然石墨粉根据Hummers法可制得氧化石墨[17].图1(A)为天然石墨粉(NG)以及所制得的氧化石墨(GO)的XRD图.由图1(A)可以看出,石墨粉的XRD图在26.52°处出现了(002)的特征衍射峰.经氧化后.石墨的(002)的特征衍射峰消失,在10.94°处出现了GO的(001)的特征衍射峰.这表明石墨粉几乎全部被氧化成GO.图1(B)为CoFe2O4(a)和G/TiO2/CoFe2O4(b)复合光催化剂的XRD图.由图1(B-a)可以看出,合成的CoFe2O4纳米颗粒已出现主强峰(311)和次强峰(440),且各衍射峰分别对应于标准JCPDSP卡片No.22-1086尖晶石型CoFe2O4的特征峰,说明制得的磁核样品是尖晶石型CoFe2O4.图1(B-b)是G/TiO2/CoFe2O4复合光催化剂的XRD图,对照PDF卡片可看出,所制得的G/TiO2/CoFe2O4复合材料中的TiO2为锐钛矿晶型,在25.2°出现锐钛矿TiO2的(101)晶面衍射峰.其图1(B-b) 中(220)、(311) 、(400) 、(422) 、(511) 、(440)等峰分别对应标准JCPDSP卡片No.22-1086尖晶石型CoFe2O4的特征峰,说明所制得的G/TiO2/CoFe2O4复合材料中CoFe2O4为尖晶石型.同时,在G/TiO2/CoFe2O4复合光催化剂的XRD图中没有出现G的衍射峰,这可能是由于衍射峰重叠的原因,文献中也有这方面的报导[18].

图1 天然石墨NG,氧化石墨GO(A)以及CoFe2O4(B-a)和G/TiO2/CoFe2O4(B-b)的

2.3磁性能分析图3为所制备的CoFe2O4(A),G/TiO2/CoFe2O4(B)复合光催化剂的磁性能曲线.从图3(A)中可以看出,在最大磁化场强下,CoFe2O4的饱和磁化强度为75 emu/g.图3(B)为不同配比的原料合成的G/TiO2/CoFe2O4复合光催化剂的磁性能曲线,我们所选择的G(25 mg)/TiO2/CoFe2O4的饱和磁化强度为三者中的最大饱和磁化强度.磁化过程中G/TiO2/CoFe2O4复合光催化剂基本没有磁滞现象,矫顽力和剩磁几乎可以忽略,这说明制备的光催化剂具有超顺磁性,即当外加磁场强度降到零时,所制备粒子的剩磁也几乎降到零.因此,在无外加磁场作用下,催化剂能够很容易地分散在反应体系中,当赋予悬浆反应体系外加磁场时,能够方便地回收催化剂.

图2 氧化石墨(A)、CoFe2O4(B,C)和G/TiO2/CoFe2O4(D,E,F)的

图3 CoFe2O4(A),G/TiO2/CoFe2O4(B)的磁性能曲
2.4光催化性能分析
2.4.1光催化条件最优化图4(A)为染料初始浓度对催化剂降解亚甲基蓝效果的影响.结果如图4(A)所示,随着MB初始浓度的增大,光降解率明显降低.这是因为在光强、光照时间以及催化剂浓度不变的情况下,TiO2表面受紫外光照射激发而产生的羟自由基(·OH)的数目是一定的.浓度越大,反应物分子越多,受到·OH攻击的几率就会越小;另外,当催化剂的比表面积一定,增大MB浓度时,吸附在催化剂表面的有机物的浓度必然降低,从而导致脱色率降低,且当某种有机物具有较强的紫外吸收时,有机物浓度越高屏蔽掉的紫外光也越多,这也会在一定程度上降低光催化效率.
图4(B)为催化剂投加量对催化剂降解亚甲基蓝效果的影响.实验结果如图4(B)所示,在一定范围内,亚甲基蓝的脱色率随着催化剂用量的增加而增大.当用量达到0.8 g/L时,降解率基本趋于平缓.究其原因是随着催化剂用量的增加,负载于载体上TiO2的浓度越大,通过紫外光激发后产生的·OH更多,·OH数量的增加能增强其同亚甲基蓝分子的接触几率,从而提高亚甲基蓝分子被氧化的几率.但过多的催化剂的加入也会屏蔽紫外光,降低光的透过率,从而使得随着催化剂投加量增加,降解率基本趋于平缓.
图4(C)为pH值对催化剂降解亚甲基蓝效果的影响.结果如图4(C)所示,催化剂吸附并光降解亚甲基蓝的效率首先随着溶液pH值的增大基本保持不变.
图4(D)为光照时间对催化剂降解亚甲基蓝效果的影响.由图可知,在其他条件不变的情况下,随着光照时间的延长,亚甲基蓝的降解率明显提高,表明亚甲基蓝不断被降解;但当光照时间达到20 min后,再继续延长光照时间,其降解率并没有提高,说明降解率已稳定处于高水平.
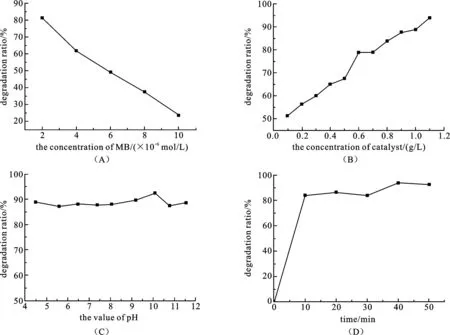
图4 染料初始浓度(A),催化剂投加量(B),pH值(C),光照时间(D)对催化剂降解亚甲基蓝效果的影
2.4.2光催化性能图5(A)为不同光催化降解体系对亚甲基蓝染料脱色率的影响.由图5(A-d)可以看出,在没有加任何催化剂,而仅仅是在紫外灯照射的条件下,亚甲基蓝的脱色率在50 min后仅仅只达到8%左右,这说明在没有催化剂作用下,紫外光对亚甲基蓝的降解作用在本实验中是可以忽略的.由图5(A)可以发现催化降解效果依次为G/TiO2/CoFe2O4(A-a)、G/TiO2(A-b)、TiO2/CoFe2O4(A-c)、空白(A-d).我们推测出现这种现象的原因是:在紫外光激发下TiO2,能形成电子一空穴对,表面与吸附在表面上的物质发生氧化还原反应.由于G/TiO2/CoFe2O4是负载于石墨烯的层间上的,石墨烯材料作为载体具有良好的电子传导性,故TiO2激发产生的电子可以通过石墨烯快速传导,进而有效地提高了光催化活性.同时多孔隙的石墨烯载体的孔道还很好地抑制了TiO2晶粒的生长,这样复合材料中的TiO2可形成较小的晶粒,从而提高了对亚甲基蓝的吸附.另外,G/TiO2/CoFe2O4还具有较高比表面积和孔间相通的三维结构,有利于物质流通,可使降解后的污染物快速脱附,保证了降解反应顺利进行.
图5(B)为复合光催化材料的回收利用图.将复合光催化材料用磁铁分离回收、水洗之后,用于亚甲基蓝染料的降解,其降解效果如图5(B)所示.由图可知,G/TiO2/CoFe2O4复合材料在循环使用4次之后,对亚甲基蓝仍有较高的降解率,表明制备的G/TiO2/CoFe2O4复合光催化材料具备较高的重复利用率和较好的可再生性.
3结论
采用一步水热法制备G/TiO2/CoFe2O4复合物,TEM结果表明,TiO2,CoFe2O4颗粒均匀负载于石墨烯薄片上.以MB水溶液模拟染料废水,以G/TiO2/CoFe2O4复合物为光催化剂研究了其在紫外光下对于MB的光催化降解效果,结果表明,催化降解效果依次为G/TiO2/CoFe2O4、G/TiO2、TiO2/CoFe2O4、空白样.即石墨烯负载了TiO2后,G/TiO2/CoFe2O4催化效率最高,光催化50 min后,脱色率达90%,复合材料中的石墨烯可以传导光照TiO2产生的电子,提高电子空穴对的分离效率,从而提高紫外光下G/TiO2/CoFe2O4复合材料对亚甲基蓝的分解性.同时钴铁氧体CoFe2O4有效解决了悬浮光催化体系中光催化剂的分离回收再利用问题.对复合光催化材料的回收利用的研究表明制备的G/TiO2/CoFe2O4复合光催化材料具备较高的重复利用率和较好的可再生性.
4参考文献
[1] Hofmann M R,Martin S T,Choi W Y,et a1.Environmental applications of semiconductor photocatalysis[J].Chem Rev,1995,95:69-96.
[2] Legrini O Oliveros,Oliveros E,Braun A M.Photochemical processes for water treatment[J].Chem Rev,1993,93:671-698.
[3] Fox M A,Dulay M T.Heterogenous photocatalysis[J].Chem Rev,1993,93:341-357.
[4] Hagfeldt A,Gratzel M.Light-induced redox reactions innanocrystalline systems[J].Chem Rev,1995,95(1):49-68.
[5] Xin B F,Jing L Q,Ren Z Y,et a1.Effects of simultane0usly doped and deposited Ag on the photocatalytic activity and surface states TiO2[J].J Phys Chem B,2005,109(23):2805-2809.
[6] Sakthivel S,Shankar M V,Palanichamy M.Enhancement of photocatalytic activity by metal deposition:characterisation and photonic efficiency of Pt,Au and Pd deposited on TiO2catalyst[J].Water Research,2004,38(13):3001-3008.
[7] Kyeong Y J,Seung B P.Photoactity of SiO2/TiO2and ZrO2/TiO2mixed oxides prepared by sol-gel method[J].Mater Lett,2004,58(22/23):2897-2900.
[8] Chatterjee D,Mahata A.Evidence of superoxide radical formation in the photodegradation of pesticide on the dye modified TiO2surface using visible light[J].J Photochem Photobiol,2004,165(1/3):19-23.
[9] YANG Yonggang,CHEN Chengmeng,WEN Yuefang,et a1.Oxidized graphene and graphene based polymer composites[J].New Carbon Mater,2008,23(3):193-200.
[10] 黄桂荣,陈建.石墨烯的合成与应用[J].炭素技术,2009,28(1):35-39.
[11] WANG Songwei,XU Shengming,CHEN Songzhe,et al.Preparation and characterization of TiO2/SiO2/gamma-Fe2O3-SiO2magnetic photocatalyst[J].Chinese J Catal,2005,26(11):938-940.
[12] CHEN Jinyuan,PENG Tuzhi.Preparation and properties of a magnetic-nanometer TiO2/Fe3O4Composite Photocatalyst[J].Acta Chimica,2004,62(20):2093-2097.
[13] Chung Y S,Park S B,Kang D W.Magnetically separabletitania-coated nickel ferrite photocatalyst[J].Chem Phys,2004,86(2/3):375-381.
[14] FU Wuyou,YANG Haibin,LIU Bingbing,et al.Preparation and photocatalytic property ofanatase TiO2/ MnFe2O4core-shell structure nanoparticles[J].Acta Composite Material Sinica,2007,24(3):136-140.
[15] XU Shihong,FENG Daolun,LI Dengxin,et al.Magnetically separable TiO2:preparation and photocatalytic properties[J].Chinese J Inorg Chem,2008,24(5):785-790.
[16] BAO Shujuan,ZHANG Xiaogang,LIU Xianming.Preparation and photocatalytic activity of TiO2/SiO2/Ni0.5Fe2.5O4 magneticphotocatalyst[J].Chinese J Inorg Chem,2003,19(9):925-928.
[17] Hummers W,Offeman R E.Preparation of graphene oxide[J].J Am Chem Soc,1958,80(6):1339-1339.
[18] Wang D H,Choi D W,Li J,et a1.Enhanced high-temperature long-term stability of polymer solar cells with a thermally stabletiOx interlayer[J].ACS Nano,2009,3(4):907-914.
[19] Paek S M,Yoo E J,Honma I.Enhanced cyclic performance and lithium storage capacity of snO2/graphene nanoporous electrodes with three-dimensionally delaminated flexible structure[J].Nano Lett,2009,9(1):72-75.
[20] McAllister M J,Li J L,Adamson D H,et a1.Single sheet functionalized graphene by oxidation and thermal expansion of graphite[J].Chem Mater,2007,19(18):4396-4404.
[21] Kovtyukhova N I,Ollivier P J,Martin B R,et a1.Layer-by-layer assembly of ultrathin composite films from micron-sized graphite oxide sheets and polycations[J].Chem Mater,1999,11(3):771-778.
(责任编辑胡小洋)
The preparation of G/TiO2/CoFe2O4magnetic composite photocatalyticmaterials and its application in photocatalytic degradation of methylene blue
MAO Mi,ZHOU Jiangang,HE Yu,GE Yili,SONG Gongwu
(Ministry of Education Key laboratory for the Synthesis and Application of Organic Functional Molecules(Hubei University),Hubei Collaborative Innovation Center for Advanced Organic Chemical Materials(Hubei University), Wuhan 430062,China)
Abstract:Graphene oxide (GO) was synthesized from natural flake graphite via a modified Hummers method.G/TiO2/CoFe2O4ternary nanocomposite was synthesized from CoFe2O4 via hydrothermal method,while CoFe2O4 was synthesized from FeCl2 and FeCl3 via coprecipitation method.The synthetic production (GO and G/TiO2/CoFe2O4composite materials) was characterized by using FT-IR,XRD,AFM,TEM.Then compared the effect on the degradation of methylene blue under the condition of UV irradiation among G/TiO2,TiO2/CoFe2O4,G/CoFe2O4/TiO2 composite materials.After catalyzing 40 min,the decolorization rate could reach up to 90%.The result suggests that the catalytic efficiency of photocatalytic degradation of methylene blue by G/CoFe2O4/TiO2 composite material is significantly greater than by pure G/TiO2 and TiO2/CoFe2O4.Therefore,G/CoFe2O4/TiO2 composite material shows more opportunities for application in photocatalytic degradation of dye wastewater.
Key words:graphene oxid(GO); titanium dioxide; cobalt ferrite; composite materials; photocatalytic; degradation of methylene blue
中图分类号:O643.3
文献标志码:A
DOI:10.3969/j.issn.1000-2375.2016.03.005
文章编号:1000-2375(2016)03-0195-06
作者简介:毛蜜(1992-),女,硕士生;宋功武,通信作者,教授,E-mail:songgw@hubu.edu.cn
基金项目:湖北省教育厅科学研究基金(Q20110010)资助
收稿日期:2015-11-04
