无标记定量蛋白质组学分析AMACR过表达对肝癌细胞生物学行为的影响
2016-05-27夏江宝邢晓华王英超沈佐君
夏江宝, 邢晓华, 王英超, 沈佐君
(1. 蚌埠医学院医学检验系, 安徽 蚌埠 233030; 2. 福建省联合创新重点实验室, 福建医科大学孟超肝胆医院, 福建 福州 350025; 3. 安徽医科大学附属省立医院, 安徽省临床检验中心, 安徽 合肥 230001)
无标记定量蛋白质组学分析AMACR过表达对肝癌细胞生物学行为的影响
夏江宝1, 2, 邢晓华2, 王英超2, 沈佐君3
(1. 蚌埠医学院医学检验系, 安徽 蚌埠233030; 2. 福建省联合创新重点实验室, 福建医科大学孟超肝胆医院, 福建 福州350025; 3. 安徽医科大学附属省立医院, 安徽省临床检验中心, 安徽 合肥230001)
摘要:研究α-甲酰基辅酶A消旋酶(AMACR)过表达对肝癌细胞生物学行为的影响及其分子机制. 首先建立AMACR稳定过表达细胞株, 然后提取AMACR过表达细胞株的全蛋白, 进行无标记定量蛋白质组学研究, 最后对鉴定结果进行生物信息学分析和结果验证, 共筛选出138种差异表达蛋白. 这些差异表达蛋白主要参与代谢加工、 细胞加工等, 证明AMACR的过表达对于肝癌细胞的生物学行为影响巨大. IPA分析发现, 这些差异表达蛋白主要参与了ERK1/2信号通路和NF-κB信号通路. 以上结果说明, AMACR的过表达通过调节ERK1/2和NF-κB信号通路等手段改变肝癌细胞的生物学行为.
关键词:肝细胞癌; α-甲酰基辅酶A消旋酶; 细胞增殖; 无标记定量蛋白质组学
0引言
肝细胞癌(hepatocellular carcinoma, HCC, 简称肝癌)是消化系统中常见的恶性肿瘤之一, 其发病率呈逐年上升的趋势. 目前肝癌的治疗仍以手术切除为首选, 局部化疗、 介入治疗、 射频消融治疗、 免疫治疗甚至肝移植等多种方式被广泛应用, 但肝癌病人的远期生存率仍不够理想. 肝癌具有增殖速度快的特点, 以致于出现临床症状并且被诊断时肝癌通常处于中晚期. 因此持续、 深入研究肝癌的发生、 发展是早日攻克肝癌这一顽疾的必经之路.
α-甲酰基辅酶A消旋酶(AMACR)是一种由P504S基因编码的包含382个氨基酸的胞浆蛋白, 存在于人类的线粒体和过氧化物酶体中, 在侧链脂肪酸及脂肪酸衍生物的β氧化和胆酸代谢中间产物的氧化中发挥重要作用[1]. 在前列腺癌的研究中, AMACR作为重要的愈后诊断因子被广泛接受. 除前列腺癌外, 在其他恶性肿瘤中AMACR同样存在过表达现象, 如在胃肠道间质瘤中, AMACR基因的表达量增加可增强细胞增殖, 增加肿瘤侵袭性[2]. 黄新辉等[3]发现AMACR同样过表达于巨大肝癌的组织样品中, 后续研究证实AMACR同样可以作为肝癌的愈后指标. AMACR的过表达被证实与癌症的发生、 发展有密切的关系, 例如AMACR的过表达促进粘液纤维肉瘤的增长. 当抑制AMACR在前列腺癌和粘液纤维肉瘤中的表达时, 发现癌细胞的增殖同样受到了抑制, 同时, PI3K/AKT信号通路以及细胞凋亡和细胞周期(包括cyclin D1, cyclin T2)均受到了影响[4]. 综上所述, AMACR的高表达对肿瘤的增殖具有积极的促进作用, 但这一结论在肝癌中尚未被证实.
蛋白质组学作为后基因组时代的一个非常重要的领域, 在生物系统及疾病和医疗领域起到非常重要的作用. 研究和分析差异蛋白便于人们更好地理解疾病发病机制、 筛选生物靶标等. 无标记定量蛋白质组学方法与标记定量蛋白质组学方法相比具有样品制备简单、 成本低廉、 数据分析便捷等优点, 同时无标记定量方法与基于标记的定量方法可达到相似的准确度[5]. 应用无标记定量蛋白质组学的方法比较分析AMACR过表达对细胞的改造作用, 在蛋白组水平上阐释AMACR促进肝癌细胞生长、 增殖的分子机制.
1材料与方法
1.1材料及试剂
人肝癌细胞株HepG2购自ATCC; AMACR慢病毒表达载体由本实验室人员构建, 该载体在过表达AMACR的同时还表达有绿色荧光蛋白, 经测序分析质粒完全正确; AMACR抗体购自abcam公司; 质谱仪为Thermo公司的LTQ系列; 蛋白提取液配方包含: 8 mol·L-1尿素, 50 mmol·L-1NH4HCO3, 50 mmol·L-1的碘乙酰胺和cocktail 蛋白酶抑制剂; 酶解液为含有100 ng·μL-1胰酶、 50 mmol·L-1NH4HCO3和50 g·L-1乙腈的水溶液.
1.2方法1.2.1慢病毒的包装
接种1×107个293T细胞, 待细胞汇合度达70%~80%时(约24 h), 更换为Opti-MEM培养基, 并使用Lipofectamine 3000进行转染, 实验步骤参照厂家说明书. 收集24 h和48 h的细胞上清液, 4 ℃、 2 000g离心10 min, 然后将上清液用0.45 μm的滤器过滤, 分装并于-80 ℃保存.
1.2.2AMACR过表达肝癌细胞株构建
接种 5×105个细胞, 培养24 h后, 利用AMACR过表达慢病毒(pAMACR)和空白对照慢病毒(按照病毒 ∶细胞=10 ∶1的比例)感染HepG2细胞. Polybrene(5 μg·mL-1) 作为感染增强剂, 在感染的同时加入. 24 h后更换培养基, 48 h后加入2 μg·mL-1的嘌呤霉素筛选, 此后以1 μg·mL-1的嘌呤霉素维持培养.
1.2.3蛋白样品的制备及酶解
细胞经PBS冲洗3次后, 使用500 μL细胞裂解液抽提蛋白, 然后用细胞刮刀回收提取液, 超声破碎细胞, 条件为: 超声1 s, 停5 s, 共8 min. 离心取上清液. 往蛋白提取液中加入DTT至终浓度为8 mmol·L-1, 55 ℃加热25 min, 室温冷却后加IAA至终浓度为50 mmol·L-1, 避光反应30 min. BCA法测定蛋白浓度, 操作按照仪器公司说明书进行. 取30 μg蛋白样品进行SDS-PAGE凝胶电泳, 检测蛋白提取质量.
将200 μg蛋白加入超滤管中, 离心至残留体积为20 μL左右. 加入400 μL、 50 mmol·L-1NH4HCO3, 离心后弃滤液, 将滤膜放入新的EP管中, 加入酶解液, 37 ℃摇床过夜. 加入5%(体积分数)的TFA终止消化, 再加100 μL、 50 mmol·L-1NH4HCO3离心至残留体积约为20 μL. 将滤液混合均匀, 取5 μg至PCR管, 蒸干用于检测样品质量. 其余滤液用低温浓缩仪浓缩, 至体积小于100 μL时转移至PCR管, 蒸干用于质谱检测.
1.2.4高pH值反相分离肽段
冻干的肽段样品复溶于A缓冲液中(A缓冲液: 50 g·L-1乙腈, 0.1%甲酸(体积分数)的水溶液, pH值用NH4HCO3调至10.0). 肽段的第一维分离使用的HPLC系统是Agilent 1260 Infinity system, 选用高pH值反向层析柱(Durashell C18, 5 μm, 4.6 mm×250 mm, Bonna-Agela Technologies)进行分离.
1.2.5低pH值 nano色谱分离及串联质谱分析
每一个组分的样品, 首先经filter过滤, 再在trap柱中富集除盐后以300 nL·min-1的流速经过Acclaim PepMap C18, 75 μm×15 cm 分析柱分离样品. 洗脱肽段经由纳升级电喷雾离子源接口喷出, 进入LTQ Orbitrap Velos高分辨率质谱仪进行检测分析. 每组样品应用2D-LC MS/MS检测3次.
1.2.6蛋白质数据库的搜索
使用MaxQuant(Version 1.4.1.2)搜索引擎对MS/MS肽段进行数据库搜索, 搜库结果采用Target-decoy策略进行过滤, 并设定肽段和蛋白质鉴定FDR≥99%.
1.2.7qRT-PCR方法二次验证AMACR的过表达和蛋白质组定量结果
收集对数生长期的细胞, 采用Trizol法提取细胞总RNA并定量, 取1 μg的 RNA进行反转录, 然后通过qPCR 分析AMACR 在mRNA水平的表达. 实验使用的引物包括: AMACR上游引物为5’-ATTTGGCTTTGTCAGTGTTCT-3’, 下游引物为5’-GCGGTCAAAAAGAGCCATTAT-3’;β-actin上游引物5’-CCACTGGCATCGTGATGGAC-3’, 下游引物5’-GCGGATGTCCACGTCACA -CT-3’; FABP5上游引物5’-ATGAAGGAGCTAGGAGTGGGA-3’, 下游引物 5’-TGCACCATCTGTAAA GTTGCAG-3’. PCR扩增条件: 94 ℃, 5 min. 然后进行40个循环的基因扩增, 条件为: 95 ℃, 15 s; 60 ℃, 31 s; 72 ℃, 31 s. 每次实验包含2个技术重复, 并且每个基因独立检测3次, 所得qRT-PCR结果使用2-ΔΔCT进行计算.
1.2.8Western blot验证AMACR的过表达
AMACR过表达的细胞样品经RIPA试剂裂解后, 回收上清液作为粗提蛋白, 经BCA定量后取50 μg进行SDS-PAGE电泳; 转膜, 封闭后, 孵育AMACR抗体(1/600稀释的)或GAPDH抗体(1/2 000), 4 ℃过夜; 再使用TBST洗涤3次后, 孵育HRP标记的二抗(1/5 000稀释), 室温反应1 h; 再次洗膜后, 进行ECL化学发光检测.
1.2.9质谱鉴定蛋白的生物信息学分析
应用GO数据库对鉴定出的差异表达蛋白质进行细胞成分和生物学加工分析. 差异蛋白间的相互作用网络通过Ingenuity Pathway Analysis(IPA)数据库进行分析.
1.2.10统计学处理
通过 t检验, 将蛋白表达差异大于2倍或小于0.5倍, 同时P<0.05的蛋白定义为显著差异蛋白.
2结果
2.1稳定过表达AMACR肝癌细胞株的建立
慢病毒转染HepG2细胞后经嘌呤霉素筛选荧光显微镜下观察细胞状态良好, 说明慢病毒转染对细胞没有明显毒性作用; 绿色荧光和明场重合度极高, 证明细胞转染效率达90%以上(见图1(a)). 同时, Western blot结果显示AMACR的表达量在过表达组中比参照组中高8.36倍(见图1(b)、 (c)).
2.2蛋白样品浓度测定和样品质量检测
在562 nm波长下读取蛋白标准品和样品的吸光值, 绘制出标准曲线, 得到直线回归方程y=1.495x+0.14 (R2=0.996 7). 计算得出AMACR过表达组和参照组的蛋白质量浓度分别是1.623和2.294 μg·μL-1. 取50 μg蛋白进行SDS-PAGE电泳, 结果显示, 2组样品之间平行度较好, 蛋白的相对分子质量主要富集在25~100 ku区域, 蛋白条带清晰, 初步表明蛋白提取效果理想, 样品适合进行蛋白质组研究.
2.3蛋白鉴定及差异蛋白的筛选
经无标定量质谱分析, 共鉴定到1 886种蛋白满足我们设定的标准(FDR≥99%). 如图2(a)所示, 这些蛋白的相对分子质量分布于1~200 ku内, 主要集中于30~50 ku范围, 与文献[6]报道相似, 证明质谱鉴定结果准确、 可靠. 另外, 将特异性表达在AMACR过表达细胞或参照细胞上的蛋白以及表达差异大于2倍或小于0.5倍(p<0.05)的蛋白定义为差异蛋白. 根据该设置, 共筛选出138种差异蛋白(见图2(b)), 包括124种上调蛋白, 14种下调蛋白, 其中105种蛋白在AMACR过表达组和参照组中均有表达, 另外有28种蛋白只在AMACR过表达的细胞中特异性地出现, 有5种蛋白在AMACR过表达的细胞株中特异性地消失. 这些特异性存在和特异性缺失的蛋白充分体现了AMACR对于细胞的改造作用.
2.4差异蛋白的生物信息学分析
利用GO对差异蛋白的亚定位分析发现, 差异蛋白主要存在于细胞器、 大分子复合物中(见图3(a)). 由于AMACR主要存在于溶酶体和线粒体中, 它表达量的变化对与之作用的蛋白会产生直接影响, 因此差异蛋白亚定位结果是合理的. 通过生物学加工分析发现, 这些差异蛋白所参与的生物加工主要是细胞加工、 代谢加工、 生物调节等过程(见图3(b)). 这说明由于AMACR的过表达直接改变了HepG2细胞的正常代谢, 对细胞生物学性状的改变明显.
应用IPA软件对差异蛋白所涉及的信号通路以及相互作用网络进行分析. 图3(c)、 (d)是IPA分析中得分最高的两个蛋白网络图. 两个网络分别聚集了30种和24种差异蛋白. 如图3(c)所示, 线粒体复合物作为该蛋白网络的一个节点与7种差异蛋白相连, 这一结果与AMACR的定位一致. 同时, IPA的结果提示这些差异蛋白间的相互调节主要由ERK1/2和NF-κB两条信号通路相连. ERK1/2信号途径是一个重要的癌细胞的增殖、 生长和凋亡的调节子[7]. NF-κB是一个重要的转录因子, 对于癌细胞的存活、 增殖、 抗凋亡均有调节作用[8-9].
2.5差异蛋白质的荧光定量PCR验证
如图4(a)所示, AMACR的mRNA表达水平在过表达细胞中比参照细胞中高约200倍, 再次证明建立的AMACR过表达细胞系成功. 另外以FABP5基因为例, 对质谱鉴定结果进行验证, 结果证明AMACR过表达组中FABP5的mRNA表达量较参照组高3倍, 该结果与质谱结果一致(见图4(b)), 证明质谱鉴定结果正确、 可信(结果均具有统计学意义,P<0.05).
3讨论
之前的实验室研究发现, AMACR是一种新的肝癌标志物[3, 10-11]. 在其它类型癌症中, AMACR不仅是一种肿瘤标志物, 更是一种肿瘤恶化的促进因子[12], 而AMACR的促癌功能在肝细胞癌中仍没有被验证. AMACR是一种存在于溶酶体、 线粒体中的支链脂肪酸氧化酶, 它的过表达可以加快支链脂肪酸的β氧化, 而脂肪酸β-氧化过程可以生成乙酰CoA, 后者是一种十分重要的中间化合物, 既可以进入三羧酸循环为细胞提供能量, 还可以为许多重要化合物合成提供原料, 如酮体、 胆固醇和类固醇化合物. 因此, AMACR的过表达一方面可以为细胞提供过剩的能量, 另一方面可以为细胞的代谢提供过剩的原料, 进而加快细胞的代谢. 因此从生化的角度分析, AMACR的过表达存在促进细胞生长、 增殖的潜力.
另外, GO分析发现, AMACR的过表达导致58.3%的差异蛋白参与了代谢加工和细胞加工的过程, 这说明AMACR的过表达必然引起细胞的生物学行为发生改变. 而IPA分析发现, 由于AMACR过表达引起的差异表达蛋白主要涉及ERK1/2信号途径和NF-κB信号途径. 如前文所述, 这两个信号途径在癌细胞的生长、 增殖、 凋亡过程中发挥着重要的作用. 它们可能是AMACR促进肝癌细胞生长、 增殖所依赖的最重要的分子机制.
结合之前的文献报道, 共找到5种与癌细胞增殖相关的蛋白(见表1), 包括: U2AF2、 FABP5、 SDC1、 ADGB和C1QBP. 以表皮型脂肪酸结合蛋白(fatty acid binding protein5, FABP5)基因为例. 据报道沉默FABP5 基因能够抑制肝癌细胞的增殖, 将细胞周期阻滞于G2/M期, 使肝癌细胞凋亡显著增加. JEONG等[13]报道在肝内胆管癌中FABP5的表达量与癌症分期显著正相关, 并且当FABP5被过表达后, 癌细胞的淋巴结转移增加、 细胞的增殖侵袭能力增强. 在本课题研究中, FABP5被AMACR显著上调, 而且FABP5同样涉及脂肪酸的代谢, 因此猜测FABP5与AMACR可能存在某种相互作用, 进而协同地调节癌细胞的增殖. 再如补体1Q结合蛋白(C1QBP)存在于线粒体的基质中. 据报道该蛋白在其它类型的癌症中显著上调, 而当C1QBP被缺失后, 细胞的增殖减弱, 凋亡增多. 结合IPA结果(见图4(c))发现, C1QBP与线粒体复合物发生直接的相互作用, 因此推测AMACR的过表达增加了C1QBP的表达量, 后者进一步促进了癌细胞的增殖. 除此之外, 还发现由于AMACR的过表达, 造成BCL-2样蛋白1(B2LCL1)的表达量显著升高, 该蛋白是一个已经被证实的、 重要的细胞凋亡抑制蛋白. 这说明AMACR的过表达将通过调节BCL-2的表达实现对肝癌细胞凋亡的抑制.
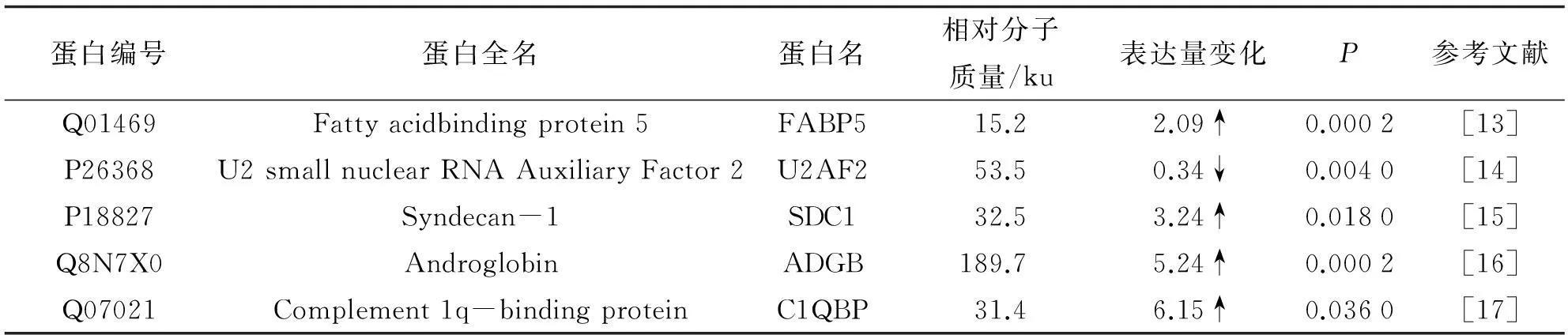
表1 细胞增殖相关的差异表达蛋白
注: ↓代表蛋白在AMACR过表达组与空载组中表达量比值下降, ↑代表蛋白在AMACR过表达组与空载组中表达量比值升高
综上所述, AMACR的过表达一方面为肝癌细胞的生长、 增殖提供能量和物质基础, 另一方面, 依赖ERK1/2和NF-κb信号通路并且上调多种促癌因子增强肿瘤生长、 增殖和抗凋亡的能力.
4结论
研究采用无标记定量蛋白质组学对AMACR过表达细胞与正常细胞进行比较分析, 共筛选出138种表达差异在2倍以上的差异蛋白, 其中有58%的差异蛋白涉及代谢加工和细胞加工, 证明AMCR的过表达对于肝癌细胞的生物学行为影响巨大. IPA分析发现, 这些差异蛋白主要涉及ERK1/2信号通路和NF-κB信号通路. 结合文献报到共找到6种促癌细胞增殖蛋白.
综合以上结果证明, AMACR的过表达通过调节ERK1/2和NF-κB信号通路以及上调多个促癌因子的表达量等手段改变肝癌细胞的生物学行为, 并具有促进肝癌细胞的生长和增殖的潜力, 为进一步研究AMACR的分子功能提供数据基础.
参考文献:
[1] LLOYD M D, DARLEY D J, WIERZBICKI A S,etal. Alpha-methylacyl-CoA racemase-an ‘obscure’ metabolic enzyme takes centre stage[J]. FEBS J, 2008, 275(6): 1 089-1 102.
[2] LI C F, CHEN L T, LAN J,etal. AMACR amplification and overexpression in primary imatinib-naive gastrointestinal stromal tumors: a driver of cell proliferation indicating adverse prognosis[J]. Oncotarget, 2014, 5(22): 11 588-11 603.
[3] HUANG X, ZENG Y, XING X,etal. Quantitative proteomics analysis of early recurrence/metastasis of huge hepatocellular carcinoma following radical resection[J]. Proteome Sci, 2014,12: 22.
[4] FESTUCCIA C, GRAVINA G L, MANCINI A,etal. Trifluoroibuprofen inhibits alpha-methylacyl coenzyme A racemase (AMACR/P504S), reduces cancer cell proliferation and inhibitsinvivotumor growth in aggressive prostate cancer models[J]. Anticancer Agents Med Chem, 2014, 14(7): 1 031-1 041.
[5] LATOSINSKA A, VOUGAS K, MAKRIDAKIS M,etal. Comparative analysis of label-free and 8-Plex iTRAQ approach for quantitative tissue proteomic analysis[J]. PLoS One, 2015, 10(9): e0 137 048.
[6] XING X, HUANG Y, WANG S,etal. Comparative analysis of primary hepatocellular carcinoma with single and multiple lesions by iTRAQ based quantitative proteomics[J]. J Proteomics, 2015, 128: 262-271.
[7] DESCHENES-SIMARD X, KOTTAKIS F, MELOCHE S,etal. ERKs in cancer: friends or foes[J]. Cancer Res, 2014, 74(2): 412-419.
[8] CHEN Y, LU R, ZHENG H,etal. The NFKB1 polymorphism (rs4648068) is associated with the cell proliferation and motility in gastric cancer[J]. BMC Gastroenterol, 2015,15: 21.
[9] PIKARSKY E, PORAT R M, STEIN I,etal. NF-kappaB functions as a tumour promoter in inflammation-associated cancer[J]. Nature, 2004, 431(7 007): 461-466.
[10] GUZMAN G, WU S J, KAJDACSY-BALLA A,etal. Alpha-methylacyl-CoA racemase (AMACR/P504S) can distinguish hepatocellular carcinoma and dysplastic hepatocytes from benign nondysplastic hepatocytes[J]. Appl Immunohistochem Mol Morphol, 2006, 14(4): 411-416.
[11] LI W, CAGLE P T, BOTERO R C,etal. Significance of overexpression of alpha methylacyl-coenzyme A racemase in hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 2008, 27(1): 2.
[12] ZHA S, FERDINANDUSSE S, DENIS S,etal. Alpha-methylacyl-CoA racemase as an androgen-independent growth modifier in prostate cancer[J]. Cancer Res, 2003, 63(21): 7 365-7 376.
[13] JEONG C Y, HAH Y S, CHO B I,etal. Fatty acid-binding protein 5 promotes cell proliferation and invasion in human intrahepatic cholangiocarcinoma[J]. Oncol Rep, 2012, 28(4): 1 283-1 292.
[14] TIAN M, CHENG H, WANG Z,etal. Phosphoproteomic analysis of the highly-metastatic hepatocellular carcinoma cell line, MHCC97-H[J]. Int J Mol Sci, 2015, 16(2): 4 209-4 225.
[15] SHIMADA K, NAKAMURA M, DE VELASCO M A,etal. Role of syndecan-1 (CD138) in cell survival of human urothelial carcinoma[J]. Cancer Sci, 2010, 101(1): 155-160.
[16] HUANG B, LU Y S, LI X,etal. Androglobin knockdown inhibits growth of glioma cell lines[J]. Int J Clin Exp Pathol, 2014, 7(5): 2 179-2 184.
[17] MCGEE A M, DOUGLAS D L, LIANG Y,etal. The mitochondrial protein C1qbp promotes cell proliferation, migration and resistance to cell death[J]. Cell Cycle, 2011, 10(23): 4 119-4 127.
(责任编辑: 洪江星)
Label-free quantitative proteomic analysis of the effect of AMACR overexpression on biological behaviors of hepatocellular carcinoma cells
XIA Jiangbao1, 2, XING Xiaohua2, WANG Yingchao2, SHEN Zuojun3
(1. Department of Medicine Laboratory of Bengbu Medical College, Bengbu, Anhui 233030, China;2. The United Innovation of Mengchao Hepatobiliary Technology Key Laboratory of Fujian Province,Mengchao Hepatobiliary Hospital of Fujian Medical University, Fuzhou, Fujian 350025, China;3. Affiliated Provincial Hospital of Anhui Medical University, Anhui Provincial Center for Clinical Laboratories,Hefei, Anhui 230001, China)
Abstract:This study attempted to investigate the effect of AMACR overexpression on the biological behavior of HCC cells using label free quantitative proteomic approch. A stable cell line that overexpressed AMACR was produced by transducing engineered lentivirus containing AMACR complete sequence into HepG2 cells. Afterwards, the whole protein extracted from the AMACR-overexpressed cells and the normal cultured cells (control) were comparatively quantified by 2D LC-MS/MS. A total of 138 differentially expressed proteins were identified. These dysregulated proteins were mostly enriched for metabolic process and cellular process, which suggested a big change at biological behaviors occurred in the host cells due to AMACR overexpression. The signalings pathway analysis revealed that the dysregulated proteins in AMACR-overexpressed cells are more concentrated to the ERK1/2 and NF-κB signaling pathways. Thus, AMACR overexpression induced the alterations at biological behaviors of HCC cells majorly through modulating the ERK1/2 and NF-κB signalings.
Keywords:hepatocellular carcinoma; AMACR; cell proliferation; label-free quantitative proteomics
中图分类号:R735.7
文献标识码:A
基金项目:福建省自然科学基金资助项目(2015J05174); 福建省卫生计生委青年科研课题资助项目(2015-1-94); 福州市科技强院建设项目(编号:2014-S-139-3); 福建医科大学孟超肝胆医院科研资助项目(QDZJ-2014-005); 福建中医药大学校管科研课题资助项目(XB2014096)
通讯作者:王英超(1983-), 博士, 助理研究员, 主要从事肿瘤蛋白质组学研究, yingchaowang@live.com
收稿日期:2015-11-30
文章编号:1000-2243(2016)02-0282-07
DOI:10.7631/issn.1000-2243.2016.02.0282
沈佐君(1963-), 博士, 副教授, 主任检验师, 主要从事肿瘤的早期诊断和预后判断, shenzuojun@163.com
