产AmpC酶大肠埃希菌的检测及耐药分析
2016-05-26王欣慧许可欣
王欣慧,许可欣
(南京医科大学第二附属医院检验科,江苏南京 210011)
产AmpC酶大肠埃希菌的检测及耐药分析
王欣慧,许可欣△
(南京医科大学第二附属医院检验科,江苏南京 210011)
摘要:目的检测临床分离细菌中大肠埃希菌的AmpC β-内酰胺酶(简称AmpC酶)及其耐药情况。方法收集临床上药敏试验头孢西丁抑菌圈直径≤18 mm的大肠埃希菌299株,三维试验筛选产AmpC酶大肠埃希菌,多重PCR扩增产AmpC酶的基因。最低抑菌浓度法检测抗菌药物的敏感性。结果AmpC酶初筛试验阳性的299株大肠埃希菌中,56株(18.73%)三维试验筛选阳性,多重PCR试验阳性共34株,其中DHA群的有14株,CIT群的有20株。结论大肠埃希菌临床菌株中AmpC酶仍有较高的分离率,本研究中以DHA群和CIT群为主,并且耐药情况越来越严重。
关键词:大肠埃希菌;AmpC β-内酰胺酶;ampC
大肠埃希菌的分离率始终最高,从近年我国发布的耐药监控数据分析来看,其耐药率也逐年增加[1-3]。细菌因产生各种β-内酰胺酶导致的耐药现象随着β-内酰胺类抗菌药物的广泛应用日趋严重,酶的水解作用已成为耐药增加的一个重要原因,尤其以产超广谱β-内酰胺酶(ESBLs)、AmpC酶β-内酰胺酶(AmpC酶)最为常见。其中AmpC酶已是肠杆菌科细菌对β-内酰胺类抗菌药物产生多重耐药的重要原因之一[4]。AmpC酶的产生使细菌对包括青霉素和除头孢匹罗和头孢吡肟以外几乎全部的头孢菌素类药物产生耐药,另有报道,由于伴有ESBLs,产AmpC酶的大肠埃希菌出现了对广谱头孢菌素的耐药性[5]。种间传播性是质粒介导的AmpC酶具有的特征,不论其在细菌耐药机制还是在院内感染方面都有重要的意义。目前,对于AmpC酶产生耐药的检测仍然没有方法学的临床和实验室标准协会(CLSI)指导标准[6],临床常规检测项目中也没有对产AmpC酶的大肠埃希菌检测。因此,笔者对临床菌株产AmpC酶的情况及其耐药情况用进行了调查和分析,旨在为相关研究提供参考。
1材料与方法
1.1菌株从临床痰、尿等标本中分离得到且筛选出头孢西丁抑菌圈直径小于等于18 mm 299株,无重复的菌株。用大肠埃希菌ATCC 25922作为产AmpC酶的阴性对照株,以产AmpC酶阴沟肠杆菌(029M)作为产AmpC酶的阳性对照株。
1.2仪器与试剂试验药敏纸片购自Oxoid公司;药敏试验板购自上海复星佰珞生物技术有限公司,PCR扩增试剂盒购自大连宝生物工程有限公司;引物合成于上海生工生物公司。使用的仪器包括微生物鉴定药敏系统、Mastercycle梯度PCR仪、 Tanon Eps100电泳仪、凝胶成像仪、高速离心机、加热仪器、37 ℃孵箱。
1.3方法
1.3.1AmpC酶的初筛试验用微生物鉴定药敏系统对菌株进行鉴定,筛选出头孢西丁抑菌圈直径≤18 mm的大肠埃希菌。
1.3.2三维试验筛选反复冻融提取酶粗提物,大肠埃希菌 ATCC 25922菌液涂布M-H琼脂培养基,将头孢西丁纸片贴在培养基中心,沿纸片边缘向外划线加入酶粗提物,35 ℃孵育16~18 h[7]。
1.3.3多重PCR方法检测AmpC酶加热裂解方法提取细菌DNA,配制PCR的反应体系共50ul,分群特异性的引物6对[8],见表1。多重PCR的反应条件是94 ℃ 3 min,94 ℃ 30 s,64 ℃ 30 s,72 ℃ 1 min,72 ℃ 7 min。

表1 PCR引物序列及扩增片段长度
1.3.4微量肉汤稀释法按照CLSI推荐使用MIC法检测待检大肠埃希菌对抗菌药物的敏感性。稀释后菌液顺次加入含有不同浓度药物的96孔板中,设有阳性和阴性对照孔。37 ℃培养20~22 h进行结果观察。
2结果
2.1三维试验对初筛试验阳性的菌株进行三维试验,得到三维试验阳性共56株,其阳性率为18.73%(56/299),见图1。

1、2:三维试验阴性;3:为三维试验阳性。
图1三维试验结果
2.2多重PCR试验对三维试验阳性的大肠埃希菌进行多重PCR试验,多重PCR试验阳性共34株,其中DHA群的有14株,CIT群的有20株,见图2。
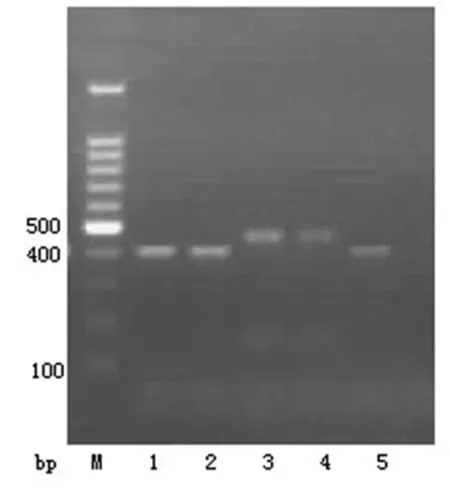
1、2、5:DHA群;3、4:CIT群。
图2多重PCR试验结果图
2.3MIC法药物敏感试验筛选出的34株大肠埃希菌的MIC法药物敏感试验结果,见图3(见《国际检验医学杂志》网站主页“论文附件”),这些大肠埃希菌对AMP、KZ、CXM、CTX的耐药率均为100%,对FEP的耐药率高达58.8%,另外对CIP、PRL和CAZ的耐药率分别高达91.2%、94.1%和97.1%和,对AK的耐药率为23.5%,而对碳青霉烯类抗菌药物如MEM和IPM耐药率相对较低分别为8.8%和11.8%。
3讨论
大肠埃希菌为临床分离革兰阴性杆菌引起感染中最常见,可见于泌尿道、伤口、呼吸道、胆道和脑膜等部位,随着抗菌药物在临床的广泛应用耐药现象不断增加[9]。各种因β-内酰胺酶引起的耐药中AmpC酶已成为肠杆菌科细菌对β-内酰胺类抗菌药物产生多重耐药的重要原因之一。
目前国际上检测AmpC酶的方法有很多,三维试验是公认可以使用的方法,本研究三维试验阳性率为18.73%(56/299)。质粒介导的AmpC酶至少被归为CIT、DHA、MOX、EBC、FOX和ACC六个主要群,本研究中以DHA群和CIT群为主,可见DHA群和CIT群是临床中产AmpC酶大肠埃希菌的常见基因型。
通过对筛选出的34株产AmpC酶大肠埃希菌进行药物敏感试验,得出一、二、三代头孢中这些产AmpC酶大肠埃希菌均有高的耐药率,这也与AmpC酶可水解第一、二、三代头孢菌素的报道一致[10]。另外,对AMP、PRL和CIP的耐药率也分别高达100%、94.1%和91.2%。本实验结果显示一直对产AmpC酶的大肠埃希菌有高敏感率的四代头孢如FEP的耐药率竟然高达58.8%。当前因产生AmpC酶而出现对一代、二代和三代头孢耐药的感染性疾病治疗最为有效的抗菌药物是碳青霉烯类抗菌药物如IPM和MEM,耐药率相对较低分别为11.8%和8.8%。可见,治疗因产AmpC酶的细菌引起的感染性疾病中可用抗菌药物的选择范围变得非常小,要控制抗生素使用和加强产酶菌监测,否则一旦继续滥用抗菌药物就会出现无药可用。
伴着细菌出现高耐药率,一方面揭示了细菌的耐药性正在增强,这样发展下去,对感染性疾病的治疗极可能无药可用;另一方面,虽然AmpC酶被认为是革兰阴性细菌尤其是肠杆菌科细菌产生耐药的重要机制,但随着更深入的研究发现膜通透性降低、泵外排作用和青霉素结合蛋白的改变等机制在细菌产生耐药过程中也起着至关重要的作用,同时,也正是存在各种机制的协同作用导致了耐药现象更为严重。
参考文献
[1]梅亚宁,童明庆.2011年度卫生部全国细菌耐药监测网报告:成年患者分离菌的耐药监测[J].中国临床药理学杂志,2014,2(30):94-99.
[2]汪复,朱德妹,胡付品,等.2012年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2013,5(13):321-330.
[3]胡付品,朱德妹,汪复,等.2013年中国CHINET细菌耐药性监测[J].中国感染与化疗杂志,2014,5(14):365-374.
[4]Nedbalcova K,Nechvatalova K,Pokludova L,et al.Resistance to selected beta-lactam antibiotics[J].Cell Mol Life Sci,2014,171 (3/4):328-336.
[5]Mammeri H,Nazic H,Naas T,et al.AmpC beta-lactamase in an Escherichia coli clinical isolate confers resistance to expanded-spectrum cephalosporins[J].Antimicrob Agents Chemother,2004,48(10):4050-4053.
[6]Roche C,Boo TW,Walsh F,et al.Detection and molecular characterisation of plasmidic AmpC beta-lactamases in Klebsiella pneumoniae isolates from a tertiary-care hospital in Dublin,Ireland[J].Clin Microbiol Infect,2008,14(6):616-618.
[7]Coudron PE,Moland ES,Thomson KS.Occurrence and detection of AmpC beta-lactamases among Escherichia coli,Klebsiella pneumoniae,and Proteus mirabilis isolates at a veterans medical center[J].J Clin Microbiol,2000,38(5):1791-1796.
[8] Hussain M,Hasan F,Shah AA,et al.Prevalence of class A and AmpC beta-lactamases in clinical Escherichia coli isolates from Pakistan Institute of Medical Science,Islamabad,Pakistan[J].Jpn J Infect Dis,2011,64(3):249-252.
[9]Yamasaki K,Komatsu M,Abe N,et al.Laboratory surveillance for prospective plasmid-mediated AmpC beta-lactamases in the Kinki region of Japan[J].J Clin Microbiol,2010,48(9):3267-3273.
[10]Upadhyay S,Sen MR,Bhattacharjee A.Diagnostic utility of boronic acid inhibition with different cephalosporins against Escherichia coli producing AmpC β-lactamases[J].J Med Microbiol,2011,60(Pt 5):691-693.

(收稿日期:2016-01-10)
DOI:10.3969/j.issn.1673-4130.2016.08.041
文献标识码:A
文章编号:1673-4130(2016)08-1112-03
△通讯作者,E-mail:sunshinexu1988@163.com。
·临床研究·
