Trop2病毒样颗粒的制备及纯化研究*
2016-05-26张惠中
王 琳,王 希,董 轲,张惠中
(第四军医大学唐都医院临床实验与检验科,陕西西安 710038)
·论著·
Trop2病毒样颗粒的制备及纯化研究*
王琳,王希,董轲,张惠中△
(第四军医大学唐都医院临床实验与检验科,陕西西安 710038)
摘要:目的获得Trop2为靶点的病毒样颗粒(VLPs),为进一步体内诱导实验和疫苗研究提供依据。方法利用分子克隆技术构建Trop2真核表达载体pCAGGs/Trop2和杆状病毒表达载体pFastbac1/Trop2,以pCAGGs/Trop2表达载体转化Hela细胞,用免疫细胞化学方法确定Trop2蛋白表达并锚定于胞膜上;以pFastbac1/Trop2转化大肠杆菌E.coliDH10bac菌株获得重组杆粒Trop2 Bacmid,转染Tn5昆虫细胞获得重组病毒Trop2 rBV,与本室保存的Gag rBV共感染昆虫细胞得到重组VLPs,透析浓缩后经蔗糖密度梯度离心纯化、蛋白免疫印迹(WB)鉴定,电镜观察病毒形态。结果构建成功的重组杆粒Trop2 Bacmid转染Tn5昆虫细胞获得重组病毒Trop2 rBV,与Gag rBV共感染昆虫细胞获得重组Trop2 VLPs。结论成功制备了Trop2 VLPs,为其后续诱导体液和细胞免疫应答研究奠定了基础。
关键词:Trop2;肿瘤疫苗;病毒样颗粒
随着分子生物学、细胞生物学和免疫学等研究的进展,肿瘤疫苗逐渐成为肿瘤免疫治疗的热点,但目前研发的临床实验肿瘤疫苗很难获得满意疗效,新型更有效的肿瘤疫苗制备策略亟待发掘[1]。病毒样颗粒(VLPs)是由病毒单一或多个结构蛋白自行装配形成,能够模拟天然病毒衣壳空间结构[2],因VLPs不含病毒的核酸成分而无复制和感染能力,但具有天然病毒的类似嗜性,能被多种免疫细胞摄取并在细胞内运输,从而通过主要组织相容性复合体(MHCⅠ)类途径呈递,激发全面免疫反应,这些独特的性质使VLPs在疫苗研究中备受关注,为新型疫苗的研发提供了新平台;膜表面糖蛋白Trop2高表达于多种上皮来源的恶性肿瘤[3],并与肺癌恶性程度密切相关[4],其表达产物定位于细胞膜表面,使其成为抗体和ADCC的理想作用靶点[5];VLPs自我装配过程中,外源蛋白与壳蛋白Gag之间会有相互作用关系,外源蛋白之间的相互作用也会影响VLPs组装效率及蛋白呈现特性[6-8]。本课题拟结合SIV-Gag病毒制备特点制备以Trop2 为靶点的VLPs,为后续体内免疫应答实验及有效的新型肿瘤疫苗研究提供依据,为高表达Trop2的恶性肿瘤如肺癌、宫颈癌、胃癌及胰腺癌疫苗研制与应用提供新思路和借鉴依据。
1材料与方法
1.1材料
1.1菌株、细胞株及质粒大肠杆菌E.coliJM109、E.coliDH5a、E.coliDH10bac、人宫颈癌细胞株Hela和昆虫细胞Tn5,杆状病毒表达载体pFastBac1、真核表达载体pCAGGs均为本实验室保存,SIV-Gag杆状病毒(rBV-Gag)为美国Emory大学Ling Ye教授惠赠。
1.1.2主要试剂与仪器CellfectinⅡReagent、Sf-900ⅡSFM、Unsupplemented Grace′s Insect Medium、Lipofectamine 2000转染试剂购自Invitrogen公司;QSM-O3SP/50蛋白质浓缩仪购自美国通用;Hitachi-H7500透射电镜由唐都医院电镜中心提供;分子克隆载体及相关辅助试剂、各种酶、抗菌药物、IPTG、X-gal均购自于TaKaRa公司;引物由北京奥科鼎盛生物科技公司合成。
1.2方法
1.2.1Trop2基因扩增根据Gene Bank Trop2序列设计引物,分别从不同新生鼠组织用Trizol法提取相应RNA,RT-PCR扩增出Trop2基因序列、回收PCR产物,按照克隆载体pMDTM18-Vector说明书进行连接反应,连接产物转化E.coliJM109感受态,涂布LB/Amp培养平板,37 ℃过夜培养,随机挑取单菌落增菌并提取质粒DNA,酶切鉴定正确后送测序,得到含有目的基因的T克隆载体Tv/Trop2。
1.2.2Trop2真核表达载体的构建用EcoRⅠ/XhoⅠ双酶切测序成功的Tv/Trop2和真核表达载体pCAGGs,PCR回收目的片段连接到pCAGGs上,转化E.coliJM109感受态细胞,提取质粒双酶切及测序鉴定成功,构建真核表达载体并命名为pC/Trop2。
1.2.3Trop2包膜定位表达确认真核表达载体pC/Trop2参照脂质体Lipofectamine2000说明书转染Hela细胞,分别设立空白对照组、阴性对照组。转染24 h后RIPA细胞裂解液裂解细胞,收集标本,常规方法进行Western Blot检测Trop2蛋白表达;同时,Hela细胞爬片、脂质体法转染后24 h,取出爬片进行细胞免疫化学染色,检测Trop2蛋白在细胞水平的表达情况。
1.2.4Trop2杆状病毒表达载体的构建用EcoRⅠ/XhoⅠ双酶切质粒Tv/Trop2和pFastBac1杆状病毒表达载体,回收后用T4连接酶连接目的片段与载体,连接产物转化E.coliDH5a感受态细胞,涂布LB/Amp培养平板,37 ℃过夜培养;随机挑取单菌落增菌并提取质粒DNA,双酶切及测序鉴定正确后,得到杆状病毒表达载体命名为pF/Trop2。
1.2.5pF/Trop2转染与Bacmid鉴定将1 μL pF/Trop2杆状病毒表达载体转染100 μL E.coliDH10bac感受态细胞,冰浴30 min,42 ℃热激45 s,加入900 μL LB培养基、37 ℃、180 r/min培养4 h,筛选培养板(含100 μg/mL X-gal、40 μg/mL IPTG、50 μg/mL卡那霉素、10 μg/mL四环素、7 μg/mL庆大霉素)37 ℃培养48 h,蓝白筛选阳性克隆,参照S.N.A.P MidiPrep Kit说明书分离重组杆粒DNA(Bacmid),用pUC/M13鉴定引物进行PCR鉴定,并命名为Trop2 Bacmid。
1.2.6Bacmid转染TN5昆虫细胞制备Rbv 1 μL Trop2-bacmid 与10 μL转染试剂混合,依据 CellfectinⅡReagent说明书操作转染Tn5昆虫细胞,27 ℃培养6 h,更换Sf-900ⅡSFM继续培养,至转染细胞出现病变现象表明杆粒转染成功,收集上清液获得第一代病毒P1,传代扩增病毒进行滴度测定,至滴度达到(5×107~108)pfu/mL,收集病毒命名为Trop2 rBV。
1.2.7Trop2 VLPs制备与纯化以Gag rBV(本室保存)和Trop2 rBV MOI比例为1∶10共感染TN5昆虫细胞,感染72 h后收集培养上清液,经QSM-O3SP/50蛋白质浓缩仪浓缩后,蔗糖梯度密度离心(从管口至管底质量/体积百分比浓度梯度依次为10%、>10%~30%、>30%~50%),从管底依次收集不同片段,无钙镁PBS洗涤纯化。
1.2.8蛋白免疫印迹鉴定表达以SDS-PAGE及蛋白免疫印迹法分别检测收集片段的目的蛋白表达,依据常规方法进行,将上述标本跑SDS-PAGE电泳,考马斯亮蓝染色;同时SDS-PAGE胶上目的蛋白用电转移法转移至硝酸纤维素膜上,分别用SIV-Gag和Trop2抗体检测目的蛋白表达。
1.2.9电镜观察取制备好的Trop2 VLPs ,滴一小滴于铜网上,使有支持膜的表面与样品液表面接触,稍晾干,1%磷钨酸溶液负染晾干后,Hitachi-H7500透射电镜观察制备好的VLPs形态结构。
2结果
2.1构建Trop2真核表达载体、杆状病毒表达载体及包膜定位表达情况新生鼠组织(肌肉、小肠、肾脏、肺脏、心脏、肝脏及脑)中提取的RNA,RT-PCR法扩增Trop2基因,结果显示在肌肉、肾脏中扩增出970 bp目的条带,连接T克隆载体、EcoRⅠ/XhoⅠ双酶切鉴定大小正确,DNA测序结果比对,获得测序正确的Tv/mTrop2目的基因,见图1。
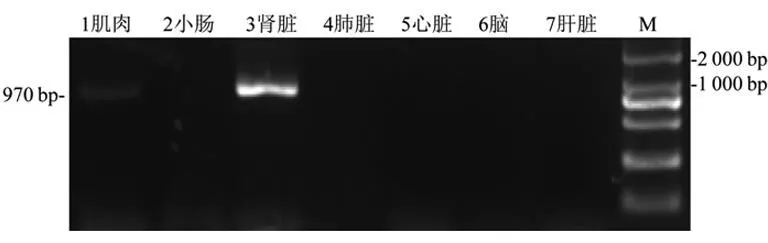
1~7:不同鼠组织Trop2 PCR产物;M:DL2000 Marker。
图1Trop2基因RT-PCR结果
目的基因克隆入pCAGGs真核表达载体(4 790 bp)和pFastbac1杆状病毒表达载体(4 750 bp),EcoRⅠ/XhoⅠ双酶切鉴定结果显示目的片段970 bp,条带大小正确,见图2,测序结果经比对与目的基因Trop2一致,成功构建了真核表达载体pC/Trop2和杆状病毒表达载体pF/Trop2。
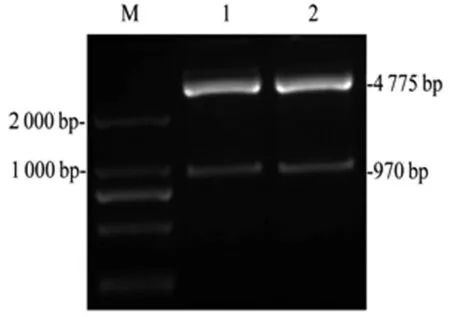
1:pC/Trop2真核表达载体;2:pF/Trop2杆状病毒表达载体;M:DL2000 Marker。
图2pC/Trop2、pF/Trop2载体酶切鉴定

1:空白组;2:转染pCAGGs阴性对照组;3:转染 pC/Trop2表达载体组;M:DL2000 Marker。
图3WB检测Trop2表达
蛋白免疫印迹鉴定Trop2在Hela细胞表达情况,结果显示,对比分析空白对照、阴性对照显示约在35×103处出现特异条带,见图3,证实转染了pC/Trop2表达载体的Hela细胞成功表达Trop2蛋白。细胞免疫化学方法结果显示对比NC组可见Trop2组在细胞膜高表达,见图4,证实表达产物锚定于胞膜。
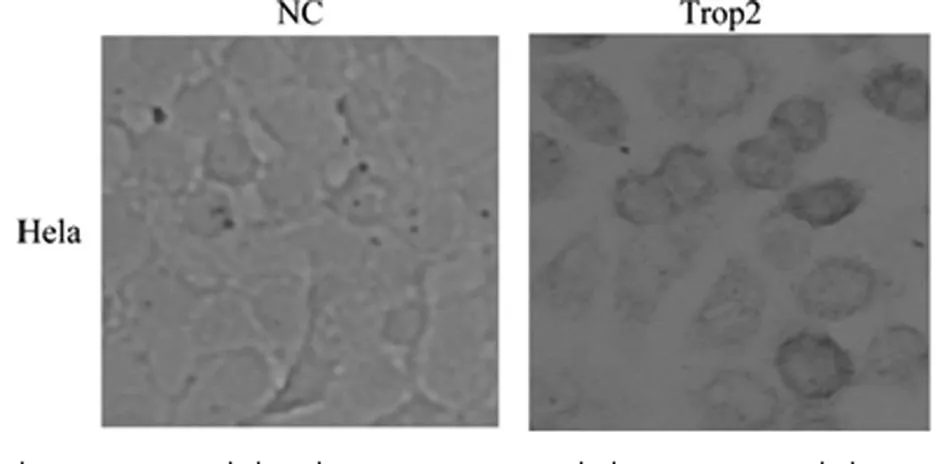
NC:转染pCAGGS阴性对照组;Trop2:转染pC/Trop2真核表达载体组。
图4免疫组化检测Trop2真核表达定位
2.2Trop2 Bacmid鉴定结果杆状病毒表达载体pF/Trop2转座E.coliDH10bac菌株,白色克隆为阳性克隆,应用鉴定引物(pUC/M13)进行PCR鉴定、分离杆粒,显示1#、2#扩增出目的片段3 270 bp(2 300 bp+970 bp)和阳性对照片段(2 900 bp),证实目的基因已整合入杆粒,命名为Trop2 Bacmid,见图5。

1#、2#:1号、2号Trop2 BacmidPCR产物;positive:阳性对照;M:DL15000 Marker。
图5Trop2 Bacmid鉴定结果
2.3嵌合Trop2 VLPs的制备与鉴定Trop2 Bacmid转染细胞5 d后,细胞逐渐增大、肿胀,渐脱离贴壁培养状态,对比正常对照组、转染组结果表明杆粒转染成功,见图6。上清传代扩增培养,按照Gag rBV与Trop2 rBV MOI比例1∶10共感染TN5细胞大量制备VLPs,浓缩纯化收集不同密度层蛋白片段,蛋白免疫印迹分析VLPs纯度,分析结果可见洗脱后在30%~50%蔗糖浓度层VLPs片段含量最大,见图7。
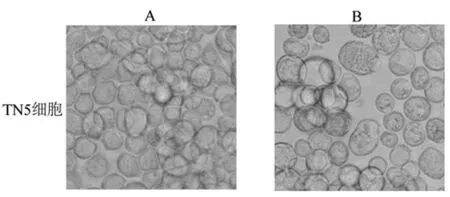
A:未转染组;B:转染Trop2 Bacmid组。
图6转染TN 5细胞后

1:10%蔗糖浓度层VLPs;2:>10%~30%蔗糖浓度层VLPs;3:>30%~50%蔗糖浓度层VLPs。
图7WB检测VLPs 组装效率
2.4电镜观察透射电镜负染结果表明视野中出现结构完整、颗粒大小均一的VLPs,其直径大小为110~120 nm 与gag VLPs直径大小相似(直径大小约110 nm),表明该方法能产生结构完整的VLPs,见图8。

图8 透射电镜观察VLPs
3讨论
肺癌是当前世界上发病率较高的恶性肿瘤,随着免疫治疗研究的不断深入,以肿瘤特异性抗原为基础的疫苗研究备受关注[9],VLPs疫苗研发技术成为肿瘤疫苗研发的新策略之一,为肿瘤的预防和治疗开辟了新的途径。
膜表面糖蛋白Trop2在多种上皮来源的恶性肿瘤中过表达,在肿瘤细胞増殖及决定恶性表型中发挥重要作用,定位于胞膜表面使其成为抗体和抗体依赖的细胞介导的细胞毒性作用(ADCC)的理想靶点,尤其是对那些缺乏有效表达MHC Ⅰ类分子而不能呈递抗原于细胞毒T细胞的肿瘤细胞具有更重要的抗原递呈意义[10]。VLPs因抗原呈现好、制备简便安全性高、免疫原性强等优势,成为疫苗研发热点。
本课题中结合SIV-Gag在病毒复制过程中的装配机制特性,制备以Trop2为靶点的嵌合型肺癌VLPs。考虑到VLPs自我装配过程中,外源蛋白需通过与壳蛋白Gag之间相互作用出胞并形成VLP,外源蛋白胞内表达定位直接影响VLPs组装效率及蛋白呈现特性[11],首先通过构建真核表达载体pC/Trop2在Hela细胞中表达,经免疫细胞化学法确定了Trop2蛋白表达并定位在细胞膜上,使抗原成分有利于呈现于VLPs结构表面;其次,有多种系统可用于VLPs表达制备,选择Bac-to-Bac杆状病毒表达系统表达并获得Trop2靶抗原组装的VLPs。其优点如下:表达量较高、细胞培养方便、杆状病毒使用相对安全,应用广泛,可以在一个细胞中表达多种蛋白[12]。除此之外,本研究结合SIVGag蛋白和Trop2rBV共感染制备嵌合VLPs,多种MOI比例共感染昆虫细胞制备嵌合VLPs,进行体外生物学活性鉴定,筛选最有效的比例可以优化VLPs组装效率,从而为后续的体内实验及有效的新型肺癌疫苗研究提供依据,也为高表达Trop2的其他恶性肿瘤如宫颈癌、胃癌及胰腺癌的疫苗研制提供新思路和借鉴依据[13]。
参考文献
[1]Win SJ,Ward VK,Dunbar PR,et al.Cross-presentation of epitopes on virus-like particles via the MHC Ⅰ receptor recycling pathway[J].Immunol Cell Biol,2011,89(6):681-688.
[2]Roldão A,Mellado MC,Castilho LR,et al.Virus-like particles in vaccine development[J].Expert Rev Vaccines,2010,9(10):1149-1176.
[3]Mühlmann G,Spizzo G,Gostner J,et al.TROP2 expression as prognostic marker for gastric carcinoma[J].J Clin Pathol,2009,62(2):152-158.
[4]江爱桂,黄建安.Trop2在晚期非小细胞肺癌组织中的表达及其对预后的影响[J].江苏医药,2013,39(22):2702-2705.
[5]Gridelli C,Maione P,Comunale D,et al.Adjuvant chemotherapy in elderly patients with non-small-cell lung cancer[J].Cancer Control,2007,14(1):57-62.
[6]Owonikoko TK,Ragin CC,Belani CP,et al.Lung cancer in elderly patients:an analysis of the surveillance,epidemiology,and end results database[J].J Clin Oncol,2007,25(35):5570-5577.
[7]Immunosenescence PT.Current status and molecular mechanisms[J].Hautarzt,2011,62(8):598-606.
[8]Gruver AL,Hudson LL,Sempowski GD.Immunosenescence of ageing[J].Pathol,2007,211(2):144-156.
[9]Frasca D,Blomberg BB.Aging affects human B cell responses[J].J Clin Immunol,2011,31(3):430-435.
[10]舒放,王晓岩,雷迎峰,等.HCV中和抗原表位与HBV S抗原嵌合病毒样颗粒的制备及纯化[J].中国生物制品学杂志,2015,28(3):257-260,265.
[11]李谨革,龙敏,王希,等.Her2/ECD-sf162/TM融合杆状病毒表达及鉴定[J].现代肿瘤医学,2015,23(13):1798-1802.
[12]彭建明,李金明.病毒样颗粒在免疫测定中的应用研究进展[J].中华检验医学杂志,2005,28(2):214-216.
[13]Hesketh PJ,Lilenbaum RC,Chansky K,et al.Chemotherapy in patients ≥80 with advanced non-small cell lung cancer:combined results from SWOG 0027 and LUN 6[J].Journal of Thoracic Oncology,2007,2(6):494-498.
Expression and purification of Trop2 virus like particles*
WangLin,WangXi,DongKe,ZhangHuizhong△
(DepartmentofClinicalResearchandDiagnaosis,TangduHospital,FourthMilitaryMedicalUniversity,Xi′an,Shaanxi710038,China)
Abstract:ObjectiveTo gain the virus like particles (VLPs) based on Trop2 targets,which provided the basis for further in vivo induced experiments and anti-tumor vaccine studies.MethodsUsing molecular cloning method to constract eukaryotic expression vector of pCAGGs/Trop2 and baculovirus expression vector of pFastbac1/Trop2,expression product of pCAGGs/Trop2 in HeLa cells were intended to be to be anchored to the cell membrane by the methods of Immunohistochemistry;pFastbac1/Trop2 were transformed into E.coliDH10bac isolates to gain recombinant bacmids,which were transfected into insect cells to express recombinant baculovirus with Gag rBV,then sucrose density gradient centrifugation,Western Blot and electron microscope were performed to purify and identify the Trop2 VLPs.ResultsBuilding recombinant bacmids which were transfected into insect cells to express recombinant baculovirus with Gag rBV,gained the recombinant Virus like Particles.ConclusionTrop2 VLPs was successfully prepared,which laid the foundation for the subsequent induction of humoral and cellular immune response.
Key words:Trop2;tumor vaccine;virus like particles
(收稿日期:2015-12-20)
DOI:10.3969/j.issn.1673-4130.2016.08.002
文献标识码:A
文章编号:1673-4130(2016)08-1020-04
基金项目:国家自然科学基金(81201775、81572974);陕西省自然科学基础研究计划(2013JZ010)。
作者简介:王琳,女,检验技师,主要从事医学分子生物学方面的研究。△通讯作者,E-mail:huizz328@163.com。
