佛山地区无偿献血人群人细小病毒B19感染情况分析*
2016-05-26严军雄伍伟健周健欣
严军雄,伍伟健,周健欣,卢 瑾
(1.佛山市第四人民医院,广东佛山 528000;2.佛山市中心血站,广东佛山 528000)
·论著·
佛山地区无偿献血人群人细小病毒B19感染情况分析*
严军雄1,伍伟健2△,周健欣2,卢瑾2
(1.佛山市第四人民医院,广东佛山 528000;2.佛山市中心血站,广东佛山 528000)
摘要:目的了解佛山地区无偿献血人群人细小病毒(HPV)B19 感染现状。方法采用ELISA检测血液中的HPV B19 IgG和IgM抗体,并用PCR检测抗体阳性标本HPV B19 DNA。结果368例无偿献血者标本中检出HPV B19 IgG阳性92例,阳性率为25.00%;检出HPV B19 IgM阳性2例,阳性率为0.54%,两者比较差异有统计学意义(P<0.01)。94例抗体阳性标本中,检测HPV B19 DNA 阳性4例,阳性率为4.26%。结论佛山地区无偿献血人群存在较高的HPV B19既往感染率,急、慢性感染率较低,慢性感染者HPV B19病毒载量较低。
关键词:无偿献血者;人类细小病毒B19;血清学检测;实时荧光定量PCR
人细小病毒B19(HPV B19)是直径为20~30 nm无囊膜包裹,3 500碱基组成的单链DNA病毒,属细小病毒科嗜红细胞病毒属[1]。1975年在献血者的血清中首次被发现,目前研究已经证实HPV B19可引起人类多种疾病[2],有经血液传播的风险[3],由于我国未将HPV B19纳入献血者血液检测项目中,故目前未见佛山市无偿献血人群HPV B19感染相关研究数据。为调查当前采血模式下佛山地区无偿献血人群HPV B19感染现状和病毒载量,笔者对无偿献血人群采用ELISA检测HPV B19抗体,采用PCR检测DNA水平,获得了本市无偿献血人群HPV B19感染相关研究数据,现报道如下。
1材料与方法
1.1血液标本随机选取非团体无偿献血者368例,其中男208例、女160例,年龄18~57岁,抽取静脉血液10 mL,分别置于2支一次性试管(EDTA抗凝,其中1支为核酸检测专用管)各5 mL,离心取血浆待检。
1.2试剂与仪器主要仪器包括酶免全自动前处理器(STAR3-2931型,瑞士HAMILTON公司)、全自动酶标仪(Anthos240rt型,奥地利Anthos公司),实时荧光PCR仪(Bio-Rad CFX96型,美国Bio-Rad公司)。ELISA检测试剂:HPV B19 IgG和IgM抗体试剂盒(美国WKSUBIO公司产品)。PCR试剂盒(上海之江生物科技股份有限公司产品),PCR特异性引物与探针:上游引物5′-GGC ATG GTT AAC TGG AAT AA-3′,下游引物5′-TGC AGC ACT GTC AAC AGC ACT-3′,Taqman荧光探针。
1.3方法
1.3.1献血者的筛选严格按照《献血者健康检查要求》《血站技术操作规程(2012版)》和市中心血站质量标准、标准操作规程筛选献血者,采集低危献血者血液。
1.3.2HPV B19 IgG和IgM抗体检测采用ELISA分别检测HPV B19 IgG和IgM,严格按试剂说明书进行,检测标本A值(S)/CO<1为阴性,S/CO≥1为阳性。
1.3.3HPV B19 DNA检测抗体阳性标本采用Real time RT-PCR检测HPV B19 DNA。标本和对照品核酸裂解处理:标本50 μL分别加入50 μL核酸提取液,震荡混匀10 s,99 ℃水浴10 min,13 000 r/min离心10 min,保留上清液备用,H2O为阴性对照,阳性对照品作10倍、100倍、1 000倍梯度稀释。试剂配制:取HPV B19 核酸荧光PCR检测混合液与1 μL内部对照品,加入0.4 μL酶(Taq+UNG)震荡混匀10 s,3 000 r/min离心10 s。加样:取混合液36 μL置于PCR管中,加入样品处理上清液、H2O和阳性对照品各4 μL分别加入PCR管。反应程序:37 ℃,2 min;94 ℃,2 min;40个循环:93 ℃,15 s,58 ℃,30 s,60 ℃,30 s。单点荧光检测在60 ℃,制备溶解曲线:65 ℃,5 s;0.5 ℃/s上升温至95 ℃。荧光通道检测选择:FAM和HEX(或VIC/JOE)通道。
1.4统计学处理采用多个样本率比较的χ2检验和四格表χ2检验(当n≥40,理论频数1≤T<5时,对χ2值进行连续性校正;当n≥40,理论频数T<1时,采用四格表的Fisher确切检验法),P<0.05为差异有统计学意义。
2结果
2.1抗体检测结果如表1所示,368例无偿献血者标本中检出HPV B19 IgG阳性92例,阳性率为25.00%;检出HPV B19 IgM阳性2例,阳性率为0.54%,男女性别间比较差异无统计学意义(P>0.05);IgG与IgM阳性率比较,差异有统计学意义(P<0.01)。如表2所示,按年龄分组,两组间IgG阳性率比较差异有统计学意义(P<0.05),IgM阳性率比较差异无统计学意义(P>0.05)。

表1 不同性别HPV B19 IgG和IgM的检测结果
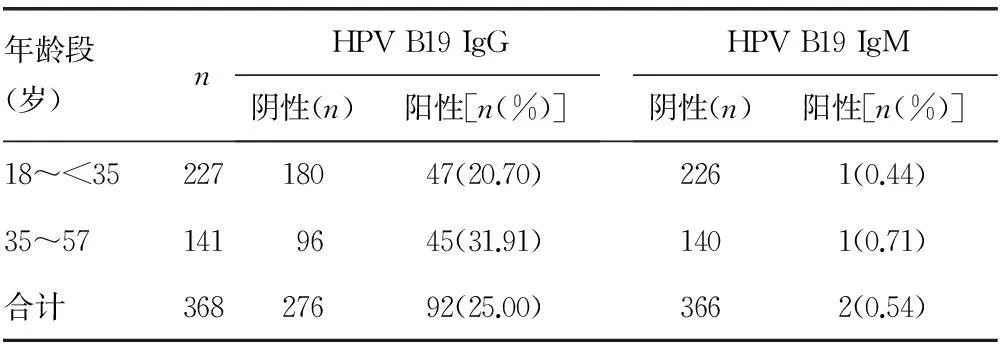
表2 不同年龄人群间HPV B19 IgG和IgM的检测结果
2.2DNA检测94例抗体阳性标本中,检测HPV B19 DNA 阳性4例,阳性率为4.26%,经四格表的Fisher确切检验,按组间抗体阳性比较,差异有统计学意义(P<0.01)。见表3。

表3 94例HPV B19 IgG和IgM阳性标本HPV B19
-:该项无数据。
3讨论
HPV B19是唯一致人感染的细小病毒,多表现为隐性感染,可引起小儿免疫型血小板减少症(ITP)、儿童传染性红斑,孕妇贫血、流产、死胎,成人关节炎或关节病、贫血、肝炎、再生障碍性贫血危象等严重疾病[4-6]。HPV B19是一种容易变异的病毒,对热稳定,56 ℃ 30 min仍可存活,对甲醛敏感,对常规血浆灭活方法不敏感[6]。国内血液制品生产工艺中使用了灭活/去除HPV B19的方法,但有研究中筛查的原料血浆及血液制品中仍检出了HPV B19 DNA[7]。国内多地开展了HPV B19检测的研究性实验。王志效等[8]检测济宁地区无偿献血者HPV B19 IgG抗体、IgM抗体阳性率分别为36.15%、5.94%,抗体阳性标本DNA 阳性率为0.83%。鲍海娥等[9]检测三峡地区献血员HPV B19 IgG阳性率43.36%,HPV B19 IgM阳性率2.46%。刘运保等[10]检测376例广东瑶族献血者血液,HPV B19 IgG阳性率为29.26%,42例HPV B19 IgG阳性血液中HPV B19 DNA阳性率为9.52%。检测结果显示,不同地区献血人群均存在着HPV B19感染。
遏制经输血传播疾病是血液安全的重要任务。欧洲药品管理局(EMA) 2011年发布的《血浆衍生制品指南》要求病毒灭活血浆和抗-D免疫球蛋白需进行B19核酸检测[11],欧洲药典要求病毒灭活血浆B19水平应小于104IU/mL[11]。但除了我国《血站技术操作规程(2012版)》规定必检的项目(HBV表面抗原或DNA、HCV抗体或RNA、HIV抗体或RNA、梅毒抗体)外,HPV B19等多种经血传播疾病未经检测,对血液制品的安全构成了一定的威胁,直接影响用血者的健康。目前,本市采供血机构已经建立了完善的血液质量管理体系,采血前对献血者进行详细的健康征询,对有流感样、红斑、急性关节炎、贫血、肝炎等症状者严格筛选,坚持从低危献血者中采集血液。本市HPV B19 IgG阳性率远高于IgM,IgG阳性率组间年龄结果比较,高龄组高于低龄组,显示既往感染率较高,急、慢性感染率均较低,慢性感染率与年龄呈正相关。IgM 抗体阳性组DNA 检出率明显高于IgG 阳性组,与王志效等[8]报道相一致。IgM可用于HPV B19感染的急性期检测,本试验HPV B19 IgM阳性2例病毒载量均大于1×106copy/mL,提示有较强的传染性;IgG阳性率略低于省内其他地区,HPV NDA检测阳性2例,病毒载量低于IgM阳性标本病毒载量。若高HPV B19病毒载量的血液输给患者,可能会造成患者感染。
目前临床用血量不断上升,血液供求关系紧张,如果全部献血者血液均进行HPV B19 IgG筛查,则血液的阳性率大大攀升,大量安全的血液将被报废浪费,而且Kleinman等[12]研究数据表明含B19特异性抗体的成分血在HPV B19 DNA<106IU/mL 时不会导致感染HPV B19。凌辉生等[13]初步建立了HPV B19 IgM抗体间接ELISA检测方法。建立HPV B19 IgM加HPV B19 DNA的血液筛查模式,则更有利于遏制HPV B19通过输血传播,需要解决的问题是降低HPV B19相关检测试剂盒的费用,提高试剂特异性和和减少假阳性率。同时,采供血机构应建立HPV B19 IgM抗体阴性和病毒核酸检测阴性的资料库,使孕妇、婴幼儿、免疫力低下者、再生障碍性贫血危象等患者得到更加安全、有效的血液。
参考文献
[1]Brown KE.The expanding range of parvoviruses which infect humans[J].Rev Med Virol,2010,20(4):231-244.
[2]彭燕.人微小病毒B19及其研究新进展[J].现代医药卫生,2013,29(7):1021-1023.
[3]Hourfar MK,Mayr-Wohlfart U,Themann A,et al.Recipients potentially infected with parvovirus B19 by red blood cell products[J].Transfusion,2011,51(1):129-136.
[4]李亚飞,赵晓明,卢洁,等.人微小病毒B19-DNA定量检测在儿童免疫性血小板减少症中的意义[J].中国小儿血液与肿瘤杂志,2015,20(1):38-40,44.
[5]周惠玲,程秀华,甘燕玲,等.妊娠早期人微小病毒B19感染对孕妇血液系统的影响[J].贵阳中医学院学报,2015,37(2):20-23.
[6]Corcoran A,Doyle S.Advances in the biology,diagnosis and host-pathogen interactions of parvovirus B19[J].J Med Microbiol,2004,53(Pt 6):459-475.
[7]郑荣斌,余燕.血液制品中人细小病毒B19基因的检测与分析[J].中国医药科学,2015,5(13):151-153.
[8]王志效,周贝贝,张娜,等.济宁地区无偿献血者人细小病毒B19感染的相关研究[J].公共卫生与预防医学,2015,26(3):4-7.
[9]鲍海娥,杨伯家,潘修银,等.三峡地区献血人员人细小病毒B19感染率调查[J].临床血液学杂志:输血与检验,2015,28(2):289-291.
[10]刘运保,梁伟文,喻红玲,等.瑶族无偿献血者人细小病毒B19感染研究[J].中国输血杂志,2014,27(3):306-307.
[11]Jia J,Ma Y,Zhao X,et al.Prevalence of human parvovirus B19 in Chinese plasma pools for manufacturing plasma derivatives[J].Virol J,2015,12(1):162-164.
[12]Kleinman SH,Glynn SA,Lee TH,et al.A linked donor-recipient study to evaluate parvovirus B19 transmission by blood component transfusion[J].Blood,2009,114(17):3677-3683.
[13]凌辉生,储迅涛,曾敏霞.人细小病毒B19 IgM抗体间接ELISA检测方法的初步建立[J].检验医学与临床,2014,11(5):583-585,588.
Human parvovirus B19 detection in voluntary blood donors of Foshan City*
YanJunxiong1,WuWeijiang2△,ZhouJiangxin2,LuJin2
(1.TheFourthPeople′sHospitalofFoshan,Foshan,Guangdong528000,China;2.FoshanBloodCenter,Foshan,Guangdong528000,China)
Abstract:ObjectiveTo investigate the infection status of human parvovirus B19(HPV B19) in voluntary blood donors of Foshan City.MethodsThe HPV B19 IgG and IgM antibodies of voluntary blood donors were detectd by using ELISA.Real-time PCR assay was applied to detect HPV B19 DNA on HPV B19 IgG and/or IgM antibody positive specimens.ResultsThere were 92 HPV B19 IgG positive cases in 368 specimens,positive rate was 25.00%;and the HPV B19 IgM positive cases were 2,positive rate was 0.54%.4 positive cases were detected in 94 antibody positive specimens,positive rate was 4.26%.ConclusionHPV B19 infection of blood donation person in Foshan is high,new infections and chronic infection rate are low.HPV B19 viral loads are low in people with chronic infection.
Key words:blood donors;human parvovirus B19;serological determination;real time PCR
(收稿日期:2016-01-05)
DOI:10.3969/j.issn.1673-4130.2016.08.010
文献标识码:A
文章编号:1673-4130(2016)08-1039-03
基金项目:广东省佛山市卫生和计划生育局科技项目(2014160)。
作者简介:严军雄,男,主管检验技师,主要从事血液检测和输血技术研究。△通讯作者,E-mail:wwjzqcn1@163.com。
