溶藻弧菌感染小鼠导致的炎性因子变化*
2016-05-26刘晓斐宗玉龙胡成进
武 静,刘晓斐,宗玉龙,曹 源, 胡成进
(济南军区总医院实验诊断科,山东济南 250031)
·论著·
溶藻弧菌感染小鼠导致的炎性因子变化*
武静,刘晓斐#,宗玉龙,曹源, 胡成进△
(济南军区总医院实验诊断科,山东济南 250031)
摘要:目的探讨溶藻弧菌感染小鼠后引起的炎性因子水平变化及意义。方法建立溶藻弧菌ATCC17749T腹腔注射感染BALB/c小鼠动物模型,进行血液学和肝功能指标检测以及肝脏病理学检查,采用炎性因子抗体芯片进行炎性因子检测。结果溶藻弧菌ATCC17749T感染BALB/c小鼠的半数致死量为1×109 CFU。感染组小鼠血液白细胞和血小板数目均降低,差异有统计学意义(P<0.05);红细胞和血红蛋白量、丙氨酸氨基转移酶、天门冬氨酸氨基转移酶水平均升高,差异有统计学意义(P<0.05);病理学观察发现,溶藻弧菌感染可引起小鼠肝、肺严重损伤;炎性因子检测筛选出20种显著变化的炎性因子,其中细胞因子信号值大于200,倍数改变大于10的有8种炎性因子,分别为KC、IL-6、RNATES、IL-12、Eotaxin、G-CSF、MIP-1α、Mig。结论该研究所筛选出的溶藻弧菌感染小鼠后变化的炎性因子为溶藻弧菌炎症机制的研究提供了理论依据。
关键词:溶藻弧菌;动物实验;炎性因子
溶藻弧菌是海洋弧菌科中最为常见的革兰阴性致病菌,广泛分布于世界各地海域和口岸处,可引起鱼类发生细菌性鱼病,也可引起海洋作业人员伤口海水浸泡感染、中耳炎、眼内炎、胃肠炎和败血症等疾病[1-3]。溶藻弧菌感染主要发生在夏季,但随着全球变暖的趋势,溶藻弧菌感染的季节范围逐年扩大[4]。由于其致病特点不同于陆地致病菌,对临床抗菌药物的敏感性不同,而且感染后鉴定困难,不易及时救治,因此溶藻弧菌越来越受到人们关注。由于溶藻弧菌感染后均表现为局部或全身的炎性反应,具体的炎性因子变化尚不明确,因此,研究溶藻弧菌的炎性因子对于溶藻弧菌的治疗和预防具有十分重要的意义。本研究建立了溶藻弧菌腹腔注射感染BALB/c小鼠动物模型,通过血液学和肝功能指标检测,组织病理学观察以及炎性因子检测来探讨溶藻弧菌诱导的炎性反应。
1材料与方法
1.1实验菌株与动物本研究使用了溶藻弧菌ATCC17749T,为模式菌株,购自中国海洋微生物菌种保藏管理中心。实验动物为SPF级BALB/c小鼠,雌性,6~8周龄,体质量(21±1)g,购买于山东大学动物实验中心,适应性饲养1周。
1.2方法
1.2.1半数致死量测定根据文献[5]中的方法,细菌在碱性蛋白胨水中过夜培养后,收集细菌悬液将其浓度调整为1×1010、5×109、1×109、5×108、1×108CFU/mL的菌悬液备用。取小鼠分为实验组(分设5个浓度梯度)与对照组,每组10只,实验组分别腹腔注射上述不同浓度的溶藻弧菌进行感染,每只0.1 mL;对照组注射等体积无菌碱性蛋白胨水。观察24 h,并记录各浓度小鼠的死亡情况。
1.2.2血液学、肝功能指标检测溶藻弧菌致死剂量感染小鼠后,于小鼠濒死前收集小鼠眼球血。采用Sysmex KX-21血液分析仪进行血液学检测;剩余眼球血于5 000 r/min离心10 min,分离血清后采用贝克曼DXC800生化分析仪检测丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)。
1.2.3脏器组织病理学观察收集小鼠组织脏器如心脏、肺、肝脏、脾脏、肾脏、胃、小肠,采用甲醛溶液固定24 h,石蜡包埋、切片后进行HE染色,光镜下观察组织病理学改变。
1.2.4溶藻弧菌感染小鼠后炎性因子检测溶藻弧菌致死剂量感染小鼠后,于小鼠濒死前收集小鼠血清,使用RayBiotech公司小鼠炎性因子抗体芯片进行炎性因子检测,包括干扰素-γ(IFN-γ)、白细胞介素(IL)-1α、IL-1β、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-10、IL-12p70、IL-13、IL-15、IL-17、IL-21、角质细胞起源的趋化因子(KC)、瘦素(Leptin)、脂多糖诱导的CXC趋化因子(LIX)、单核细胞趋化蛋白(MCP)-1、MCP-5、巨噬细胞集落刺激因子(M-CSF)、单核细胞因子(Mig)、巨噬细胞炎性蛋白(MIP)-1α、MIP-1γ、血小板因子-4(PF-4)、调节正常T细胞表达和分泌因子(RANTES)、干扰素诱导T-细胞α亚族趋化剂(I-TAC)、T细胞活化蛋白(TCA-3)、组织源性基质金属蛋白酶抑制剂(TIMP-1)、肿瘤坏死因子(TNF)-α、肿瘤坏死因子受体(TNFR)Ⅰ、TNFRⅡ、B淋巴细胞趋化因子(BLC)、CD30L、嗜酸性粒细胞趋化因子(Eotaxin)、Eotaxin-2、Fas L、粒细胞集落刺激因子(G-CSF)、粒-巨噬细胞集落刺激因子(GM-CSF)、细胞间黏附分子-1(ICAM-1)。检测步骤按照操作说明书进行。以细胞因子信号值大于200,倍数改变大于2或小于0.5为差异因子进行筛选。
1.3统计学处理采用SPSS19.0统计学软件进行数据处理,计量资料的组间比较采用t检验,P<0.05为差异有统计学意义。
2结果
2.1BALB/c小鼠感染后的一般情况实验组注射溶藻弧菌菌液2 h后开始出现毛发竖立、腹部颤抖、呼吸急促、背弓、蜷缩少动、进食减少等情况,症状的轻重与注射的细菌量呈正相关,死亡或活杀前上述情况都未好转或减轻。对照组精神状态良好,无上述症状,无死亡。
2.2半数致死量检测为确定溶藻弧菌腹腔注射感染小鼠的感染剂量及感染时间,本课题组进行了半数致死量实验。根据Reed-Muench法计算得,小鼠的半数致死量为1×109CFU,本课题组的后续实验采用剂量为每只1×109CFU。
2.3溶藻弧菌感染后小鼠主要脏器的病理改变为观察溶藻弧菌感染对小鼠脏器的病理改变,本课题组取小鼠心、肺、肝、脾、肾、胃、小肠组织标本进行HE染色、镜检。腹腔注射感染溶藻弧菌后,可以引起小鼠多个脏器的损伤,以肝脏和肺脏的损伤较重,炎性反应明显。肝细胞出现疏松、肿胀、坏死,炎症细胞浸润;肺脏淤血、水肿,肺泡塌陷,炎症细胞浸润,见图1。
2.4溶藻弧菌感染对小鼠全血细胞分析及生化指标的影响溶藻弧菌感染组小鼠血液中白细胞和血小板水平均低于对照组,差异有统计学意义(P<0.05);红细胞和血红蛋白水平均高于对照组,差异均有统计学意义(P<0.05);血清中ALT和AST水平也高于对照组,差异有统计学意义(P<0.05)。这些检测结果进一步验证了肝脏炎性病理损伤,提示溶藻弧菌感染后肝功能受损。见图2。
2.5炎性因子的芯片检测分析本课题组收集了溶藻弧菌感染后的小鼠血清,采用炎性因子抗体芯片检测了40种炎性因子水平的变化。以细胞因子信号值大于200,倍数改变大于2或小于0.5作为筛选条件,血清中BLC、Eotaxin、G-CSF、IL-1α、IL-6、IL-10、IL-12p40/p70、IL-17、I-TAC、KC、LIX、MCP-1、Mig、MIP-1α、RANTES、TCA-3、TIMP-1、TNF-α、sTNFRⅠ、sTNFRⅡ20种炎性因子水平增加。结果提示,溶藻弧菌感染能够引起大量炎性因子显著增加。其中细胞因子信号值大于200,倍数改变大于10的有8种炎性因子:KC、IL-6、RNATES、IL-12、Eotaxin、G-CSF、MIP-1α、Mig。

图1 溶藻弧菌致小鼠肝、肺损伤的病理学
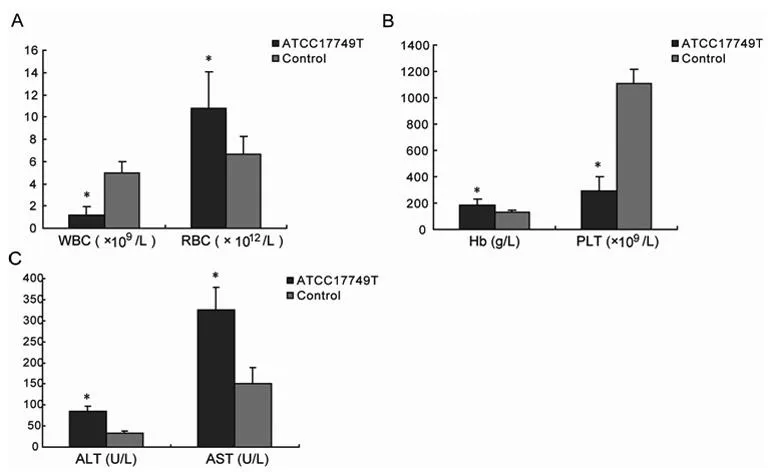
图2 溶藻弧菌感染小鼠后血细胞和肝功能指标检测
3讨论
大量临床资料显示,溶藻弧菌感染后可导致局部或全身的炎性反应,目前,具体的炎性因子尚不明确。因此,迫切需要研究溶藻弧菌感染后导致的炎性因子变化,以期为临床诊治提供一定的理论依据。
病理切片显示,感染后肝细胞坏死,水肿,炎性细胞浸润,并且肝功能指标ALT和AST水平也明显升高。这些均提示感染后肝脏出现明显炎性反应。这可能是由于细菌感染后由门静脉进入肝脏,肝脏成为入侵的首要器官,可能更容易受损,而具体机制需要进一步探讨。
根据文献报道及本研究实验结果,笔者推测当大量的溶藻弧菌被注入到小鼠腹腔后,溶藻弧菌被腹膜吸收后进入血液,通过血液循环到达全身各个组织脏器,引起炎性反应。为进一步探讨溶藻弧菌感染小鼠的炎性反应机制,采用了炎性因子抗体芯片技术检测小鼠血液中的炎性因子改变。本研究共检测了40种炎性因子,筛选出20种炎性因子水平明显增加。其中细胞因子信号值大于200,倍数改变大于10的共有8种炎性因子,分别为KC、IL-6、RNATES、IL-12、Eotaxin、G-CSF、MIP-1ɑ、Mig。
KC属于CXC趋化因子家族,可通过与趋化因子受体2(CXCR2)结合将中性粒细胞趋化到炎症部位发挥作用[6]。有研究报道在CXCR2缺乏小鼠的胰腺炎、肺损伤和关节炎模型中,中性粒细胞的浸润明显减弱[7]。IL-6是一种多功能细胞因子,可以激活巨噬细胞[8],是造血系统、神经内分泌系统及免疫系统的主要成员[9]。在葡萄球菌感染时,IL-6过多分泌会导致小鼠的死亡[10]。在细菌性脑膜炎时,IL-6能够增加血脑屏障的通透性,并能影响白细胞聚集及血管通透性[9]。
RNATES是促炎细胞因子趋化家族的成员[11],对T细胞、嗜酸性粒细胞、嗜碱性粒细胞以及单核细胞具有趋化性,在白细胞向炎症部位聚集的过程中发挥着重要作用。IL-12是一种异源二聚体细胞因子,能诱导NK细胞和T细胞产生干扰素,激活肝内外单核巨噬细胞释放TNF等多种炎症介质,大量的TNF作为一种炎症介质和内毒素休克介质可导致机体出现多种免疫病理损伤,加重肝脏疾病发展[12]。
Eotaxin被认为是已发现的具有嗜酸性粒细胞趋化活性最强的趋化因子,其对嗜酸性粒细胞的作用是通过与特异性受体CCR3结合介导的。研究表明,CCR3- Eotaxin系统在过敏性炎症(如变应性鼻炎、支气管哮喘)的形成中起着重要作用[13-14]。G-CSF是调节粒系祖细胞增殖分化并能增强成熟粒细胞功能的细胞因子[15]。有研究者指出,G-CSF是确定细菌感染存在及其在体内繁殖与否的一项敏感指标[16]。
MIP-1ɑ属于趋化因子家族,为巨噬细胞受到刺激后分泌的主要炎性因子[17]。MIP-1α可以活化中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞引起炎性反应,其主要作用在于调节免疫炎症反应。趋化因子Mig又称为CXCL9,属于趋化因子家族,通过与其特异性G蛋白偶联受体CXCR3的结合来发挥趋化作用。有研究报道,Mig参与了幽门螺杆菌相关性胃炎的炎细胞浸润[18]。此外,Mig还参与了肝脏炎症细胞的浸润,介导了肝组织损伤,在慢性乙肝发病机制中起一定作用[19]。
溶藻弧菌感染后诱导产生多种细胞因子,这些细胞因子直接或间接参与炎性反应,以抵御溶藻弧菌的感染。而促炎细胞因子大量产生也对机体造成了病理性损伤。这些细胞因子一方面可促进炎性细胞的渗出与趋化,如KC、RNATES、Eotaxin、Mig可吸引中性粒细胞、单核-吞噬细胞、嗜酸性粒细胞、嗜碱性粒细胞等炎性细胞迁移至炎症病灶。另一方面可激活炎性细胞,如IL-6、IL-12、MIP-1-ɑ、Eotaxin可以激活单核-吞噬细胞、中性粒细胞等,增强它们的吞噬杀伤功能,促进他们释放炎症蛋白和炎症介质,直接参与炎症过程。
炎性因子与溶藻弧菌致病过程密切相关,它们构成了复杂的网络,相互促进或抑制,从而在溶藻弧菌的致病过程中发挥作用。
总之,本实验建立了溶藻弧菌腹腔注射感染小鼠模型,发现溶藻弧菌感染后可以引起肝脏和肺脏的炎性损伤,发现了一些重要的炎性因子。本实验为研究溶藻弧菌的炎症机制提供了实验数据,筛选出的炎性因子可能成为监测抗炎症治疗的指标。期望更多的同行能够关注溶藻弧菌的炎症机制研究,为溶藻弧菌的诊断、治疗和预防提供新的理论依据。
参考文献
[1]Hlady WG,Klontz KC.The epidemiology of Vibrio infections in Florida,1981-1993[J].J Infect Dis,1996,173(5):1176-1183.
[2]Morris JG,Black RE.Cholera and other vibrioses in the United States[J].N Engl J Med,1985,312(6):343-350.
[3]Ardiç N,Ozyurt M.Case report:Otitis due to Vibrio alginolyticus[J].Mikrobiyol Bul,2004,38(1/2):145-148.
[4]Sganga G,Cozza V,Spanu T,et al.Global climate change and wound care:case study of an off-season vibrio alginolyticus infection in a healthy man[J].Ostomy Wound Manage,2009,55(4):60-62.
[5]Kelly GE,Lindsey JK.Robust estimation of the median lethal dose[J].J Biopharm Stat,2002,12(2):137-147.
[6]Devalaraja RM,Nanney LB,Du J,et al.Delayed wound healing in CXCR2 knockout mice[J].J Invest Dermatol,2000,115(2):234-244.
[7]Vieira SM,Lemos HP,Grespan R,et al.A crucial role for TNF-alpha in mediating neutrophil influx induced by endogenously generated or exogenous chemokines,KC/CXCL1 and LIX/CXCL5[J].Br J Pharmacol,2009,158(3):779-789.
[8]Su WL,Perng WC,Huang CH,et al.Identification of cytokines in whole blood for differential diagnosis of tuberculosis versus pneumonia[J].Clin Vaccine Immunol,2010,17(5):771-777.
[9]Wang T,Secombes CJ.Identification and expression analysis of two fish-specific IL-6 cytokine family members,the ciliary neurotrophic factor (CNTF)-like and M17 genes,in rainbow trout Oncorhynchus mykiss[J].Mol Immunol,2009,46(11/12):2290-2298.
[11]Donlon TA,Krensky AM,Wallace MR,et al.Localization of a human T-cell-specific gene,RANTES (D17S136E),to chromosome 17q11.2-q12[J].Genomics,1990,6(3):548-553.
[12]孙敬,洪杰华,郑世民.IL-12及其免疫调节作用[J].动物医学进展,2010,31(2):111-114.
[13]袁群霞,李惠,单葵.慢性荨麻疹疹患者外周血eotaxin、mcp-1的表达及意义[J].重庆医科大学学报,2010,35(12):1888-1890.
[14]李静,李玉琴.趋化因子eotaxin及其受体与支气管哮喘[J].国际儿科学杂志,2006,33(6):406-408.
[15]冯献启,高美华,王海燕,等.GCSF在恶性卵巢肿瘤患者中表达的意义[J].滨州医学院学报,1999,22(5):423.
[16]李玉芳,黄建宁,刘晓彦,等.粒细胞集落刺激因子在肝硬化失代偿中的检测及临床意义[J].宁夏医学杂志,2000,22(8):451-452.
[17]孙鑫波,刘朝东.MIP-1α与MMP-9在免疫炎症反应中作用及其关系研究进展[J].中国免疫学杂志,2012,28(5):474-477.
[18]胡友莹,赵金红,汪雪峰,等.幽门螺杆菌相关性胃炎患者趋化因子IP-10、Mig的表达[J].中国人兽共患病学报,2011,27(7):641-644.
[19]赵金红,王健,江水清,等.慢性乙型肝炎患者CXC趋化因子Mig的表达[J].南方医科大学学报,2006,26(11):1589-1592.
The changes of inflammatory factors in mice infected with Vibrio alginolyticus*
WuJing,LiuXiaofei#,ZongYulong,CaoYuan,HuChengjin△
(DepartmentofLaboratoryMedicine,GeneralHospitalofJinanMilitaryRegionofPLA,Jinan,Shandong250031,China)
Abstract:ObjectiveTo investigate the changes of inflammatory factors in mice infected with Vibrio alginolyticus.MethodsEstablished a V.alginolyticus ATCC17749 T-infected mouse model through intraperitoneal injection,then performed the median lethal dose experiment,the detection of hematological and liver function indicators,histopathologic evaluation and inflammatory cytokine detection.ResultsThe median lethal dose of V.alginolyticus ATCC17749T was 1×109 CFU by intraperitoneal injection.The dose of 1×109 CFU per mouse was adopted in the following study.WBC and platelet numbers significantly decreased after infection (P<0.05),RBC number and hemoglobin content significantly increased(P<0.05) and ALT,AST significantly increased after V.alginolyticus infection(P<0.05);light microscopy observation revealed that,hepatic cell and pulmonary tissue suffered serious injury after infection。Through the detection of antibody array,the levels of 20 inflammatory factors were found changed significantly.8 of them including KC,IL-6,RNATES,IL-12,Eotaxin,G-CSF,MIP-1ɑ,Mig,the expression of which increased more than 10 times.ConclusionThe inflammatory factors analysed in the paper provide a theoretical basis for the study of the inflammatory mechanism of Vibrio alginolyticus infection.
Key words:Vibrio alginolyticus;animal experiment;inflammatory factors
(收稿日期:2015-10-28)
DOI:10.3969/j.issn.1673-4130.2016.08.001
文献标识码:A
文章编号:1673-4130(2016)08-1017-03
基金项目:全军医学科技“十二五”重点项目(BWS12J014)。
作者简介:武静,女,检验医师,主要从事海洋致病菌致病机制的相关研究;刘晓婓,女,主管检验师,主要从事海洋致病菌的致病机制及快速诊断的相关研究。#:并列第一作者。△通讯作者,E-mail:405045650@qq.com。
