S100A6基因过表达慢病毒载体的构建、转染及鉴定
2016-05-25马力天南岩东吴大方
李 洁, 胡 进, 马力天,3, 叶 欣, 南岩东, 吴大方*
(1解放军第451医院内分泌科,西安 710054; 2解放军68222部队卫生队; 3第四军医大学唐都医院中医科暨中西医结合肿瘤科; 4第四军医大学唐都医院呼吸与危重症医学科; *通讯作者, E-mail:wudafangll@sohu.com;△共同通讯作者,E-mail:nanyandong2008@163.com
S100A6基因过表达慢病毒载体的构建、转染及鉴定
李洁1, 胡进2, 马力天2,3, 叶欣1, 南岩东4△, 吴大方1*
(1解放军第451医院内分泌科,西安710054;2解放军68222部队卫生队;3第四军医大学唐都医院中医科暨中西医结合肿瘤科;4第四军医大学唐都医院呼吸与危重症医学科;*通讯作者, E-mail:wudafangll@sohu.com;△共同通讯作者,E-mail:nanyandong2008@163.com
摘要:目的构建S100A6基因重组慢病毒质粒,经293T细胞包装为重组慢病毒颗粒,并感染A549细胞,实现在细胞中高效、稳定表达。方法PCR扩增S100A6基因序列,将目的基因与酶切线性化载体pLenO-DCE定向连接,转化E.Coli DH5α感受态细胞,对阳性重组子进行DNA测序及比对。将构建成功的目的质粒和辅助包装质粒共转染293T细胞生产病毒液,荧光显微镜观察报告基因在293T细胞中的荧光表达,判断重组慢病毒的感染效率。用得到的病毒液转染人肺腺癌A549细胞,real-time PCR和Western blot检测转染A549细胞后S100A6蛋白和S100A6 mRNA的表达。结果测序提示重组慢病毒质粒构建成功;荧光显微镜观察显示在包装细胞中获得较高的转染效率。real-time PCR检测显示A549细胞中有S100A6 mRNA表达;Western blot显示S100A6蛋白在A549细胞中稳定表达。结论成功构建S100A6基因慢病毒表达载体,并成功感染A549细胞,实现在细胞中高效、稳定表达,为S100A6基因功能及特性的研究和探索提供了实验基础。
关键词:慢病毒载体;A549细胞;S100A6基因
S100A6是S100蛋白家族中的一员,这些成员广泛参与了细胞增殖、迁移、运动和细胞周期的调节等过程。S100A6可能参与了钙离子的代谢,并作为钙调蛋白的结合蛋白[1-4]。研究表明,S100A6蛋白的表达在一些肿瘤细胞中是上调的,比如胃癌[5,6],甲状腺癌[7],肝癌[8],乳腺癌[9]等。S100A6可能在肿瘤的发生发展过程中扮演着重要角色,尤其是在肿瘤细胞向周围组织浸润的过程中[5,10]。本实验将构建S100A6基因慢病毒载体,转染目的细胞后表达S100A6,为下一步分子机制的研究提供实验参考。
1材料与方法
1.1主要试剂与仪器
pLenO-DCE Vector(中国Invabio公司,cat.No.#26208-2),DL2000 DNA ladder(日本Takara),琼脂糖(中国赛百盛公司),BamHⅠ(Takara公司),MscⅠ(美国NEB公司),SmiⅠ(SwaⅠ)(Takara),NucleoBond Xtra Midi Plus(德国MACHEREY-NAGEL公司),AxyPrep质粒小量制备试剂盒(美国Axygen公司),制备感受态试剂盒(加拿大BIOSCIENCES),包装细胞293T细胞株(中科院上海细胞所),大肠埃希菌DH5α(美国Invitrogen公司),胎牛血清(美国PAA公司),胰蛋白酶,A549人肺腺癌细胞系由Griad通过肺癌组织移植培养建系。实时荧光定量PCR仪(德国Eppendorf公司),荧光倒置显微系统(德国Leica公司),超高速离心机(美国Beckman公司),测序仪(Invitrogen公司),稳压DNA电泳仪(美国BioRad公司),凝胶成像仪(博迅仪器公司)。
1.2PCR扩增S100A6
参考GenBank中S100A6的cDNA编码序列(NM_014624)设计引物,引物由上海生工生物工程技术服务有限公司合成。S100A6上游引物序列:5′-ATGGCATGCCCCCTGGAT-3′;下游引物序列:5′-TCAGCCCTTGAGGGCTTC-3′。以含有S100A6基因的cDNA库为模板,扩增S100A6基因序列。PCR反应参数:94 ℃预变性2 min、98 ℃变性10 s、58 ℃退火30 s、68 ℃延伸30 s,共30个循环;68 ℃保温5 min。琼脂糖凝胶电泳鉴定并分离产物,DNA凝胶回收试剂盒回收并纯化S100A6片段。
1.3重组慢病毒质粒pLenO-DCE-S100A6载体构建
使用SmiⅠ对pLenO-DCE载体进行酶切,使其线性化。反应体系为:SmiⅠ(10 U/μl)1.5 μl,10×H Buffer 4.0 μl,BSA 0.4 μl,Plasmid DNA(500 ng/μl)15.0 μl,dH2O 19.1 μl;反应条件:25 ℃,4 h。将酶切产物过柱纯化,琼脂糖凝胶电泳并分离产物。pLenO-DCE载体和S100A6基因酶切产物进行连接反应,连接反应体系:pLenO-DCE载体DNA 1 μl,S100A6基因DNA片段1 μl,10×T4噬菌体DNA连接酶缓冲液1 μl,T4噬菌体DNA连接酶1 μl,dH2O 7 μl;反应条件:16 ℃,12 h。
1.4重组子的筛选与鉴定
常规操作方法转化E.ColiDH5α感受态细胞,根据Axygen质粒抽提试剂盒方法抽提质粒。PCR扩增重组质粒,反应条件:94 ℃预变性2 min,94 ℃变性30 s,60 ℃退化30 s,72 ℃延伸30 s,30个循环;72 ℃延伸6 min。产物琼脂糖凝胶电泳,筛选阳性克隆条带。对阳性pLenO-DCE-S100A6重组体使用BamH Ⅰ单切鉴定,反应体系:BamH Ⅰ(10 U/μl)0.5 μl,MscⅠ 0.5 μl,10×Buffer 2.0 μl,BSA 0.2 μl,Plasmid DNA(500 ng/μl)8.0 μl,ddH2O 8.8 μl,总溶液20 μl;反应条件:37 ℃,4 h。对阳性重组子进行DNA测序及比对。
1.5慢病毒颗粒包装和浓缩
该慢病毒载体系统包括:pRsv-EV、pMDlg-pRRE、pMD2G、Transfer Vector,其中绿色荧光蛋白(GFP)被表达在慢病毒表达质粒中,前3个为病毒包装所必需。对这4种质粒载体进行高纯度无内毒素的抽提。取对数生长期的293T细胞,胰酶消化后接种于10 cm细胞培养皿(每个平皿接种细胞约为2×106-2.5×106),置于37 ℃,50 ml/L CO2培养箱内培养。当细胞密度达60%-70%时进行转染,将各质粒和磷酸钙的混合液转移至含单层细胞的培养液中,混匀,培养6-8 h后弃去该培养液,加入PBS 15 ml,轻摇后弃去,重复3次。更换培养基,每瓶细胞中加入含10 %FBS的细胞培养液5 ml,培养48 h;收集转染后72 h的293T细胞上清液,于4 ℃,4 000×g离心10 min,收集离心后的上清液,将上清液以0.45 μl滤器过滤;于40 ml超速离心管中,4 ℃,25 000 r/min离心2 h;而后以冰PBS液或DMEM重悬病毒沉淀,4 ℃溶解过夜。
1.6慢病毒的滴度测定
选用逐孔稀释滴度测定法,首先293T细胞进行铺板,使用96孔板,每个孔中加1×105个细胞,体积为100 μl。准备7-10个无菌EP管,在每个管中加入90 μl的新鲜培养基;向第一个管中加入待测定的病毒原液10 μl,混匀后,取10 μl加入到第二个管中。然后进行相同的操作直到最后一管;选取所需的细胞孔,吸去90 μl培养基并加入稀释后的病毒溶液。培养24 h,加入新鲜培养基100 μl。继续培养96 h,荧光显微镜观察其生长状况,取0.1 μl pLenO-DCE-S100A6慢病毒感染的293T细胞,应用流式细胞仪检测阳性细胞比率,并计算病毒滴度。
1.7病毒感染人肺腺癌A549细胞
将人肺腺癌A549细胞培养于含100 g/L胎牛血清的RPMI1640培养液中,取对数生长的A549细胞接种于6孔板中,待细胞生长融合约60%进行转染。共分为3组:空白对照组(NC组)、空质粒转染(GFP组)转染只携带GFP而不携带目的基因的空载质粒、目的基因质粒转染组(pLenO-DCE-S100A6组)转染携带目的基因及GFP的质粒。
1.8real-time PCR检测A549细胞S100A6 mRNA表达
筛选后的细胞加入1 ml TRIzol,按照Trizol说明书提取RNA,测定总RNA的纯度,将RNA逆转录为cDNA,以适量cDNA为模板,在TaqDNA聚合酶催化PCR扩增。S100A6上游引物:5′-ATGGCATGCCCCCTGGAT-3′,下游引物为:5′-TGAGGGCTTCATTGTAGATC-3′;β-actin上游引物为:5′-GTGGGGCGCCCCAGGCACCA-3′,下游引物为:5′-CTCCTTAATGTCACGCACGATTTC-3′。扩增条件为:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,循环35次,72 ℃保温10 min,Bio-Rad CFX Manager 2.0软件分析实验数据。
1.9Western blot检测A549细胞S100A6蛋白表达
以细胞裂解液裂解筛选后的细胞,提取细胞总蛋白,测定蛋白的浓度,灌制12% SDS-聚丙烯酰胺凝胶,常规电泳,转膜,封闭,一抗(博士德,PB0716)(1∶200),4 ℃孵育过夜,二抗(1∶2 000),室温孵育2 h,化学荧光发光法显色。
1.10统计学分析
应用SPSS13.0软件进行统计学分析,不同组间S100A6相对表达量采用Studentt检验分析,以P<0.05表示差异具有统计学意义。
2结果
2.1PCR扩增S100A6基因
PCR成功扩增出S100A6序列DNA片段,电泳可见大小约250 bp的特异性条带(见图1)。
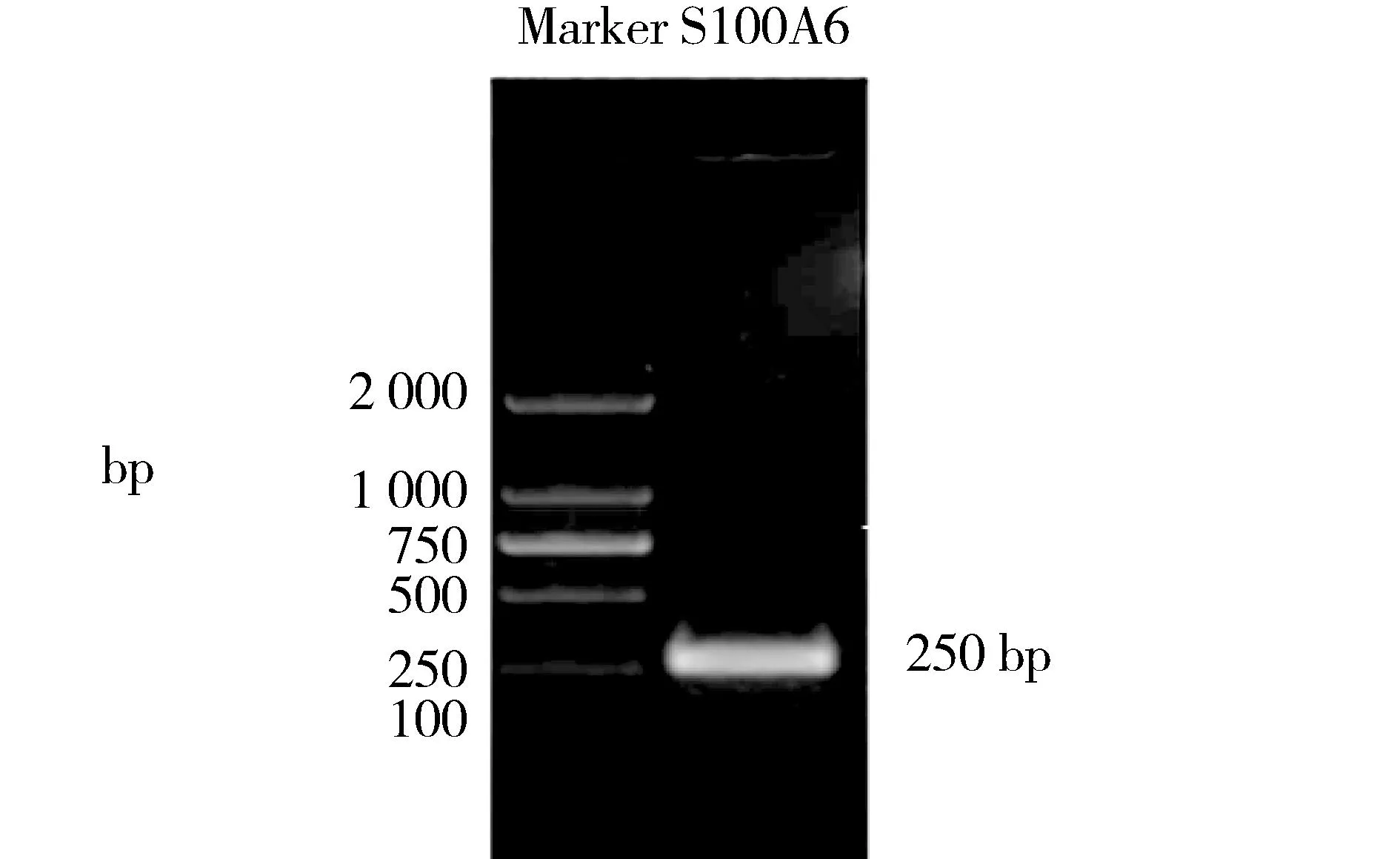
图1 PCR扩增S100A6基因产物凝胶电泳结果Figure 1 Gel electrophoresis of the PCR product
2.2重组质粒pLenO-DCE-S100A6 PCR扩增鉴定
pLenO-DCE-S100A6重组质粒PCR扩增,得到大小约270 bp阳性克隆(见图2)。

1,2,4-6,8.pLenO-DCE-S100A6;3.阴性对照(ddH2O); 7.空载体对照(pLenO-DCE);9.阳性对照(GAPDH);M.Marker图2 pLenO-DCE-S100A6重组质粒PCR扩增产物凝胶电泳分析Figure 2 Gel electrophoresis analysis of the PCR products of recombinant plasmid
2.3pLenO-DCE-S100A6阳性克隆测序
pLenO-DCE-S100A6的阳性克隆由南京金斯瑞生物科技有限公司测序,测序结果与克隆模板序列比对完全一致(图3)。
2.4慢病毒制备及滴度测定
pLenO-DCE-S100A6共转染293T细胞后24 h,荧光显微镜观察示细胞发出绿色荧光,48 h细胞内绿色激发荧光表达明显增强。取0.1 μl pLenO-DCE-S100A6慢病毒感染的293T细胞,应用流式细胞仪检测阳性细胞比率,计算得出病毒滴度为2.1×109TU/ml。
2.5A549细胞转染后S100A6 mRNA表达
real-time PCR检测显示,pLenO-DCE-S100A6组较NC组和GFP组具有更高的S100A6 mRNA的表达;pLenO-DCE-S100A6组与NC组和GFP组之间差异均有统计学意义(P<0.01),而NC组和GFP组之间差异无统计学意义(P>0.05)。

图3 pLenO-DCE-S100A6阳性克隆测序结果(第1-100碱基序列)Figure 3 The pLenO-DCE-S100A6 sequencing of the positive clones (bases sequence from 1 to 100)

图4 pLenO-DCE-S100A6慢病毒感染的293T细胞荧光表达检测 (×100)Figure 4 GFP expression in 293T cells 24 h and 48 h after infection (fluorescent microscope×100)

与NC组比较,*P<0.01;与GFP组比较,#P<0.01图5 A549细胞转染后S100A6 mRNA表达结果Figure 5 The mRNA expression of S100A6 gene in A549 cells
2.6A549细胞转染后S100A6蛋白表达
Western blot检测结果显示pLenO-DCE-S100A6组较NC组和GFP组具有更高的S100A6 蛋白表达(见图6)。
3讨论
S100A6为S100蛋白家族成员之一,可能参与了钙离子的代谢[11],并与细胞周期、细胞分化、增殖等活动相关[9,12]。S100A6在多种肿瘤细胞中表达异常,可以通过影响钙离子和一些信号通路如Wnt/β-Catenin等来调控肿瘤细胞[9]。

图6 A549细胞转染后S100A6蛋白表达结果Figure 6 The protein expression of S100A6 gene in A549 cells by Western blot
化疗是治疗肿瘤的重要手段,其主要作用在于抑制原发病灶的复燃和癌症的转移。然而,由于多重耐药(multiple drug resistance,MDR)的产生,使化疗效果大打折扣,达不到预期的效果。因此深入研究肿瘤细胞耐药的机制十分重要。有研究表明[13],S100A6与肿瘤细胞的耐药性有关,在胃癌细胞中,S100A6的低表达会使胃癌细胞的耐药性上升。S100A6与肿瘤细胞耐药性的关系极为复杂,与Ca2+关系较为密切[14],低表达的S100A6蛋白会增加细胞内游离Ca2+,解除对MDR1的抑制,MDR1基因能编码一种膜转运蛋白—P-糖蛋白(P-glycoprotein,P-gp),该蛋白具有泵的作用,可以将细胞内的药物泵出到细胞外,是MDR发生的重要机制[15]。
经典的Wnt信号通路与肿瘤的发生有密切联系[16],异常激活的Wnt信号通路导致beta-Catenin在细胞质内大量聚集,并进入细胞核,启动下游靶基因的转录,促进细胞增殖,诱导肿瘤的发生。S100A6与Wnt信号通路有着密切的联系,在多种肿瘤细胞中,高表达的S100A6和beta-Catenin常同时存在[17],S100A6可以直接与beta-Catenin相互作用,抑制beta-Catenin降解,这可能是导致beta-Catenin在细胞质内大量聚集的原因之一[18]。此外,S100A6在钙周期素结合蛋白(CacyBP/SIP)核转位的调节中起重要作用[19],CacyBP/SIP的核转位可促进肿瘤细胞增殖[20],高表达的S100A6可以与CacyBP/SIP结合,调节CacyBP/SIP的核转位,进而在肿瘤的发展中发挥重要作用[21]。
慢病毒作为载体可提高转染效率,可以实现稳定转染。本实验通过基因钓取方法从基因文库中获取S100A6基因,成功构建S100A6基因慢病毒载体,并成功地转染了A549细胞,为后续分子生物学研究提供参考。
参考文献:
[1]Donato R.S100:a multigenic family of calcium-modulated proteins of the EF-hand type with intracellular and extracellular functional roles[J].Int J Biochem Cell Biol,2001,33(7):637-668.
[2]Golitsina NL,Kordowska J,Wang CL,etal.Ca2+-dependent binding of calcyclin to muscle tropomyosin[J].Biochem Biophys Res Commun,1996,220(2):360-365.
[3]Sudo T,Hidaka H.Regulation of calcyclin(S100A6) binding by alternative splicing in the N-terminal regulatory domain of annexin XI isoforms[J].J Biol Chem,1998,273(11):6351-6357.
[4]Mani RS,Mccubbin WD,Kay CM.Calcium-dependent regulation of caldesmon by an 11-kDa smooth muscle calcium-binding protein,caltropin[J].Biochemistry,1992,31(47):11896-11901.
[5]李军,王晓红,李子禹,等.S100A6对胃癌细胞侵袭转移的调控机制研究[J].中华胃肠外科杂志,2013,16(11):1096-1101.
[6]刘俊斌.联合分析S100A4和S100A6在胃癌中的表达情况[J].医学综述,2012,18(6):926-928.
[7]苏影,张谷,潘超,等.S100A6蛋白在甲状腺癌中的表达及意义[J].肿瘤学杂志,2009,15(10):908-910.
[8]Li Z,Tang M,Ling B,etal.Increased expression of S100A6 promotes cell proliferation and migration in human hepatocellular carcinoma[J].J Mol Med(Berl),2014,92(3):291-303.
[9]武睿,段亮,叶立伟,等.S100A6上调人乳腺癌细胞系MCF-7中β-catenin及其机制[J].基础医学与临床,2013,33(7):793-798.
[10]谭媛,姚德生.S100A6在宫颈癌组织中的表达及其意义[J].中国现代医生,2010,48(11):9-10.
[11]杨泽民,陈蔚文,王颖芳.慢性浅表性胃炎脾虚与脾胃湿热证患者物质能量代谢基因差异表达研究[J].中国中西医结合杂志,2012,32(9):1180-1187.
[12]南岩东,马李杰,金发光,等.EF手型钙结合蛋白S100A6及其与肿瘤关系的研究进展[J].国际呼吸杂志,2014,34(20):1561-1565.
[13]朱雯.S100A6表达下调细胞株的建立及S100A6与胃癌细胞株SGC7901多药耐药的相关性研究[D].大连:大连医科大学,2014.
[14]Takara K,Sakaeda T,Tanigawara Y,etal.Effects of 12 Ca2+antagonists on multidrug resistance, MDR1-mediated transport and MDR1 mRNA expression[J].Eur J Pharm Sci,2002,16(3):159-165.
[15]王秀梅,彭文兴,文晓柯.MDR1调控的信号传导机制研究进展[J].中国医药指南,2012(30):436-440.
[16]Moon R T,Kohn AD,De Ferrari GV,etal.WNT and beta-catenin signalling:diseases and therapies[J].Nat Rev Genet,2004,5(9):691-701.
[17]Luu HH,Zhou L,Haydon RC,etal.Increased expression of S100A6 is associated with decreased metastasis and inhibition of cell migration and anchorage independent growth in human osteosarcoma[J].Cancer Lett,2005,229(1):135-148.
[18]马闻,李星星,王胜,等.外源性重组S100A6蛋白对5株转化细胞系的增殖、迁移能力及β-catenin水平的影响[J].重庆医科大学学报,2010,35(9):1321-1326.
[19]Filipek A,Jastrzebska B,Nowotny M,etal.CacyBP/SIP,a calcyclin and Siah-1-interacting protein,binds EF-hand proteins of the S100 family[J].J Biol Chem,2002,277(32):28848-28852.
[20]翟惠虹.CacyBP/SIP核转位在结肠癌中的意义[D].西安:第四军医大学,2007.
[21]杨博.结肠癌SW480细胞中S100A1、S100A6对CacyBP/SIP核转位的影响[D].银川:宁夏医科大学,2013.
Construction, transfection and identification of S100A6-gene-overexpressed lentivirus vector
LI Jie1, HU Jin2, MA Litian2,3, YE Xin1, NAN Yandong4△, WU Dafang1*
(1DepartmentofEndocrinology, 451thHospitalofPeople’sLiberationArmy,Xi’an710054,China;2MedicalCropsof68222ofPLA;3DepartmentIntegratedTraditionalandWesternMedicineofOncology,TangduHospital,FourthMilitaryMedicalUniversity;4DepartmentofRespiratoryDiseaseandCriticalCareUnit,TangduHospital,FourthMilitaryMedicalUniversity:*Correspondingauthor,E-mail:wudafangll@sohu.com;△Co-correspondingauthor,E-mail:nanyandong2008@163.com)
Abstract:ObjectiveTo construct the S100A6-gene-overexpressed lentivirus vector and investigate the expression of S100A6 in human lung adenocarcinoma cell line A549 after transfection. MethodsThe sequence of S100A6 was amplified by PCR,and then subcloned into pLenO-DCE vector with infusion technique to generate pLenO-DCE-S100A6. The PCR products of recombinant plasmid were analyzed by gel electrophoresis and the positive clones were confirmed by sequencing. After the cotransfection of pLenO-DCE-S100A6, green fluorescent protein(GFP) expression was observed to evaluate the gene delivery efficiency in 293T cells. Finally, the virus produced by 293T cells was transfected into A549 cells. S100A6 protein and mRNA expression in A549 cells was detected by Western blot and real-time PCR. ResultsDNA sequencing confirmed that the recombinant lentivirus plasmid was successfully constructed.Recombinant lentiviruses were successfully produced in 293T cells. The expression of S100A6 and S100A6 mRNA were successfully detected in A549 cells.ConclusionThe recombinant lentivirus plasmid is successfully constructed and S100A6 is expressed in A549 cells stably,which establishes the basis on the further molecular function study of S100A6.
Key words:lentiviral vector;A549 cell;S100A6 gene
[收稿日期:2015-09-21]
作者简介:李洁,女,1978-09生,硕士,主治医师.
中图分类号:Q78
文献标志码:A
文章编号:1007-6611(2016)02-0127-05
DOI:10.13753/j.issn.1007-6611.2016.02.006
基金项目:国家自然科学基金资助项目(81001040);第四军医大学优秀文职人员基金资助项目(2011-01);第四军医大学唐都医院后备人才基金资助项目(5033)
