SPG膜乳化法制备载蛋白的CA-gel/PLGA复合微球
2016-05-25罗宇燕郭喆霏罗永梅张永明
钟 晨,罗宇燕,郭喆霏,罗永梅,张永明
(1. 中山大学药学院,广东 广州 510006;2. 中山大学附属第三医院药剂科,广东 广州 510630)
SPG膜乳化法制备载蛋白的CA-gel/PLGA复合微球
钟 晨1,罗宇燕2,郭喆霏2,罗永梅1,张永明2
(1. 中山大学药学院,广东 广州 510006;2. 中山大学附属第三医院药剂科,广东 广州 510630)
采用SPG膜乳化法,在PLGA微球的制备基础上,利用Sa与Ca2+螯合形成难溶于水的CA-gel原理,以粒径、载药量、包封率、体外释放行为等作为评价指标,研究制备载蛋白药物的CA-gel/PLGA复合微球的新工艺,并对比复合微球和PLGA微球的载药释药特性的差异。与PLGA微球相比,复合微球的载药量由6.94%增加至8.35%,包封率由62.47%增加至75.16%,突释率由42.32%下降至30.84%。复合微球在经历早期的突释之后以较为均匀的速度缓慢持续释放药物,与PLGA微球相比,2~40 d的累积释放量由31.76%增加至40.29%。两者的释药曲线均符合Peppas-Sahlin方程(R2>0.99),表明释药机制是扩散和溶蚀协同作用。采用扫描电镜观察到复合微球的结构更为致密,表面孔洞数量及面积明显减小,将其冷冻切片后观察到近表面的孔洞较少,平面孔隙率及孔隙数量均减小。激光共聚焦结果显示,更多的蛋白药物被包裹在复合微球内部,其荧光强度明显增强。表明CA-gel/PLGA复合微球能有效提高载药量和包封率,降低突释率,使微球后期释药增加。
SPG膜乳化法;CA-gel/ PLGA复合微球;包封率;突释
SPG(Shirasu Porous Glass)膜是日本SPG公司开发的新型无机膜,膜孔径微小均匀且可控[1]。SPG膜乳化法原理是分散相在氮气压力的作用下透过微孔膜的膜孔而在膜表面形成液滴,在沿膜表面流动的连续相的冲洗作用下,液滴的直径达到临界值,从膜表面剥离形成乳液。与传统乳化技术相比,具有能耗低、反应条件温和,制备乳滴粒径均一可控、操作简便等优点[2-3]。
利用生物可降解的聚乳酸聚乙醇酸共聚物(PLGA)将蛋白多肽类药物制成微球注射剂,可解决这类药物稳定性差、口服易降解、需长期频繁注射给药等缺点[4-5]。但前期研究表明,PLGA作为载体材料,存在载药量低、包封率低、突释严重等问题,添加致孔剂、调整处方工艺参数后均无较大改善。
本研究采用SPG膜乳化法,在PLGA微球的制备基础上,利用海藻酸钠(Sodium alginate,Sa)遇到Ca2+可形成难溶性螯合物的原理[6-7],将牛血清白蛋白(BSA)与Sa共溶于泊洛沙姆188(F68)溶液中作为内水相,并在连续相中添加CaCl2,使复乳在固化过程中快速形成海藻酸钙凝胶(Calcium alginate-gelatin,CA-gel),及时将药物蛋白分子阻滞于内水相,达到增加载药量和包封率、减缓突释的目的。以载药量、包封率、粒径、体外释药行为等作为评价指标来优化Sa含量和Ca2+含量,并对比CA-gel/PLGA复合微球和PLGA微球理化性质、表面及内部结构、蛋白分布情况及载药释药特性的差异。
1 试剂与仪器
1.1 试剂
牛血清白蛋白(BSA,美国Genview公司);海藻酸钠Pro-tanal LF 200DL(美国FMC公司);异硫氰酸荧光素牛血清白蛋白(FITC-BSA,美国Sigma公司);聚乳酸聚乙醇酸共聚物(PLGA,美国伯明翰公司);BCA 蛋白定量试剂盒(美国Pierce公司);其余试剂均为分析纯。
1.2 仪器
MG-20外压式SPG膜乳化器(日本SPG公司);T25高速匀浆器(美国IKA公司);JSM-6330F冷场扫描电镜(日本电子公司);SL16/40(R)冷冻离心机(美国Thermo 公司);Mastersizer2000激光粒度仪(英国马尔文仪器有限公司);LSM710激光共聚焦显微镜(德国 Zeiss公司);SDC214差示扫描量热仪(德国NETZSCH公司);Eon全自动酶标仪(美国Bio-Tek公司);EG1160石蜡切片机(德国徕卡)。
2 方 法
2.1 CA-gel/PLGA复合微球的制备
采用外压式SPG膜乳化装置结合W1/O/W2复乳溶剂挥发法制备微球[8]。CA-gel/PLGA复合微球的制备工艺如下:称取BSA粉末,加入适量Sa和F68溶液共同溶解作为内水相,PLGA溶解于DCM中作为油相,在冰浴条件下高速匀浆制成初乳。再将初乳作为分散相转移至SPG膜乳化器的储罐内,在氮气压力的作用下透过SPG膜的膜孔进入溶有一定浓度的CaCl2和PVA的连续相中,从而形成复乳。低温条件下低速搅拌3 h使微球固化完全,离心收集,纯化水洗涤3次后冷冻干燥即得。
由于内水相中Sa含量和外水相中Ca2+含量会直接影响CA-gel的生成,进而对包封率和突释产生影响。本研究固定其他参数,考察内水相中w(Sa)在0.5%、1.0%和2.0%及外水相中w(Ca2+)在0.5%、1.0%和2.0%时对微球质量的影响。
PLGA微球的制备工艺除未添加Sa和CaCl2外,其他操作同上。
2.2 微球粒径的测量
使用马尔文激光粒度仪测定微球的粒径分布及平均粒径。本试验采用干法测量,干法进样器为Scirocco 2000A,遮光度为0.5~6,测量时间为8~10 s,分散气压为0.35 MPa。
2.3 微球载药量和包封率的测定
精密称取微球约10 mg至7 mL离心管,加入0.1 mol/L NaOH-w2% SDS溶液5.0 mL。置于37 ℃恒温水浴摇床内匀速振摇48 h使微球完全裂解,13 000 r/min离心5 min后,取上清液进行BCA法蛋白含量测定。同法处理空白微球的裂解液作为背景校正。
载药量和包封率分别按以下公式计算:


2.4 微球的体外释放
精密称取微球约50 mg,加入10 mmol/L pH7.4缓冲液1.5 mL,置于37 ℃恒温水浴摇床中以100 r/min匀速振摇。分别于5、10 h,1、2、4、7、10、15、20、25、30、35、40 d取出,5 000 r/min离心5 min,将上清液全部取出,加入新鲜的PBS。用BCA法测定上清液蛋白含量,同法处理空白微球作为背景校正,计算不同时间点蛋白释放量。
2.5 微球的冷冻切片[9]
称取微球约10 mg于1.5 mL的尖底离心管,加入 0.5 mL的明胶-甘油包埋剂,离心混匀后,置于37 ℃恒温水浴振摇孵育4 h,迅速转移至-20 ℃的冰箱使包埋剂凝固。将包埋块自离心管中取出后倒立在托台上,加入适量OCT(Optimal cutting temperature compound,冷冻包埋剂)固定,放入冷冻切片机内的冷冻台上,至OCT发白并且包埋块变硬。切片前放入液氮中急冻5 min后再取出切片,切片温度为-40 ℃,切片厚度为10 μm。
2.6 微球的形态观察
将微球及其冷冻切片样品均匀分散在贴有导电胶的载样台,置于真空条件下,喷上金粉。利用冷场扫描电子显微镜在电子束强度为10 kV的条件下观察微球表面及内部形态。
2.7 微球表面及截面孔隙率[10]
从每种处方的微球及其冷冻切片的扫描电镜图片中选取至少6张,运用Image J软件对微球截面的扫描电镜图像进行定量分析,包括孔洞数目、孔洞总面积及微球平面面积,计算出孔隙率用于描述微球的内部形态结构。

2.8 微球内部药物的分布
采用激光共焦显微镜(CLSM)来考察药物在微球内部药物分布情况。将包载FITC-BSA的微球均匀分散于激光共聚焦专用培养皿,使用油镜进行观测,放大倍数为100倍,激发波长为488 /525 nm。
3 结 果
3.1 CA-gel/PLGA复合微球的处方优化
3.1.1 内水相w(Sa)对微球质量的影响 课题组前期以PLGA为载体材料,采用SPG膜乳化法制备缓释微球并进行处方筛选,确定PLGA微球的优化处方为:载药量11.11%、w(聚合物)15%、内水相300 μL、初乳匀浆转速15 000 r/min、SPG膜孔径5 μm、膜挤出压力30 KPa。但研究过程中发现仍然难以解决包封率低、突释严重等问题。而利用Sa与Ca2+鳌合形成难溶于水的CA-gel,并与PLGA微球骨架同步形成,有效改善突释且操作简便。
结果显示,载药量和包封率随着w(Sa)升高先增大后减小(见表1),原因可能是w(Sa)不但影响CA-gel的生成量,而且还会影响内水相粘度。当w(Sa)增至2.0%时,由于内水相粘性过大,在制备过程转移内水相时易造成损耗而导致包封率降低。而突释率随着w(Sa)升高逐渐降低(见图1),当w(Sa)达到1.0%时对其40 d累计释放量影响不大。综合上述结果,选定w(Sa)为1.0%。

表1 w(Sa)对微球质量的影响(x∓s,n=3)Table 1 Characteristics of MS prepared by different concentration of Sa(x∓s,n=3)
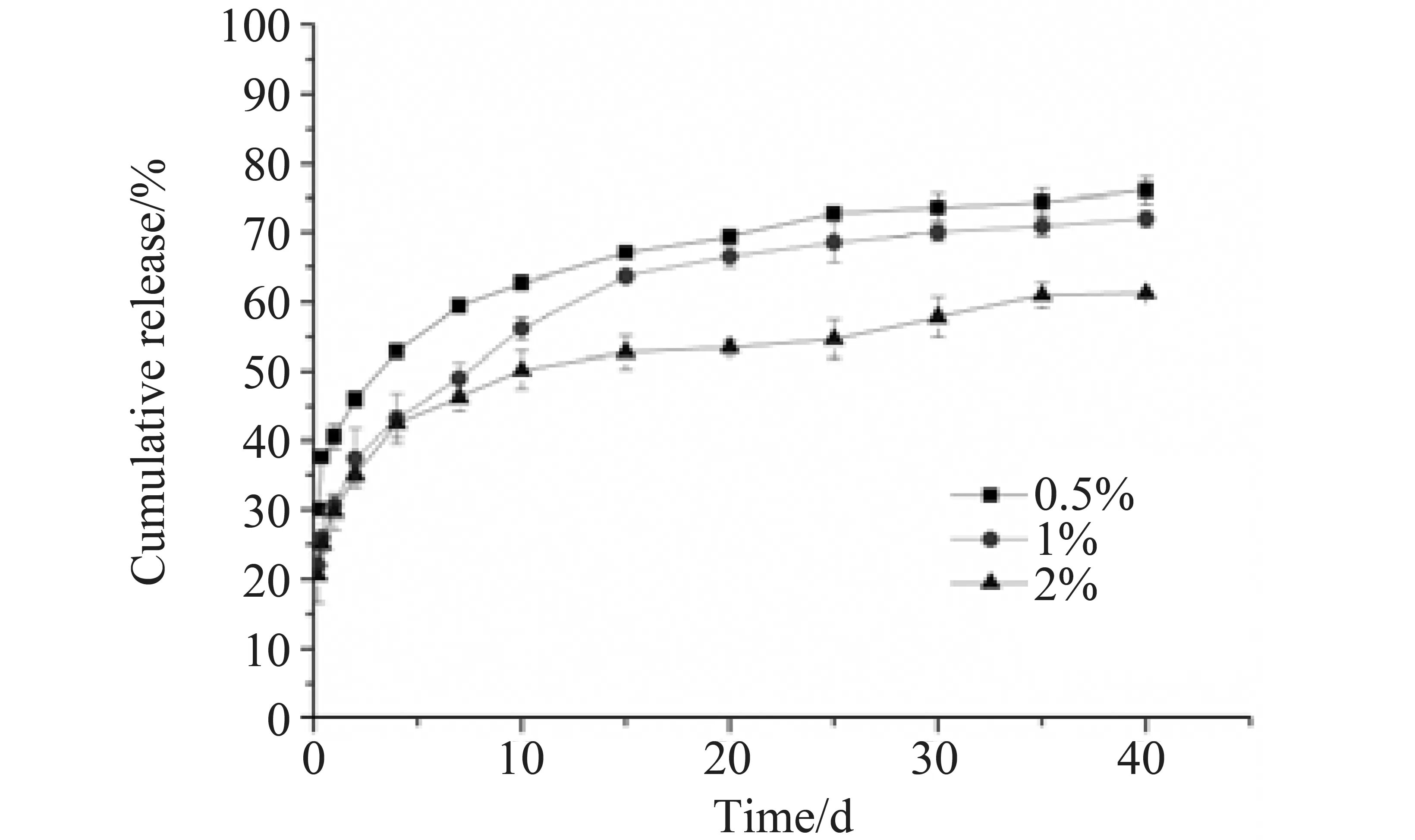
图1 w(Sa)对微球体外释放的影响(n=3)Fig.1 Influence of concentration of Sa on the release from MS(n=3)
3.1.2 外水相CaCl2浓度对复合微球质量的影响 本研究利用外部凝胶化的原理制备CA-gel,故考察外水相w(CaCl2)为0.5%、1.0%、2.0%时对微球质量的影响。结果显示,w(CaCl2)对CA-gel/PLGA复合微球的载药释药性能影响不大(见表2、图2),原因可能是本研究利用外部凝胶化的原理制备CA-gel,当 Ca2+扩散至乳滴表面时立即发生离子置换反应生成凝胶屏障,阻碍Ca2+继续往乳滴内部扩散,故w(CaCl2)继续增大对微球载药释药性能影响不大,并且w(CaCl2)增大还会造成后期微球清洗收集困难,故w(CaCl2)确定为1.0%。

图2 w(CaCl2)对微球体外释放的影响(n=3)Fig.2 Influence of concentration of CaCl2 on the release from microspheres(n=3)
3.2 CA-gel/PLGA复合微球和PLGA微球载药性能和释放行为的比较
3.2.1 载药释药性能 分别制备CA-gel/PLGA复合微球和PLGA微球(处方工艺按3.1项下),对比两者载药性能和释药行为的差异。外观上两者均为白色疏松粉末,且分散性和流动性良好。结果显示,与PLGA微球相比,复合微球的载药量和包封率显著增加20.31%,微球的粒径也由52.46 μm降低至40.01 μm,突释率下降27.13%(见表3),且在经历早期的突释之后以较为均匀的速度缓慢地释放药物,40 d的累积释放量超过70%(见图3)。并且与PLGA微球(31.76%)相比,复合微球在突释之后的2~40 d累积释放的药物量增加至40.29%(P<0.05),说明复合微球能有效改善微球的体外释放行为,突释降低,后期释药增加。

表3 CA-gel/PLGA复合微球和PLGA微球的载药释药差异(x∓s,n=3)Table 3 Different characteristics of MS prepared with or without CA-gel(x∓s,n=3)

图3 CA-gel/PLGA复合微球和PLGA微球的体外释放行为差异(n=3)Fig.3 The release behavior of MS prepared with or without CA-gel(n=3)
3.2.2 微球释药机制的拟合研究 将两种微球的体外释放数据(图3)分别按Higcuchi equation、Korsmeyer equation公式、Peppas-Sahlin equation方程进行拟合[11],结果显示,两组微球的体外释放数据按Peppas-Sahlin方程拟合的R2都大于0.99,且kd比kr的数值大(见表4),说明两组微球的释药机制均符合Peppas-Sahlin方程,即药物主要是从微球骨架中扩散释放,另有一小部分药物通过溶蚀释放。进一步考察两组微球在各个时间点释放累积释放量中扩散和溶蚀所占的比例,可以发现两组微球释放时扩散机制所占比例随释放时间延长逐渐减小但仍占据主导地位(见图4,图5),最低分别是70.20%、70.34%,溶蚀机制所占的比例则相应增大,由初始10.54%,14.04%(P<0.05)分别增大至29.79%和29.69% (P>0.05),复合微球在整个释放周期中溶蚀比例增长幅度相对较大,结合复合微球在2~40 d累积释放量高于PLGA这一结果,说明对于复合微球,CA-gel的膨胀溶蚀是促进蛋白释放的关键。

表4 CA-gel /PLGA复合微球和PLGA微球的释放曲线的模型拟合Table 4 Model fitting of CA-gel /PLGA Composite MS and PLGA MS’s release profile

图4 CA-gel /PLGA复合微球在不同释放时间点的扩散/溶蚀比Fig.4 The diffusion / dissolution ratio of CA-gel / PLGA composite MS

图5 PLGA微球在不同释放时间点的扩散/溶蚀比Fig.5 The diffusion / dissolution ratio of PLGA MS
3.2.3 微球的表面形态和内部结构 在包载亲水性蛋白多肽类微球的释放初期,药物主要通过扩散机制释放,因此微球表面的孔洞数量及面积与突释具有一定的正相关关系[12]。使用冷场扫描电镜(SEM)对微球表面形态和内部结构进行观察,并运用相关软件计算微球的表面和截面的孔隙率。两种微球的表面均圆整光滑,复合微球与PLGA微球相比,表面孔洞数量及面积均都明显减少,同时从微球的切片也可明显观察到复合微球外缘的孔洞较少(图6),平面孔隙率及孔隙数量均减小,总之复合微球的结构更为致密(表5)。

图6 CA-gel/PLGA复合微球和PLGA微球的SEM图片Fig.6 Scanning electron micrographs of MS prepared by with or without CA-gel(A、B:CA-gel/PLGA复合微球表面及内部形态;C、D:PLGA微球表面及内部形态)
3.2.4 蛋白在微球内部的分布情况 利用激光共聚焦显微镜(CLSM)可观察到样品中的荧光物,以荧光蛋白FITC-BSA(激发波长:495 nm、绿色荧光)代替BSA作为模型药物制备微球,通过CLSM观察荧光蛋白在复合微球和PLGA微球中的分布[13]。绿色荧光物质为FITC-BSA,亮度越高的地方表示蛋白量越多[14]。可见对于PLGA微球,荧光强度较低且分布较不均匀;而CA-gel/PLGA复合微球的荧光强度明显高于PLGA微球,而且荧光在整个微球的分散性有所改善(图7)。

表5 CA-gel/PLGA复合微球和PLGA微球的结构差异(x∓s,n=6)Table 5 Different structure of MS prepared by with or without CA-gel (x∓s,n=6)

图7 CA-gel/PLGA复合微球和PLGA微球的CLSM图Fig.7 Laser scanning confocal microscopy pictures of FITC-BSA microsphere slices prepared with or without CA-gel(A:CA-gel/PLGA复合微球;B:PLGA微球)
4 讨 论
本研究创新性地在SPG膜乳化法制备PLGA微球的基础上,通过在内水相中加入Sa,外水相中加入CaCl2制备CA-gel/PLGA复合微球。使复乳在形成和固化过程中,近表面形成难溶于水的CA-gel,由于BSA与Sa共同溶解于内水相中的,故BSA也被固定在CA-gel的“蛋格结构”中,难以扩散至外水相,使更多BSA包封于微球内部,载药量和包封率随之增加。并且激光共聚焦结果也显示复合微球的荧光强度明显增强。
有研究表明,在微球释放过程中,吸附在微球表面或是与外界连通孔洞内的药物最先释放,若药物量较多则引起较为严重的突释[15]。与PLGA微球相比,CA-gel/PLGA复合微球的突释率明显降低。这是由于CA-gel可在释放介质中溶胀,在释放过程中随着介质逐渐渗入微球内部,分散于PLGA骨架材料中的CA-gel吸水膨胀,可以一定程度上阻滞蛋白扩散至释放介质,延缓药物释放,减轻突释,并提高后期药物释放浓度,2~40 d的累积释放量高于PLGA微球。对比两组微球在不同释放时间点扩散/溶蚀机制所占比例,复合微球在整个释放周期中溶蚀比例增长幅度较大,说明中后期CA-gel的膨胀溶蚀机制[16]促进蛋白释放,是复合微球在2~40 d累积释放量高于PLGA微球的关键因素。
从微球的冷场扫描电镜图片可以看到,CA-gel/PLGA复合微的近表面结构的更为致密,主要原因是在复乳形成和固化过程中,外水相中的Ca2+进入微球内,与内水相的Sa鳌合形成凝胶,可以填充微球在固化过程中自发形成的孔隙,从而使微球表面结构更加致密。但由于CA-gel生成过程分为两步:① Ca2+从CaCl2溶液向Sa液滴中扩散;②在Sa链段上发生离子置换反应,Ca2+置换出Na+,生成CA-gel。所以当Ca2+扩散至微球表面并立即发生离子置换反应生成凝胶,之后该凝胶会形成屏障,凝胶的增多会增加Ca2+向液滴内部进一步扩散的阻力,使微球内部鳌合的Ca2+含量下降,所以对微球内部的结构影响不大。
[1] JOSCELYNE S M, TRAGARDH G. Membrane emulsification-a literature review [J]. Journal of Membrane Science, 2000, 169(1):107-117.
[2] OH D H, BALAKRISHNAN P, OH Y K, et al. Effect of process parameters on nanoemulsion droplet size and distribution in SPG membrane emulsification[J]. Int J Pharm, 2011, 404(1/2):191-197.
[3] HANCOCKS R D, SPYROPOULOS F, NORTON I T. The effects of membrane composition and morphology on the rotating membrane emulsification technique for food grade emulsions[J]. Journal of Membrane Science, 2016, 497:29-35.
[4] SHIVE M S, ANDERSON J M. Biodegradation and biocompatibility of PLA and PLGA microspheres[J]. Adv Drug Deliv Rev, 1997, 28(1):5-24.
[5] SINHA V R, TREHAN A. Biodegradable microspheres for protein delivery[J]. Journal of Controlled Release, 2003, 90(3):261-280.
[6] ZHAO Yinyan, LI Fuyue, CARVAJAL M T, et al. Interactions between bovine serum albumin and alginate: An evaluation of alginate as protein carrier[J]. Journal of Colloid and Interface Science,2009, 332(2):345-353.
[7] 罗宇燕,麦海燕,黎呐,等.复乳法及其改良法制备的干扰素PLGA微球载药释药特性的对比[J].中山大学学报(自然科学版), 2014,53:110-4.
[8] 杨梦琪, 张永明, 陈德, 等. SPG膜乳化法制备溶菌酶-PLGA微球的研究[J]. 中国药师,2015(3):376-380.
[9] 黎呐, 麦海燕, 罗宇燕,等. 聚乳酸聚乙醇酸微球冷冻切片方法的研究[J]. 广东药学院学报,2014(01):1-5.
[10] EHTEZAZI T, WASHINGTON C, MELIA C D. Determination of the internal morphology of poly (D,L-lactide) microspheres using stereological methods[J]. Journal of Controlled Release, 1999, 57(3):301-314.
[11] CABRERA M I, LUNA J A, GRAU R J A. Modeling of dissolution-diffusion controlled drug release from planar polymeric systems with finite dissolution rate and arbitrary drug loading[J]. Journal of Membrane Science, 2006, 280(1/2):693-704.
[12] MAO Shirui, XU Jing, CAI Cuifang, et al. Effect of WOW process parameters on morphology and burst release of FITC-dextran loaded PLGA microspheres[J]. Int J Pharm, 2007, 334(1/2):137-148.
[13] 郭喆霏, 成晓岚, 罗宇燕, 等. 激光共聚焦显微镜分析载蛋白微球的结构及药物分布[J]. 中国医院药学杂志,2015(15):1381-1384.
[14] MESSARITAKI A, BLACK S J, VANDERWALLE C F, et al. NMR and confocal microscopy studies of the mechanisms of burst drug release from PLGA microspheres[J]. J Control Release, 2005, 108(2/3):271-281.
[15] KLOSE D, SIEPMANN F, WILLART J F, et al Drug release from PLGA-based microparticles: Effects of the “microparticle:bulk fluid” ratio[J]. International Journal of Pharmaceutics, 2010, 383(1/2):123-131.
[16] ZHENG Caihong, LIANG Wenquan. A one-step modified method to reduce the burst initial release from PLGA microspheres[J]. Drug Delivery, 2010, 17(2):77-82.
CA-gel/PLGA composite microspheres loaded protein by SPG membrane emulsification
ZHONG Chen1, LUO Yuyan2, GUO Zhefei2, LUO Yongmei1, ZHANG Yongming2
(1. School of Pharmaceutical Sciences, Sun Yat-sen niversity, Guangzhou 510006, China; 2.The Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China)
Protein loaded CA-gel/PLGA composite microspheres were prepared by a novel SPG membrane emulsification method, which was modified from the traditional preparation method of PLGA microspheres. The formation of the sustained-release gel was based on the ionic interaction between Sa and calcium ion. The drug loading of composite microspheres was significantly increased from 6.94% to 8.35%, entrapment efficiency was increased from 62.47% to 75.16%,and the burst release rate was declined from 42.32% to 30.84%. Drug release test showed that nearly 40.29% of drug was continuously and steadily released from the composite microspheres in 2~40 days. The drug release curves were corresponded to Peppas-Sahlin equation (R2> 0.99) for both the traditional microspheres and composite microspheres, which means that the release mechanism was mainly diffusion and dissolution. The results from scanning electron microscopy and freezing microtomy demonstrated that the composite microspheres were more compact in structure, and its surface hole number and porosity were smaller than traditional PLGA microspheres. The enhanced fluorescence intensity was observed from the laser confocal scan microscopy, indicating that more protein drugs were wrapped inside composite microspheres. In conclusion, the CA-gel/PLGA composite microspheres can effectively increase drug loading and entrapment efficiency and reduce the burst release.
SPG membrane emulsification; CA-gel/ PLGA composite microspheres;entrapment efficiency;burst-release
10.13471/j.cnki.acta.snus.2016.05.017
2016-07-01
广东省医院药学研究基金资助项目(2015SW12)
钟晨(1989年生),女;研究方向:缓释控释制剂;通讯作者:张永明;E-mail:874477522@qq.com
R943
A
0529-6579(2016)05-0096-07
