直肠癌新辅助放化疗完全病理缓解五例报告
2016-05-25肖俊峰王昌青王贵和
肖俊峰 王昌青 王贵和
·论 著·(直肠癌专题)
直肠癌新辅助放化疗完全病理缓解五例报告
肖俊峰 王昌青 王贵和
目的 初步探讨直肠癌新辅助放化疗疗效的评估方式、时间及完全临床缓解的治疗方式。方法 回顾2012年3月至2015年9月间5例行新辅助同步放化疗术后完全病理缓解的直肠腺癌资料。3例男性,2例女性,年龄58~75岁,术前均肠镜活检证实为腺癌,术前直肠增强MRI分期符合新辅助治疗标准,且胸腹部CT未见远处转移。采用同步放化疗,5例新辅助治疗后均采取腹腔镜辅助根治性手术。术后继续辅以化疗,与术前化疗周期数之和为8,术后1~3年每3~6个月复查1次,3~5年每6个月复查1次,5年以后每1年复查1次。结果 5例病人便血和(或)里急后重感均有明显好转。直肠增强MRI提示病灶明显缩小。5例病人术后病理均未见癌组织,随访至今未见复发及转移征象。结论 直肠癌新辅助放化疗疗效明显,可以降低分期,但目前对于疗效评估方式、时间及完全临床缓解的治疗方式仍无统一标准。
直肠癌; 完全病理缓解; 新辅助同步放化疗
目前中国结直肠癌诊疗规范明确规定对于距肛门小于12 cm T3和/或N+可切除的直肠癌病人推荐术前新辅助放化疗,T4或局部晚期不可切除的直肠癌病人,必须行新辅助放化疗。而对于新辅助放化疗疗效评估方式、评估时间及完全临床缓解的下一步治疗,目前无统一标准,也未提及。本文报告5例新辅助放化疗后完全病理缓解的资料,希望能够给同行提供微小的帮助。
资料与方法
一、一般资料
回顾我院2012年3月至2015年9月期间5例行新辅助同步放化疗术后完全病理缓解的直肠腺癌资料。3例男性,2例女性,年龄58~75岁,身高160~175 cm,体重55~70 kg,术前均肠镜活检证实为腺癌,术前直肠增强MRI分期符合新辅助治疗标准,且胸腹部CT未见远处转移。
二、治疗及评估方法
采用同步放化疗,放疗采用常规分割方式:1~2 Gy/d,治疗25~30次(西门子公司Primus-H,直线加速器,适形放疗)。化疗方案为:奥沙利铂+卡培他滨,3周一个周期。每个化疗周期结束时均采用包括病人主观症状、直肠指检、肿瘤标志物(CEA、CA199、CA125及AFP)、胸腹部CT以及直肠增强MRI评估疗效,5例新辅助治疗后均采取腹腔镜辅助根治性手术。术后继续辅以化疗,与术前化疗周期数之和为8,术后1~3年每3~6个月复查1次,3~5年每6个月复查1次,5年以后每1年复查1次。
结 果
新辅助同步放化疗期间均未见局部及远处转移。病人便血和(或)里急后重感均有明显好转。2例可直肠指检触及的病人,病灶明显缩小,直肠增强MRI提示病灶明显缩小。3例病人直肠增强MRI病灶范围较治疗前明显缩小。5例病人术后病理均未见癌组织。随访至今未见复发及转移征象。资料见表1。
讨 论
一、直肠癌新辅助治疗何时评估疗效以及如何评估
直肠癌新辅助治疗可以提高手术切除率,提高保肛率,延长病人无病生存期;但直肠癌新辅助治疗过程中可以发生局部进展或远处转移,失去手术机会的病例,出现进展约5%[1]。所以在直肠癌新辅助治疗过程中及时的评估以及采取有效的评估方式至关重要。本文报道的5例病人均为每3周评估一次;包括病人主观症状、直肠指检、肿瘤标志物(CEA、CA199、CA125及AFP)、胸腹部CT以及直肠增强MRI多方面评估;以期在新辅助治疗过程及时发现进展或远处转移病例;及时进行手术干预或化疗方案更改;目前没有统一的标准,2015中国结直肠癌诊疗规范上也未提及评估时间以及如何评估。肿瘤转移是一个多步骤、多阶段、多基因的复杂过程;包括从肿瘤的原发部位脱离,进入周围的基质,进入循环或淋巴系统,黏附在内皮细胞壁并向血管外迁移及在远处浸润、血管增生,形成新的转移灶,目前结直癌转移机制尚未研究清楚[2]。由于不论是放化疗对直肠肿瘤细胞直接损伤和间接损伤的机制;还是肿瘤细胞修复再复制的机制和时间或是正常细胞受损修复时间均未明确[3]。我们无从得知直肠癌形成转移灶或局部进展的具体时间;也无从用某个或某些即时、高效的指标去评估;加之新辅助治疗的相关副反应,以及既往我科约100例直肠癌新辅助治疗病人的资料,可考虑为3周评估1次新辅助治疗的效果。现认为4~6周评估一次[4-6]。过频的评估可能会造成医疗资源的浪费,加重病人经济负担。过迟的评估可能会延误手术时机。目前对于评估的客观方法,包括CT、PET-CT、MRI以及直肠超声。超声内镜及CT对T分期不如增强MRI准确[7]。但超声内镜对T1和T2分期优于MRI[8],对于N分期,MRI仍优于前二者,目前识别转移淋巴结仍有较大困难,提高N分期准确性有待解决,对于转移淋巴结诊断标准也需提高[9],由于新辅助放化疗导致肿瘤变性、坏死及纤维化的形成等病理改变,会干扰CT、MRI及直肠超声对T及N分期,导致分期准确性下降[10]。鉴于PET-CT高昂的检查费用以及普及程度偏低,目前尚未常规用于直肠癌新辅助放化疗疗效评估。能谱CT及MRI具有较好的研究前景,然而仍没有有效的影像学检查发现完全病理缓解病理,也没有统一的标准。

表1 病例资料及结果
注:a方案为:奥沙利铂130 mg/m2+卡培他滨1250 mg/m2;b放疗方式:常规分割照射;c术式:腹腔镜辅助(全直肠系膜切除术)
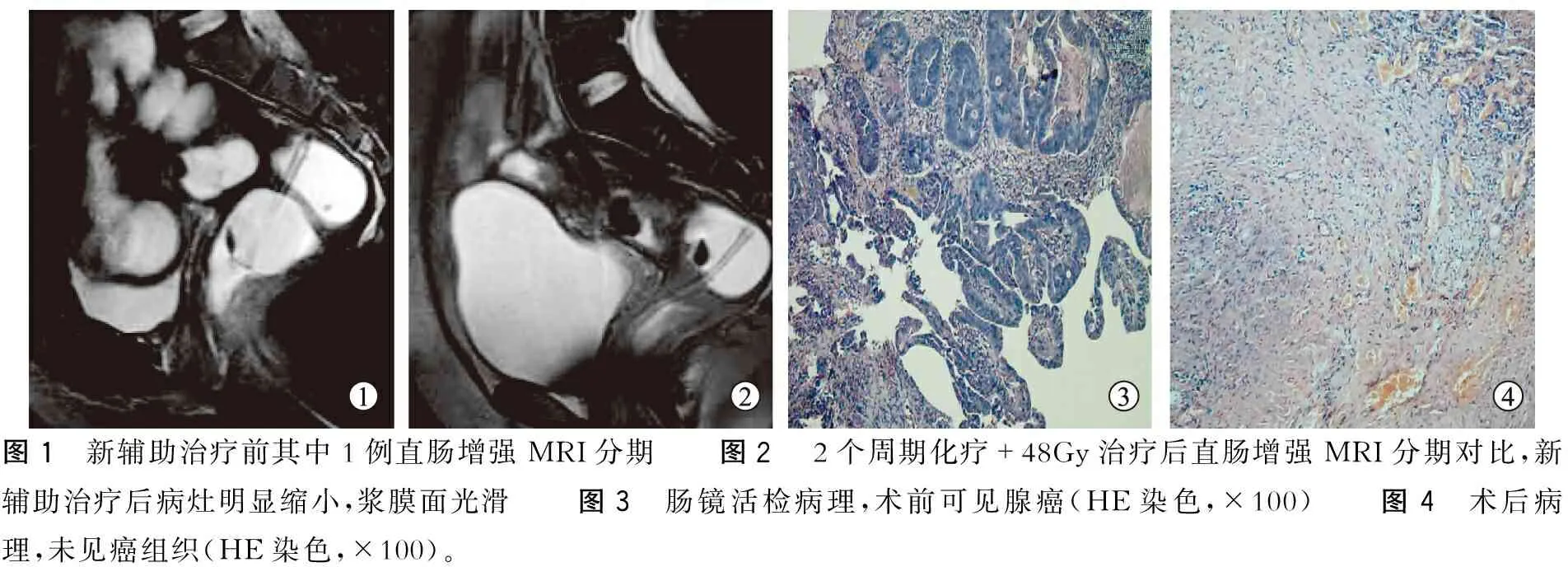
图1 新辅助治疗前其中1例直肠增强MRI分期 图2 2个周期化疗+48Gy治疗后直肠增强MRI分期对比,新辅助治疗后病灶明显缩小,浆膜面光滑 图3 肠镜活检病理,术前可见腺癌(HE染色,×100) 图4 术后病理,未见癌组织(HE染色,×100)。
二、直肠癌新辅助治疗后完全临床缓解的治疗选择
直肠癌新辅助治疗完全临床缓解目前无统一标准。可理解为经肠镜多次活检未见肿瘤细胞,未见明显肿块,影像学可见肿块完全消失。由于临床完全缓解与病理完全缓解并非完全一致,临床完全缓解仅10%~30%为病理完全缓解[11-13]。这给临床治疗带来了巨大的难题。由此造成对临床完全缓解的处理方式产生众多争议。主要集中在以下二方面:①完全临床缓解后是采取全直肠系膜切除术还是局部切除;②继续放化疗还是等待观察。对于完全临床缓解的病例,局部切除与根治性手术疗效相同[14],一篇Meta[15]分析提示:行非手术观察的局部复发率、总复发率高于根治性手术,但远处转移、长期生存与根治性手术相比无显著差异。局部切除术局部复发率、远处转移率与根治性手术相比无显著差异。行局部切除者术长期生存甚至优于根治性手术。但不得不提的最具代表性研究莫过为Habr-Gama 等[16]的研究。他们对256例行新辅助治疗的直肠癌病人进行了观察随访,发现行根治性手术且未完全临床缓解的病人与完全临床缓解进行观察的病人相比,5 年生存率和无瘤生存率分别为88% 比100%、83% 比92%。有5 例完全临床缓解后复发,其中1例行经肛局部切除,1例行补救性短程放疗,3例远处转移经化疗,5例病人均获得较好的远期生存率。完全临床缓解是否行补充性放化疗存在巨大的争议。鉴于目前无有效的检测手段,完全临床缓解并不是完全病理缓解,以及缺乏多中心的随机对照研究,对于完全临床缓解病人多数医疗单位还是采取根治性手术治疗,除非病人有强烈的保肛门要求或拒绝手术治疗。
三、术后完全病理缓解是否需要辅助化疗
直肠癌的术后化疗适应证取决于病理分期,对于Ⅲ、Ⅳ期结肠癌是辅助化疗的主要适应证和绝对适应证,对于Ⅱ期中的高危因素者[T4病灶、分化差、伴有穿孔或梗阻、神经血管浸润或淋巴结清除(送检)<12枚]应当辅助化疗,目前NCCN推荐新辅助治疗病人,术后均应行辅助化疗,其是否能使病人受益,仍缺乏相关研究,术后完全病理缓解可能不必要[17-19],目前一些回顾性研究提示完全病理缓解术后辅助化疗并未提高疗效,Govindarajan的研究提示ypT0-2N0,是否给予辅助化疗,5年无病生存率相似[20-21]。由于接受新辅助治疗的直肠癌病人,一般会导致术后病理分期降低,加之术前分期也存在不准确性,对于如何指导术后完全病理缓解辅助化疗,一些回顾性研究提示术后病理分期更能反映预后,也有研究提示以未治疗前的分期为基础,术后病理作为参考[22-23],本文的5例完全病理缓解病人均接受辅助化疗,随访至今仍未有复发及转移征象,笔者认为应当结合病人的自身情况综合评估是否需要术后辅助化疗。
直肠癌新辅助放化疗已成为规范化治疗的一部分,至于疗效的评估方式及评估时间目前仍无标准,而临床完全缓解仅一部分为完全病理缓解,且术前难以证实,对于这部分病人的处理方式仍无标准,对于完全病理缓解的术后辅助化疗疗效缺乏相关研究,应当结合病人的自身情况综合评估是否需要术后辅助化疗。
1 吴文铭,邱辉忠,吴斌,等.临床病理指标预测直肠癌新辅助治疗疗效的初步探讨.中华外科杂志,2010,48:333-337.DOI:10.3760/cma.j.issn.0529-5815. 2010.05.009.
2 赵亮,丁彦青.结直肠癌转移机制研究进展.浙江大学学报(医学版),2014,43:486-493.DOI:10.3785/ j.issn.1008-9292.2014.07.009.
3 梁小波,陶凯.直肠癌新辅助治疗后临床完全缓解处理策略的争议与困惑.中国普外基础与临床杂志,2014,21:1138-1343.DOI:10.7507/1007-9424.20140323.
4 Tran CL,Udani S,Holt A,et al.Evaluation of safety of increased time interval between chemoradiation and resection for rectal cancer.Am J Surg,2006,192:873-877.DOI:10.1016/j.amjsurg.2006.08.061.
5 Francois Y,Nemoz CJ,Baulieux J,et al.Infl uence of the interval between preoperative radiation therapy and surgery on downstaging and on the rate of sphincter-sparing surgery for rectal cancer:the Lyon R90-01 randomized trial.J Clin Oncol,1999,17:2396.DOI: 10.1016/S0959-8049(99)80635-2.
6 Wiltshire KL,Ward IG,Swallow C,et al.Preoperative radiation with concurrent chemotherapy for resectable rectal cancer:effect of dose escalation on pathologic complete response,local recurrence-free survival,disease-free survival,and overall survival.Int J Radiat Oncol Biol Phys,2006,64:709-716.DOI:http://dx.doi.org/10.1016/j.ijrobp. 2004.07.090.
7 郝雅静,邢军,任基伟,等.直肠癌新辅助放化疗影像学疗效评价现状及展望.医学综述,2014,20:3580-3582.DOI:10.3969/j.issn.1006-2084.2014.19.049.
8 詹淑芳,朱洪波.影像学对直肠癌新辅助治疗后分期的评估价值.中华胃肠外科杂志,2014,17:1156-1160.DOI:10.3760/cma.j.issn.1671-0274.2014.11.025.
9 薛黎明,姜慧杰.应用影像学进行直肠癌T,N分期的现状.中华结直肠疾病电子杂志,2015,4:62-64.DOI:10.3877/cma.j.issn.2095-3224. 2015.01.14.
10 De Nardi P,Carvello M.How reliable is current imaging in restaging rectal cancer after neoadjuvant therapy?.World J Gastroenterol, 2013, 19:5964-5972.DOI:10.3748/wjg.v19.i36.5964.
11 Torino F,Sarmiento R,Gasparini G.The contribution of targeted therapy to the neoadjuvant chemoradiation of rectal cancer.Crit Rev Oncol Hematol,2013,87:283-305.DOI: 10.1016/ j.critrevonc.2013.02. 002.
12 Hiotis SP,Weber SM,Cohen AM,et al. Assessing the predictive value of clinical complete response to neoadjuvant therapy for rectal cancer:an analysis of 488 patients.J Am Coll Surg,2002,194: 131-136.DOI:10.1016/S1072-7515 (01)01159-0.
13 Mohiuddin M,Regine WF,John WJ,et al.Preoperative chemoradiation in fixed distal rectal cancer:dose time factors for pathological complete response.Int J Radiat Oncol Biol Phys,2000,46:883-888. DOI:10.1016/S 0360-3016(99)00486-1.
14 Issa N,Murninkas A,Powsner E, at al.Long-term outcome of local excision after complete pathological response to neoadjuvant chemoradiation therapy for rectal cancer.Word J Surg,2012,36:2481-2487. DOI:10.1007/s 00268-012-1697-7.
15 李俊,崔健,张海增,等.直肠癌新辅助治疗后临床完全缓解病人不同处理措施预后效果的Meta分析.中国肿瘤外科杂志,2014,6:69-76.DOI:10.3969/j.issn.1674-4136.2014.02.001.
16 Habr-Gama A,Perez RO,Nadalin W,et al.Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy:long-term results.Ann Surg,2004,240:711-718. DOI:10.1097/01.sla.0000141194.27992.32.
17 顾晋,陈鹏举.胃肠外科医师应重视结直癌的辅助化疗.中华胃肠外科杂志,2015,18:974-978.DOI:10.3760/cma.j.issn.1671-0274.2015.10. 002.
18 Bujko K,Glyynne-Jones R,Bujku M.Does adjuvant fluoropyrimidine-based chemotherapy provide a benefit for patients with resected rectal cancer who have already received neoadjuvant radiochemotherapy?A systematic review of randomised trials. DOI:10.1093/annonc/mdq054First published online:March 15,2010.
19 Zorcolo L,Rosman AS,Restivo A,et al .Complete pathologic response after combined modality treatment for rectal cancer and long-term survival:a meta-analysis.Ann Surg Oncol,2012,19:2822-2832.DOI: 10.1245/s10434-011-2209-y.
20 彭海花,游凯云,高远红,等.局部晚期直肠癌三维适形放疗同期化疗后pCR患者术后辅助化疗的价值.中华放射肿瘤学杂志,2013,22:5-8.
21 Govindarajan A,Reidy D,Weiser MR,et al.Recurrence rates and prognostic factors in ypN0 rectal cancer after neoadjuvant chemomdiation and total mesorectal excision.Ann Surg Oncol,2011, 18:3666-3672.DOI:10.1245/s 10434- 011-1788y.
22 彭海花,游凯云,王成涛,等.局部晚期直肠癌新辅助放化疗后病理分期对预后影响.中华放射肿瘤学杂志,2013,22:439-442. DOI:10.3760/cmn.j.issn.1004-4221.2013.06.005.
23 吴晓宇,姚学权,陈彻,等.低位直肠癌新辅助放化疗后完全缓解病例的治疗策略分析.东南大学学报: 医学版,2014,33:77-80.DOI:10. 3969 /j. issn.1671-6264. 2014. 01. 019.
A report of 5 rectal cancer cases about pathological complete response to neoadjuvant chemoradiotherapy
XiaoJunfeng,WANGChangqing,WANGGuihe.
DepartmentofGastrointestinalSurgery,TonglingPeople’sHospital,Tongling244000,China
XiaoJunfeng,Email:546353987@qq.com
Objective To study the evaluation of curative effectiveness and the treatment of clinical complete response following neoadjuvant chemoradiotherapy for rectal cancer.Methods The clinical data of 5 cases of rectal cancer achieving pathological complete response to neoadjuvant chemoradiotherapy from Mar. 2012 to Sep. 2015 were retrospectively analyzed.Results Hematochezia or tenesmus was improved significantly in all enrolled patients. Enhanced MRI showed the lesions were significantly reduced. No cancerous tissues were observed postoperatively pathologically in 5 cases. There was no recurrence or distant metastases.Conclusions The neoadjuvant chemoradiotherapy is a good treatment for rectal cancer, but there is no standard in assessment of curative effect, evaluation of time and the treatment of clinical complete response.
Rectal carcinoma; Complete pathologic response; Neoadjuvant concurrent chemoradiotherapy
244000 安徽铜陵,铜陵市人民医院胃肠外科
肖俊峰,Email:546353987@qq.com
R657.1
A
10.3969/j.issn.1003-5591.2016.04.006
2016-05-02)
