酸菜发酵液多糖的分离纯化及结构分析
2016-05-24荣向华张璇赵春燕
荣向华,张璇,赵春燕,2*
1(沈阳农业大学 食品学院,辽宁 沈阳,110161) 2(沈阳工学院,辽宁 抚顺,113122)
酸菜发酵液多糖的分离纯化及结构分析
荣向华1,张璇1,赵春燕1,2*
1(沈阳农业大学 食品学院,辽宁 沈阳,110161) 2(沈阳工学院,辽宁 抚顺,113122)
摘要以醇沉法提取的酸菜发酵液粗多糖为原料,研究了酸菜发酵液多糖的分离纯化工艺,并对其结构及单糖组成进行了初步鉴定。比较了Sevag法、TCA﹣正丁醇法、TCA与木瓜蛋白酶结合法及Sevag与木瓜蛋白酶结合法4种脱蛋白方法,利用DEAE-52纤维素柱和Sephadex-50葡聚糖凝胶柱层析精制得到了SJPⅡ-1,通过红外光谱(infrared spectroscopy,IR)和高效液相色谱(high performance liguid chromatography,HPLC)分析SJPⅡ-1的结构及单糖组成。试验结果表明,TCA与木瓜蛋白酶结合法是较佳脱蛋白方法,蛋白质的清除率为94.86%,多糖的损失率为19.77%;IR检测结果显示,SJPⅡ-1具有多糖特征结构;HPLC分析结果表明,SJPⅡ-1主要由果糖、甘露糖、鼠李糖、葡萄糖4种单糖组成。
关键词酸菜发酵液;多糖;纯化;结构;单糖
酸菜发酵液是乳酸菌发酵酸菜过程中产生的剩余液,除含有乳酸菌、无机盐外,还含有多糖和蛋白质等营养物质[1-2]。随着酸菜产业的蓬勃发展,产生了大量的酸菜剩余液并以废液的形式排放到河流,导致水体富营养化,造成环境污染。因此,研究酸菜发酵液的综合利用具有十分重要的意义。乳酸菌在发酵过程中除产生对菌体自身有益的荚膜多糖和胞壁多糖之外,还产生一种扩散到发酵液中的可溶性多糖。乳酸菌胞外多糖除了其对细菌自身的生物学意义之外,更重要的是它具有安全无毒、理化性质独特、用途广泛、易与菌体分离及可通过深层发酵实现工业化生产等优良性质而备受关注。研究表明,乳酸菌发酵酸奶过程中产生的胞外多糖具有很强的生物活性,能够增强机体免疫力,并具有抗癌、抗肿瘤的功能[3]。基于以上观点,同为乳酸菌发酵产物,酸菜发酵液多糖的结构和功能越来越引起人们的关注。因此,本文利用乳酸菌发酵东北酸菜,对酸菜发酵液中多糖的分离纯化及结构进行初步研究,为进一步研究酸菜发酵液多糖的活性及开发利用提供理论依据。
1材料与仪器
1.1原料与试剂
原料:大白菜,辽宁阜新白菜生产基地。
1.2菌种
Lactobacillusplantarum1047,沈阳农业大学食品学院微生物实验室保存。
1.3试剂
无水乙醇、氯化钠、苯酚、硫酸、无水乙醚、丙酮、葡萄糖、三氯甲烷、三氯乙酸、正丁醇、考马斯亮蓝、1-甲基-3-苯基-5-吡唑酮(PMP)等(均为分析纯)、单糖(标准品)、乙腈(色谱级)、甲醇(色谱级),沈阳化工试剂公司;牛血清白蛋白,国药试剂公司;木瓜蛋白酶(酶活力10 000 U/g) 、DEAE-52纤维素、Sephadex-50,鼎国试剂公司。
1.4仪器
玻璃层析柱(2.6 cm×40 cm和1.6 cm×50 cm),国药试剂公司;722可见光分光光度计,上海菁华科技仪器公司;RE-52旋转蒸发仪,上海亚荣生化仪器有限公司;HL-2D恒流泵,上海青浦沪西仪器公司;UV-2450可见分光光度计,日本岛津公司;SA-205傅里叶交换光谱分析仪,Thorlabs公司;2489高效液相色谱仪,美国Waters公司。
2实验方法
2.1酸菜发酵液多糖的提取
取过滤后酸菜发酵液,经4 000r/min,30 min离心,低温浓缩(5∶1)后,常温下乙醇沉淀,条件为:加入浓缩液4倍体积量的无水乙醇,提取时间16 h,pH 8.4。将得到的沉淀经无水乙醇、乙醚、丙酮洗涤后,用60 ℃蒸馏水溶解,离心去杂质,上清液再醇沉,所得乳白色沉淀物质即为酸菜发酵液粗多糖。
2.2酸菜发酵液多糖的分离纯化
2.2.1酸菜发酵液多糖(SJP)脱蛋白
将酸菜发酵液粗多糖配制成浓度为10%的糖溶液。使用Sevag法:糖溶液和Sevag[(氯仿)∶(正丁醇)=4∶1]体积比为2∶1;TCA﹣正丁醇法:糖溶液和TCA﹣正丁醇(1∶5)体积比为2∶1;TCA与木瓜蛋白酶解结合法:先用0.8%木瓜蛋白酶再加入1.5% TCA;Sevag与木瓜蛋白酶解结合法:先用0.8%木瓜蛋白酶再加1/2体积的Sevag溶液,分别对酸菜发酵液多糖进行脱蛋白处理[4-7],所有试验均重复3次。用考马斯亮蓝染色法与苯酚-硫酸法分别测定4种方法处理后的蛋白质和多糖的剩余量,采用Excel 2010软件进行统计分析并绘图。应用SPSS17.0软件进行方差分析,利用Duncan多重比较进行差异显著性分析,选出最佳脱蛋白方法。
2.2.2DEAE-52纤维素离子交换层析
DEAE-52纤维素进行活化处理后,采用湿法装柱(2.6 cm×30 cm)[8-9]。取脱蛋白、透析后的粗多糖样品配制成质量浓度为10 mg/mL,上柱量为10 mL,按照顺序用蒸馏水及 0.1~0.5 mol/L NaCl溶液进行梯度洗脱,每个梯度洗脱20管,先经过纯水洗脱平衡除杂,收集洗脱液(7 mL/管),以硫酸-苯酚法进行跟踪检测,测定每管洗脱液490 nm波长处吸光度,以管数为横坐标,吸光度为纵坐标绘制洗脱曲线图。收集多糖主峰,经低温浓缩,透析后冷冻干燥得酸菜发酵液多糖(SJPⅡ)。
2.2.3Sephadex G-50葡聚糖凝胶柱层析
取30 mg SJPⅡ溶于10 mL蒸馏水中,上SephadexG-50柱(1. 6 cm×50 cm)进一步分离纯化[10],以蒸馏水洗脱,控制洗脱速度为0.5 mL/min,每支试管接洗脱液5 mL。后续操作同上,干燥得SJPⅡ-1。
2.3酸菜发酵液多糖纯度及结构组成分析
2.3.1SJPⅡ-1的紫外光谱分析
将SJPⅡ-1配成质量浓度为0.5 mg/mL的溶液,在190~400 nm范围内扫描,检测在核酸(260 nm)和蛋白质(280 nm)下是否有吸收峰,测定多糖的纯化效果。
2.3.2SJPⅡ-1的红外光谱分析
取SJPⅡ-1与KBr按1∶100的比例混合,在玛瑙研钵中均匀研磨,压片后置于傅里叶变换红外光谱仪中在4000~400 cm-1波段内扫描并观察记录谱峰[11]。
2.3.3SJPⅡ-1的高效液相色谱分析
将经过柱前衍生处理[12],离心取上清液并过滤所得的单糖标准品混合液和SJPⅡ-1水解样品分别进行洗脱分析。HPLC条件:色谱柱Kromasil C18(150 mm×4.6 mm),柱温为常温,流速0.9 mL/min,流动相为水和乙腈,体积比为20∶80,进样量10 μL,紫外检测波长为250 nm。对照单糖标准品的保留时间确定SJPⅡ-1的单糖组成。
3结果与讨论
3.1脱蛋白方法选择
对比4种脱蛋白方法(Sevag法、TCA﹣正丁醇法、TCA与木瓜蛋白酶解结合法、Sevag与木瓜蛋白酶解结合法),将醇沉后的粗多糖进行脱蛋白处理。如图1和图2可知,不同的脱蛋白方法对蛋白的脱除率和多糖损失率影响差异很大。由图1可知,酶与TCA结合法蛋白脱出率最高,显著高于其他3种脱蛋白方法(P<0.01)。在图2中,多糖损失率的高低顺序为:Sevag法>酶与Sevag结合法>TCA﹣正丁醇法>酶与TCA结合法。酶与TCA结合法多糖损失率最低,极显著低于其他3种方法(P<0.01)。综合比较得出:最好的脱蛋白方法为木瓜蛋白酶与TCA结合法,该方法的蛋白质脱除率高达94.86%,而多糖损失率仅为19.77%。
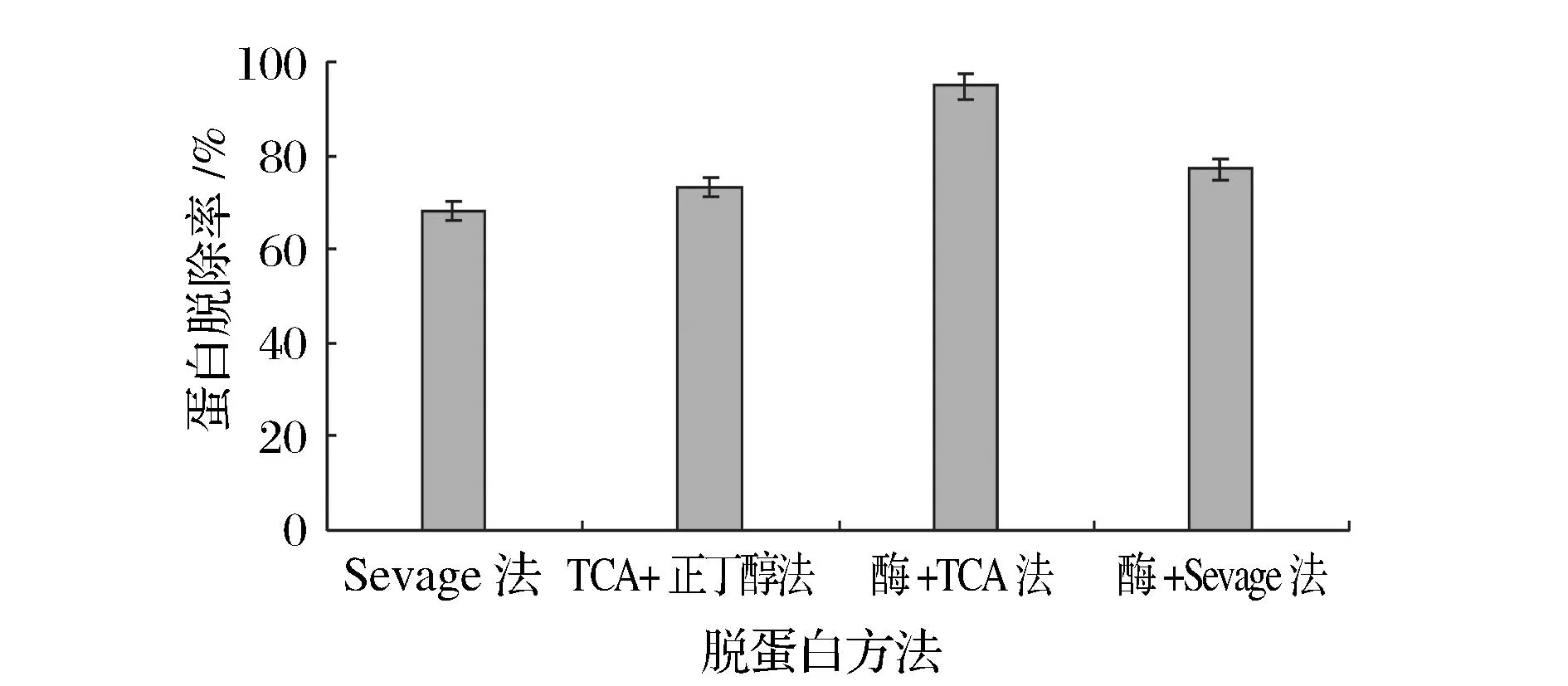
图1 四种脱蛋白方法的蛋白脱除率比较Fig.1 Comparison of removal rates of protein with four deproteinization methods
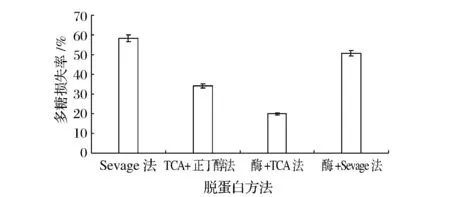
图2 四种脱蛋白方法的多糖损失率比较Fig.2 Comparison of loss rates of polysaccharides with four deproteinization methods
3.2DEAE-52纤维素柱层析
将经过脱蛋白处理得到的酸菜发酵液多糖(SJP)收集,冻干,获得纯化的SJP。将SJP上DEAE-52纤维素柱进行初级分离。由图3可知,经过纤维素柱洗脱后得到4个组分,按洗脱顺序分别命名为SJPⅠ、SJPⅡ、SJPⅢ、SJPⅣ。分别收集各吸收峰组分洗脱液,经低温浓缩,透析后冻干,计算出各组分得率分别为2.2%、64.72%、1.88%、2.37%。组分SJPⅡ收集体积最大且得率最高,本试验仅对SJPⅡ进行进一步分离纯化和结构组成分析。
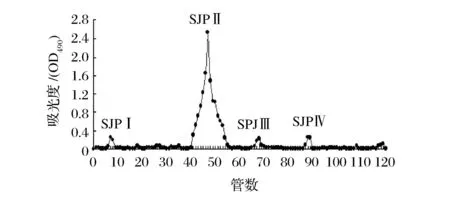
图3 DEAE-52纤维素柱洗脱曲线Fig.3 Elution curve of polysaccharide on DEAE-52 cellulose column
3.3SJPⅡ的Sephadex G-50柱层析
将经纤维素柱分离的SJPⅡ进一步经葡聚糖凝胶柱分离纯化。由图4得,经蒸馏水洗脱后,SJPⅡ只有1个洗脱峰,说明SJPⅡ是成分单一的多糖。收集吸收峰,浓缩冻干得白色沉淀SJPⅡ-1。
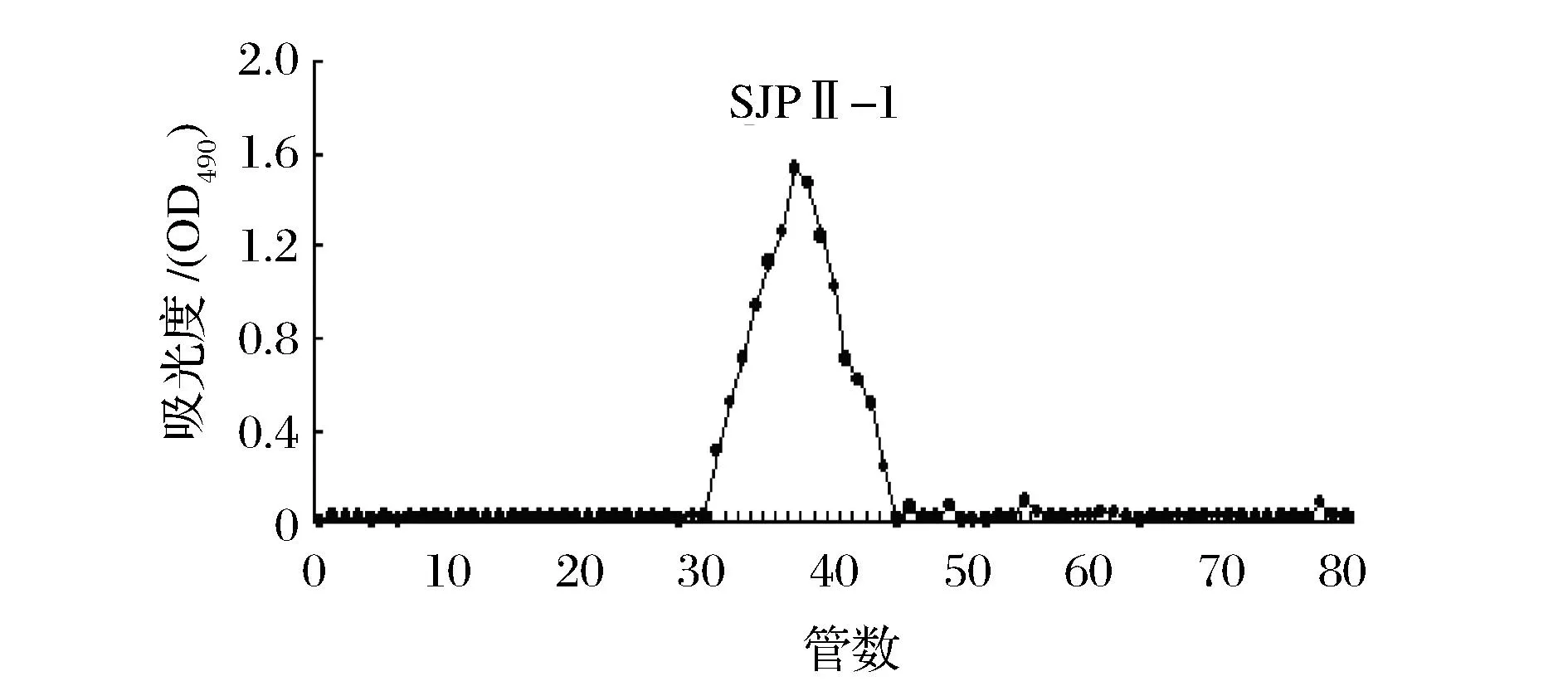
图4 Sephadex G-50层析柱洗脱曲线Fig.4 Elution curve of polysaccharide on Sephadex G-50 column
3.4SJPⅡ-1的紫外光谱分析
如图5所示,SJPⅡ-1在260 nm和280 nm波长处均无明显吸收峰,说明经过DEAE-52纤维素柱和Sephadex G-50凝胶柱层析后所得的多糖较纯,基本不含蛋白质和核酸等杂质
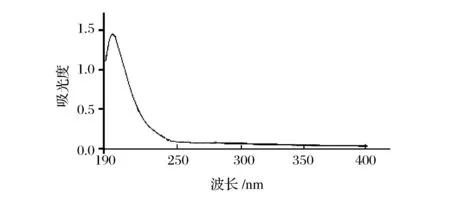
图5 SJPⅡ-1的紫外光谱Fig.5 UV spectra of SJPⅡ-1
3.5SJPⅡ-1的红外光谱分析
由图6可知,3 411 cm-1处出现一个较宽的吸收峰,是己糖环上的O—H伸缩振动峰,表明多糖存在分子内和分子间的氢键;2 930 cm-1左右处为C—H的伸缩振动吸收峰;1 600 cm-1处为C—O—C伸缩振动峰;1 400 cm-1左右处为C—H的变角振动峰,以上4处峰均为多糖的特征吸收峰。此外在1 088 cm-1处的吸收峰可证明SJPⅡ-1存在吡喃环构型的单糖。
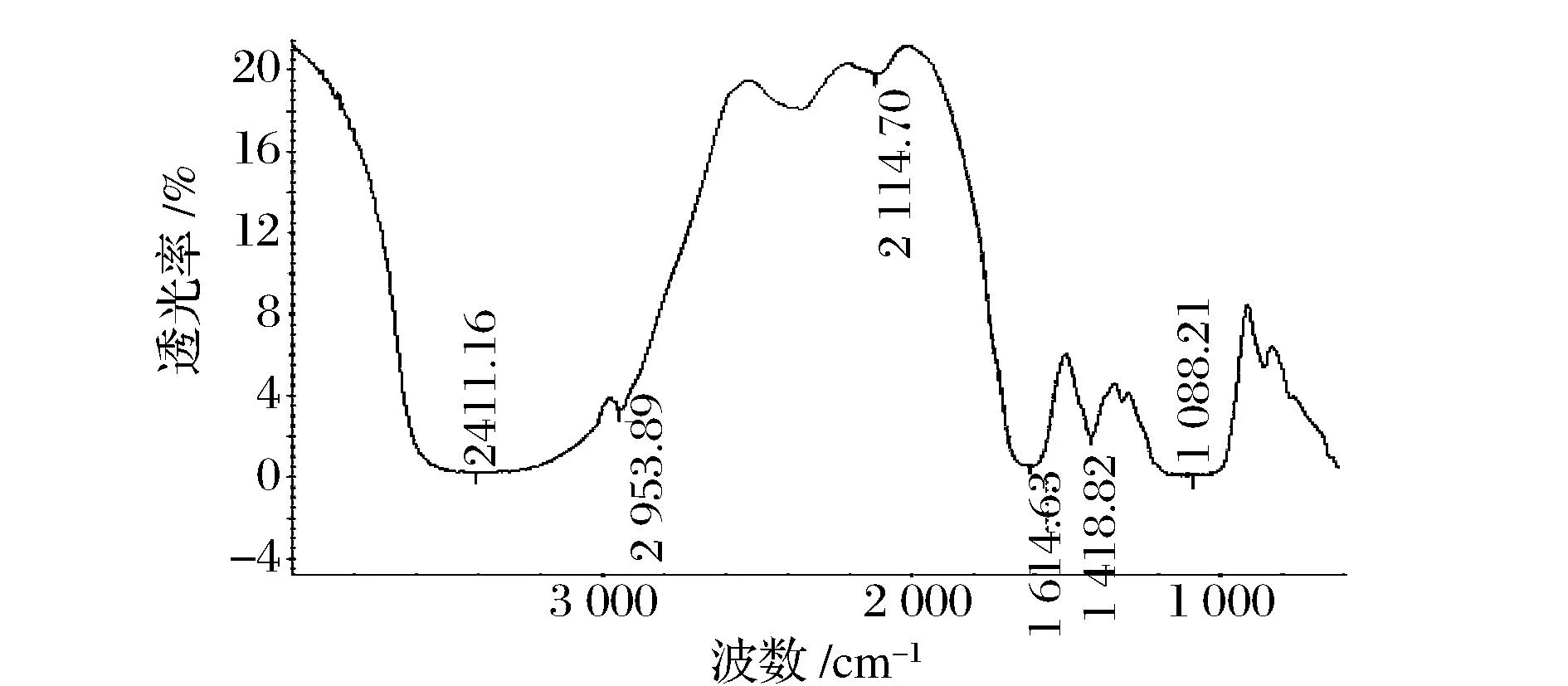
图6 SJPⅡ-1的红外光谱Fig.6 IR spectra of SJP
3.6HPLC分析SJPⅡ-1的单糖组成
由图7可知,SJPⅡ-1中含有果糖(Fru)、甘露糖(Man)、鼠李糖(Rham)、葡萄糖(Glu)。经过计算,Fru∶Man∶Rham∶Glu=1∶0.33∶0.46∶0.39。
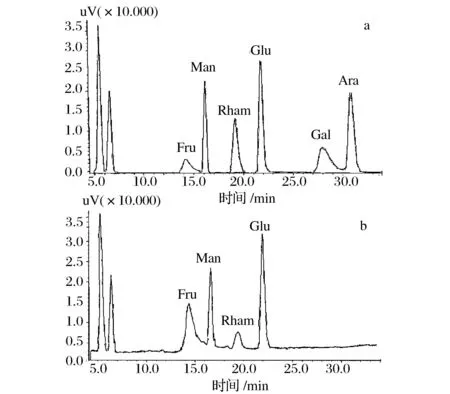
图7 单糖混合标准液(a)及SJPⅡ-1 (b)的HPLC图谱Fig.7 HPLC chromatograms of mixture of monosaccharide standards and SJPⅡ-1
4结论
本试验对醇沉后获得的酸菜发酵液粗多糖的分离纯化和结构进行了研究与分析。对4种脱蛋白方法进行比较,以蛋白清除率、多糖损失率为评价指标,确定了酶法与TCA结合法为最好的脱蛋白方法,经过DEAE-52纤维素柱与Sephadex G-50柱层析进行分级分离,得到白色固体SJPⅡ-1, 经红外光谱及高效液相色谱检测与组分分析后,得出SJPⅡ-1主要由果糖、甘露糖、鼠李糖、葡萄糖4种单糖组成。
随着活性多糖的抗癌、抗肿瘤的功能的研究和利用,除植物中天然存在的多糖外,微生物发酵产生的胞外多糖的研究也越来越广泛。各种真菌多糖已经在食品、发酵、医疗保健中广泛应用,但细菌胞外多糖研究和利用还鲜见报端。本试验对乳酸菌接种发酵酸菜的发酵液中可溶性胞外多糖进行初步的结构分析,结果表明该提取物具有多糖的结构特征。因此,本研究可为酸菜发酵液多糖进一步的活性研究及开发应用提供理论支持。
参考文献
[1]XIONG Tao, LI Xiao, GUAN Qian-qian, et al. Starter culture fermentation of Chinese sauerkraut: Growth, acidification and metabolic analyses[J]. Food Control, 2014,41:122-127.
[2]武俊瑞,张苗,蔡淼,等. 自然发酵酸菜发酵液中化学成分测定[J]. 食品科学,2012,33(16): 117-119.
[3]张丽,张兰威,韩雪. 乳酸菌胞外多糖的研究进展[J]. 食品工业科技,2012,33(17): 378-381;387.
[4]王龙艳,王文侠,张慧君,等. 豆渣碱溶性粗多糖除蛋白工艺的研究[J]. 中国食品添加剂,2013(1): 98-103.
[5]黄洁,徐文清,郎玉娇,等. 石花多糖脱蛋白工艺研究[J]. 医药导报,2008(6): 689-692.
[6]吴金松,郑炯,夏雪娟,等. 大叶麻竹笋多糖分离纯化工艺[J]. 食品科学,2015,36(2): 80-84.
[7]魏杰,吕磊,金莉莉,等. 茄枝多糖的分离纯化及成分分析[J]. 食品科学,2015,36(4):168-171.
[8]HU Hao-bin, LIANG Hai-peng , WU Yun. Isolation, purification and structural characterization of polysaccharide fromAcanthopanaxbrachypus[J]. Carbohydrate Polymers, 2015,127(8):94-100.
[9]安晓娟,冯琳,宋红平,等.淫羊藿多糖的分离纯化及结构初步分析[J]. 生物学杂志, 2012, 29(3): 39-41,82.
[10]魏杰,吕磊,金莉莉,等. 茄枝多糖的分离纯化及成分分析[J]. 食品科学,2015,36(4): 168-171.
[11]YANG Wei-fang, WANG Ying, LI Xiu-ping, et al. Purification and structural characterization of Chinese yam polysaccharide and its activities[J]. Carbohydrate Polymers, 2015,117(3):1 021-1 027.
[12]尹巧汕. 九州虫草子座多糖的分离纯化,理化性质、结构及抗氧化活性测定[D].济南:山东大学,2012.
Purification of polysaccharide from Sauerkraut juice and its structure analysis
RONG Xiang-hua1, ZHANG Xuan1, ZHAO Chun-yan1,2*
1 (College of Food Science, Shenyang Agricultural University, Shenyang 110161, China) 2 (Shenyang Institute of Technology, Fushun 113122, China)
ABSTRACTIn order to extract and purify crude polysaccharides from Sauerkraut juice (JSP) and study its preliminary structure and monosaccharide composition, the crude polysaccharide was obtained from sauerkraut juice by ethanol extraction method. Four methods, such as Sevag, trichloroacetic acid (TCA)-n-butyl alcohol, combination of TCA with papain, combination of Sevag with papain, were selected to remove protein. Further purification was conducted by DEAE-52 cellulose and Sephadex G-50 gel column chromatograph. The obtained SJPII-1 was analyzed by infrared spectrum (IR) and high performance liquid chromatography (HPLC). Results showed that the best deproteinization method was combined use of TCA and papain, which resulted in a deproteinization rate of 94.86% and a polysaccharide loss of 19.77%. Results from IR showed that SJP II-1 possessed a feature structure of polysaccharide. Monosaccharide composition of SJP II-1 was measured with HPLC. SJP II-1 was composed of fructose, mannose, rhamnose, and glucose.
Key wordsSauerkraut juice; polysaccharide; purification; structure; monosaccharide
收稿日期:2015-10-22,改回日期:2015-12-18
基金项目:辽宁省教育厅科学计划项目(2014L566)
DOI:10.13995/j.cnki.11-1802/ts.201604023
第一作者:硕士研究生(赵春燕教授为通讯作者,E-mail:zhaochunyan108@163.com)。
