功能多样性和功能冗余对高寒草甸群落稳定性的影响
2016-05-23姚天华朱志红李英年潘石玉孔彬彬卫欣华杜家丽
姚天华, 朱志红,*, 李英年, 潘石玉, 孔彬彬, 卫欣华, 杜家丽
1 陕西师范大学生命科学学院,西安 710062 2 中国科学院西北高原生物研究所,西宁 810008
功能多样性和功能冗余对高寒草甸群落稳定性的影响
姚天华1, 朱志红1,*, 李英年2, 潘石玉1, 孔彬彬1, 卫欣华1, 杜家丽1
1 陕西师范大学生命科学学院,西安7100622 中国科学院西北高原生物研究所,西宁810008
摘要:功能多样性和功能冗余是影响群落稳定性的重要因素,但它们对稳定性影响的相对强弱尚有争论。通过在青藏高原高寒矮嵩草(Kobresia humilis)草甸为期6a的刈割(不刈割、留茬3cm、留茬1cm)和施肥(施肥、不施肥)控制实验对此进行了探讨。研究结果显示,群落稳定性随着功能多样性和功能冗余的增大而单调增加,但由于功能多样性的变异性大于功能冗余的变异性,功能多样性与物种多样性间的相关性强于功能冗余与物种多样性间的相关性,功能多样性与群落稳定性间的相关性也强于功能冗余与群落稳定性间的相关性,因此,尽管功能冗余产生的保险效应对维持群落稳定性具有促进作用,但功能多样性的互补效应对维持群落稳定性的作用更大。结果表明,功能多样性和功能冗余对群落稳定性的相对影响与其变化程度正相关,功能多样性与群落稳定性的变化具有更紧密的联系,能更好地预测生态系统稳定性的变化。研究为草原生态系统的可持续管理提供了重要启示。
关键词:高寒草甸;功能多样性;功能冗余;群落稳定性
生物多样性丧失对生态系统功能的潜在影响是生态学家持续关注的热点问题[1- 2]。大量研究表明,物种多样性对群落稳定性具有正效应[3- 8]。由于生态系统功能由物种的功能属性决定[9- 10],物种多样性(SD)既包括功能多样性(FD),也包括功能冗余(FR)[11- 12]。因此,物种多样性下降或物种丧失引起的植物功能性状丢失、功能性状组成变化、或性状空间维度减小,必将导致功能多样性和功能冗余发生改变,进而影响群落稳定性。但功能多样性和功能冗余究竟哪个对群落稳定性影响较大,仍未达成共识。尽管理论[13- 15]和实验[16- 18]研究均证实功能冗余也是维持群落稳定性的一个关键特征,但长期以来有关功能多样性和功能冗余对群落稳定性相对影响的定量研究很少[16]。
功能多样性是指群落或生态系统中有机体功能性状的值和变化范围[9- 10,19],即影响植物功能的形态、生理或物候性状的组成与变化[20],是用来表示种间功能属性相对差异性和生态互补性的指标,因而在决定生态系统功能上比物种多样性具有更为直接的作用[1,21- 24]。功能冗余是指生态系统中执行相似功能的物种的多样性[11,16],即群落中具有相似功能性状物种的饱和程度[12]。由于冗余物种具有相似的生态功能[25],可相互取代,其丧失不会影响生态系统功能[26]。但功能冗余的存在并不意味着冗余物种可有可无,冗余物种对于确保扰动后生态系统的恢复是必需的[13,27]。因此,功能冗余对于维持生态系统过程具有保险作用[16,28]。由此可见,作为物种多样性的两个重要成分[12],功能多样性和功能冗余分别表示种间功能性状的相异性和相似性,并分别通过生态互补和保险效应影响生态系统功能。
一般认为,当功能多样性随物种多样性增加表现为饱和增加模式,就预示存在功能冗余[16,29- 30]。但这种定性描述并不能量化生态梯度上不同群落的功能冗余程度[16]。de Bello等提出的方法[12]为量化功能冗余,并研究功能多样性和功能冗余与群落稳定性间的关系奠定了基础。该方法是将Simpson物种多样性指数(SD)分为功能多样性(FD)和功能冗余(FR)两部分,即SD=FD+FR[12],反映出物种多样性是产生功能多样性和功能冗余的基础,通过计算一个群落的Simpson物种多样性指数和功能多样性,就能确定其功能冗余的大小。de Bello等认为,SD是潜在的最大FD或FR[12]。因为当群落物种具有完全不同的功能性状而表现出功能唯一性时,FR=0,SD=FD[12],任何物种的丧失都会对群落稳定性造成显著影响,就像铆钉假说(rivet hypothesis)预测的那样[28],群落稳定性应完全依赖于功能多样性;与之相反,当所有物种的功能性状相同而表现出功能完全重叠时,FD=0,SD=FR[12],物种丰富度越高,功能冗余就越大[14],群落稳定性应完全依赖于功能冗余。然而,自然群落中FD或FR的大小应处于上述两种极端情况之间,共同维持着群落稳定性。但Valone和Barber[18]认为功能冗余产生的保险效应并非维持陆生群落稳定性的强有力机制,因为物种对环境波动主要表现为同步响应而非保险效应所要求的异步响应。与此观点相反,Pillar等人对巴西南部放牧草地的研究显示[16],物种多样性对群落稳定性的维持作用仅来自功能冗余的保险效应,功能冗余越高,植物功能性状组成在扰动前后也更相似[16],且功能冗余与物种多样性的正相关性(R=0.769,P=0.0001)强于功能多样性与物种多样性的正相关性(R=0.537,P=0.0026),而功能多样性对稳定性无影响[16]。可以注意到,该研究所用草地放牧历史较长[16],植物对放牧选择压力的趋同响应产生的内在冗余[30]可能是功能冗余成为维持群落稳定性主要动力的原因。另外,该实验研究仅持续1a,功能多样性的变化小于功能冗余的变化[16],也可能是造成功能多样性对稳定性无影响的原因。就SD=FD+FR来说,尽管在特定环境和扰动条件下SD的变化是引起FD和FR变化的首要因素,但FD和FR的变化程度不一定相同,甚至可能出现其中一个变化,另一个保持相对不变的情况。因此,在物种多样性与群落稳定性正相关[3- 8]的前提下,根据上述分析以及Pillar等人的研究结果[16],可做如下推测:功能多样性和功能冗余中变异性较高者更有可能对群落稳定性产生较大影响,因为具有较高变异性的成分就意味着对物种多样性的生态系统功能效应产生更大影响。因此,功能多样性和功能冗余对群落稳定性的相对影响应该与其在特定环境或扰动条件下的变化程度正相关。
通过在青藏高原高寒草甸为期6a(2007—2012年)的一项刈割和施肥控制实验,采用de Bello等人的计算方法[12]量化功能冗余,研究了功能多样性和功能冗余对群落稳定性的相对影响。高寒草甸生态系统作为青藏高原最重要的自然生态系统类型之一,是全球变化的敏感区和生物多样性重点保护区,长期受放牧家畜的强烈影响,加之地处高寒,虽然土壤有机质丰富,但其矿化率较低,可利用养分缺乏,不能满足植物生长需要[31],施用化肥就成为高寒草甸改良和管理中的常见措施。但长期施肥在提高生产力的同时,也会降低物种丰富度[32]。适度放牧虽能提高物种丰富度,但普遍存在的过度放牧仍是导致高寒草甸退化的最重要因子。因此,放牧扰动强度和土壤养分获得性的变化是影响该生态系统最重要的两种因素。现有研究表明,刈割和施肥能分别增加和减小高寒草甸的物种多样性、群落稳定性[33]和功能多样性[34]。物种多样性与群落稳定性正相关,刈割和施肥能分别提高和降低多样性对稳定性的影响[33]。功能多样性随物种多样性增加表现为减速递增模式,群落存在一定的功能冗余[35]。这说明功能多样性和功能冗余都可能提高该群落的稳定性,但两者促进群落稳定性效应的差异目前并不明确。通过研究该群落功能多样性和功能冗余在刈割扰动和土壤养分梯度上的变化及其与群落稳定性的关系,有助于深入揭示高寒草甸在这两种重要外部因子影响下群落结构的变化及其影响生态系统功能的机制。本研究待检验的2个假定是:(1)由于刈割和施肥能分别增加和降低物种多样性,因而也能通过增加或降低功能多样性和功能冗余提高或降低群落稳定性,但如果刈割和施肥的相反效应相互抵消,其互作效应可能对群落稳定性无显著影响;(2)在刈割和施肥处理影响下,功能多样性和功能冗余的变化程度存在差异,该变异性与其对群落稳定性的影响正相关。
1材料和方法
1.1研究区概况
野外实验在中国科学院海北高寒草甸生态系统定位站矮嵩草(Kobresiahumilis)草甸内进行。该站位于青藏高原东北隅(37°29′—37°45′N,101°12′—101°23′ E),隶属青海省海北藏族自治州门源回族自治县。站区平均海拔3200m,年平均气温-1.7℃,最冷月(1月)平均气温-14.8℃,最热月(7月)平均温度9.8℃,年平均降水量580mm,6—9月降水量占全年降水量的68.6%[36]。矮嵩草草甸地势平缓,为当地冬春草场(每年11月—年5月底放牧,6—10月休闲,家畜转至夏季高山牧场),放牧家畜为藏羊和牦牛。矮嵩草草甸土壤为高山草甸土[37],呈微碱性[38],植株低矮,群落结构简单,初级生产力低。主要植物有矮嵩草、垂穗披碱草(Elymusnutans)、粗喙薹草(Carexscabrirostris)、异针茅(Stipaaliena)、羊茅(Festucaovina)、美丽风毛菊(Saussureasuperba)、瑞苓草(S.nigrescens)、圆萼藦苓草(Morinachinensis)、蕨麻(Potentillaanserina)、雪白委陵菜(P.nivea)、甘肃棘豆(Oxytropiskansuensis)、钝裂银莲花(Anemoneobtusiloba)和萎软紫菀(Asterflaccidus)等。
1.2研究方法1.2.1实验设计
实验样地建于2007年4月底,面积0.6ha(100m×60m)。样地建立前,草地处于家畜自由放牧状态,放牧强度中等。实验为3因子裂区嵌套设计,包括3个刈割水平、2个施肥水平、2个水分添加水平,3区组,每区组5个4m×4m大样方。实验主区为刈割处理,刈割留茬高度分别为1cm(H1)、3cm(H3)和不刈割(NH, 对照),2个刈割处理的刈割量分别为当年总地上生物量的60%—70%和45%—50%。此留茬高度是根据过去在该群落进行藏羊放牧实验时[31-32],在重度和中度放牧强度(放牧强度分别为5.35和4.30只藏羊/ha,牧草利用率分别为60%和45%)下6月中上旬的群落实际高度确定的,可以认为这两个刈割处理相当于重度和中度放牧强度下的牧草利用率。实验副区嵌套于主区中,用4块长2m、宽0.25m的铁皮十字形纵切嵌入草地0.25m深,将每个主区大样方分隔成4个2m×2m的副区样方,设置4个副区处理(图1)[34],即:1)不施肥不浇水(NFNW);2)仅施肥(F);3)仅浇水(W);4)既施肥又浇水(FW),共180个副区样方。刈割、施肥和浇水处理在副区样方中央1.5m×1.5m范围内进行,4个副区样方相互间隔0.5m。在每个副区样方内设4个0.5m×0.5m观测样方,其中1个为长期观测物种组成变化的永久样方,剩余3个用于植物功能性状测定。

图1 副区处理样方设置图[34]Fig.1 Quadrats layout of subplot [34]NFNW,不施肥,不浇水;F,仅施肥;W,仅浇水;FW,既施肥,又浇水。
每年生长季开始至植物高度达到10cm左右时(6月中旬)实施刈割处理。每年施肥3次,分别于5—7月中旬进行,每次施撒尿素4.25 g/m2(含N 20.4%)及磷酸二胺1.02 g/m2(含N 5.9%,P 28.0%),每年添加N、P的总量分别为2.782 g/m2和0.857 g/m2。施肥后用喷壶浇水4.5kg/m2,浇水总量为年降水量的2.4%。为确定嵌入草地0.25m深的雪花铁皮及0.5m的样方间隔能否有效隔离副区4个样方间的水、肥渗透,我们于2007年7月15日,在前次降雨5d后,在样地围栏外地势平坦的草地中设置3个1.5 m×1.5m的样方,用喷壶各浇水10kg(相当于4.5 kg/m2),分别于浇水后1、2、3h和4h沿垂直于样方边缘的方向向外挖出长0.3m、宽0.05m、深0.3m的沟槽,观察水分沿土壤水平和垂直方向的渗透距离,确定隔离效应。结果显示,浇水后3—4h水分即停止渗透,3个样方中水分向外和向下的最大渗透距离分别为0.065m和0.06m,远小于铁皮嵌入深度和样方间距。说明本实验设计能有效隔离不同处理间的水、肥渗透。
对2007年和2008年的数据分析显示,浇水的作用不显著,故2009年每次浇水量增至6.7 kg/m2,为年降水量的3.6%。但仍对物种多样性、群落地上净初级生产力及其稳定性无显著影响[33],因此,自2010年始停止浇水处理。本文的数据分析只考虑刈割与施肥效应。
1.2.2取样测定
每年8月初进行群落调查,计测永久样方的物种数和种群密度(分别以单株散生植物和丛生植物的个体数和分株数计数密度)。
2012年8月中旬,在性状测定样方中随机选取5株被测物种的健康植株,计测株高和总叶片数,剪取地上部分,用激光叶面积仪(CI-203,美国CID公司中国分公司,北京)测定5株植物的总叶面积,然后置于60℃烘箱中72h,称取茎、叶干重,计算单株平均地上重(g)、平均叶面积(m2)、比叶重(kg/m2)和比叶面积(m2/kg)。由于有些物种,如鳞叶龙胆(Gentianasquarrosa)等,其植株矮小,叶片极小且抱茎,基部合生成筒状,在野外测定叶面积很困难,本文最后以26个共有物种的6个定量性状(植株地上重、株高、叶干重、叶面积、比叶面积和比叶重)计算功能多样性。
根据《西藏植物志》的描述和相关文献中植物定性性状对放牧或刈割以及土壤养分资源变化的响应研究报道[39- 45],以群落调查中所有78个物种的7个定性性状用于计算功能多样性。这7个性状及其分类状态为生长型(疏丛生,莲座状,密丛生,匍匐状,单株散生)、子叶类型(单子叶,双子叶)、植物经济类群(禾草,莎草,豆科植物,其它双子叶杂类草)、生活周期(多年生,一年生或二年生)、光合途径(C3植物,C4植物)、营养繁殖器官(无,有(包括根茎,匍匐茎,块茎)和叶表面特征(光滑,具毛,具刺)。
在计算功能多样性时,对物种×性状状态数据矩阵中每个物种定性性状的状态进行赋值分类,并标准化,使赋值之和等于1。其中,对于仅有单一性状状态的物种,以0、1进行赋值。如,垂穗披碱草属于禾草,在经济类群的禾草这一列中赋1,在其它列中赋0。对于具有多重性状状态的物种,则使用模糊编码进行赋值。例如,蕨麻兼有匍匐茎和块茎,在营养繁殖器官的匍匐茎这一列赋0.5,在块茎这一列赋0.5,其它列则赋0。对于定量性状,则对其实测值标准化使其数据统一映射到[0, 1]区间上用于运算。
1.3数据计算与统计分析1.3.1功能冗余FR
功能冗余FR采用de Bello等[12]的公式计算:
FR=D-Q
(1)
式中,D为Simpson多样性指数[46],Q为表示功能多样性的Rao系数[24]。D、Q分别以下式计算:
(2)
(3)
式中,S为永久样方内的物种数;Pi和Pj分别为样方中第i和j个物种的相对密度;dij为欧氏距离,0 ≤dij≤ 1,表示物种i、j在一组性状空间中的相异性。通过采用物种相对密度对dij进行加权,Rao系数描述了种间功能性状的相对差异,是所有性状Q值的平均值[24],比其它功能多样性指数更适合表征群落的种间相对差异[47- 49],也能更好地将物种丧失与生态系统功能变化相联系[49- 50]。对于所有成对物种,如果dij=1(即物种完全不同),则Q=D。因此,Rao系数实际上是Simpson多样性指数的一般式[24],表示一个特定群落的潜在最大功能多样性[12]。
本文通过计算13个性状(6个定量性状,7个定性性状)的Q值得到功能冗余值。
1.3.2群落稳定性
群落稳定性以物种种群密度变异系数(CV)的倒数ICV表示[32- 33,51]:
(4)
式中,μ为样方中各物种的平均密度,σ为各物种密度的标准差。ICV值越大,群落稳定性越高,因为相对于平均密度,各物种密度的变异性较小[52]。在本研究样地,由于各实验处理样方物种的平均密度与其地上净初级生产力显著正相关(P<0.05)[33],以密度计算的群落稳定性也能表征生态系统生产力的稳定性[32-51]。
1.3.3功能冗余和功能多样性的变异性
不同实验处理物种功能多样性和功能冗余的变异性以变异系数CV(FR/Q)表示。计算公式如下:
(5)
式中,σ(FR/Q)和μ(FR/Q)分别表示功能冗余(FR)或功能多样性(Q)的标准差和平均值,以相同实验处理同一区组的5个样方计算。统计分析时以每处理3个区组CV(FR/Q)的平均值表示。
1.3.4统计分析
统计分析采用SPSS Version 21.0软件进行,所用数据采自2012年。由于本研究并非物种多样性控制实验,实施刈割和施肥等处理后引起的物种多样性、功能多样性、功能冗余的变化都可能受实验处理前群落物种丰富度本底差异的影响。为了控制并消除此影响,用2007年第1次刈割和施肥处理前调查的物种丰富度为协变量予以校正,并采用裂区设计的Univariate ANCOVA混合模型分析实验处理对物种多样性、功能多样性、功能冗余及群落稳定性的影响。模型的变异来源在主区为刈割和区组,副区为施肥、以及刈割×施肥、施肥×区组的交互作用。如果实验处理与协变量间的互作效应显著,就表示协变量会改变物种多样性、功能多样性、功能冗余与群落稳定性间的关系。如果刈割×施肥两因素的交互作用显著,则针对其中一个因素对另一因素进行Univariate ANOVA分析。分析前对数据进行对数转换,并进行正态性和方差齐性检验,以满足方差分析的假定。各处理平均数之间的多重比较采用Duncan氏检验。
采用成对样本的T检验分析功能冗余与功能多样性变异系数间的差异。如果差异显著,就表示功能多样性和功能冗余对同一实验处理的响应变化程度不同。T检验分别在以下5个处理组合梯度上进行:不施肥-刈割强度(3个刈割强度,3个区组,n=9),施肥-刈割强度(3个刈割强度,3个区组,n=9),不刈割-施肥(2个施肥水平,3个区组,n=6),中度刈割-施肥(2个施肥水平,3个区组,n=6)以及重度刈割-施肥(2个施肥水平,3个区组,n=6)。协方差分析和T检验的显著水平均设为P< 0.05。
由于物种多样性与功能多样性间可能存在正线性、饱和增加及S形曲线3种关系[29],采用线性、对数、指数、幂函数以及Logistic曲线5种模型拟合了功能多样性-物种多样性、功能冗余-物种多样性、功能多样性-功能冗余、群落稳定性-功能冗余以及群落稳定性-功能多样性间的关系,以F检验显著(P<0.05)且决定系数R2值最大的模型为最优回归模型。
采用二元逐步回归分析,以群落稳定性为因变量,以功能多样性和功能冗余为自变量,确定功能多样性和功能冗余对稳定性的相对影响。影响程度以标准化的偏回归系数确定。此分析也分别在不施肥-刈割强度 (n=90)、施肥-刈割强度(n=90)、不刈割-施肥(n=60)、中度刈割-施肥(n=60)以及重度刈割-施肥(n=60)5个组合梯度上进行,以比较刈割和施肥的影响。
2结果和分析
2.1刈割和施肥对物种多样性、功能多样性、功能冗余和群落稳定性的影响
协方差分析显示,协变量与刈割或施肥的交互作用不具有显著效应(P>0.05),满足协方差分析中斜率相同的条件。在相同物种丰富度条件下(SR=1.449)对修正均数的分析表明,刈割增加了物种多样性、功能多样性和群落稳定性,而施肥的作用则相反。刈割和施肥对功能冗余的影响都不显著,刈割×施肥以及施肥×区组的交互作用也无显著效应(表1,表2)。
表1刈割和施肥对高寒草甸物种多样性、功能多样性、功能冗余和群落稳定性的影响的协方差分析
Table 1ANCOVA for the effects of clipping and fertilizing on the species diversity, functional diversity, functional redundancy and community stability in alpine meadow

变异来源Sourcesofvariance自由度df(m,n)DQFRICVFPFPFPFP主区B(2,2)11.4070.006**13.4510.004**3.1130.10814.3910.003**WholeplotC(2,8)6.2630.028*8.7230.013*0.8180.4797.8810.047*副区F(1,2)6.8320.035*26.5920.001**1.7040.23311.7750.011*SubplotC×F(2,8)0.3410.7220.5690.5900.1120.8960.2860.760B×F(2,8)1.6310.2622.2160.1800.9080.4461.6120.266
*P<0.05;**P<0.01;m:处理自由度;n:误差自由度;B:区组;C:刈割;F:施肥;×:交互作用;D:Simpson物种多样性;Q:功能多样性;FR:功能冗余;ICV:群落稳定性
表2物种多样性、功能多样性、功能冗余和群落稳定性在刈割和施肥处理下的变化(平均值±标准误)
Table 2Changes of species diversity, functional diversity, functional redundancy and community stability under the clipping and fertilizing treatments (mean ± SE)
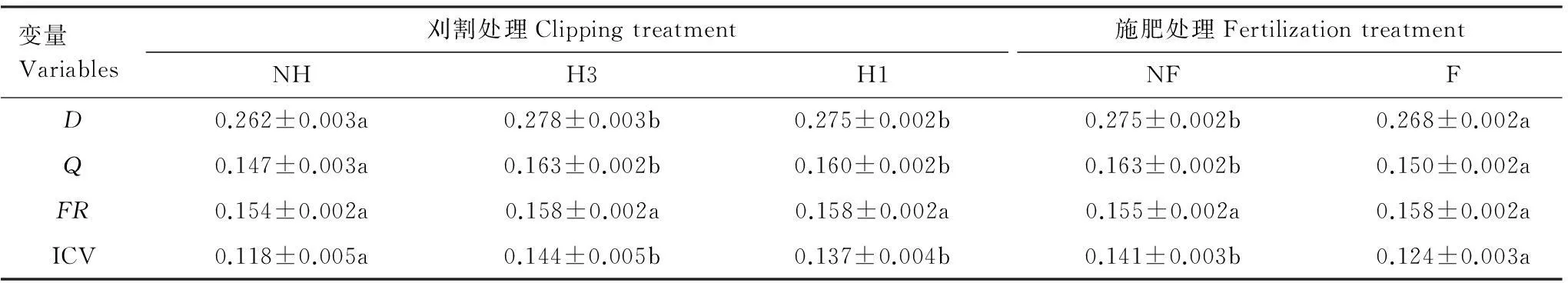
变量Variables刈割处理Clippingtreatment施肥处理FertilizationtreatmentNHH3H1NFFD0.262±0.003a0.278±0.003b0.275±0.002b0.275±0.002b0.268±0.002aQ0.147±0.003a0.163±0.002b0.160±0.002b0.163±0.002b0.150±0.002aFR0.154±0.002a0.158±0.002a0.158±0.002a0.155±0.002a0.158±0.002aICV0.118±0.005a0.144±0.005b0.137±0.004b0.141±0.003b0.124±0.003a
D、Q、FR和ICV的含义同表1;NF,F,NH,H3和H1分别表示不施肥,施肥,不刈割,中度刈割和重度刈割;表中刈割或施肥处理下同行平均值后的相同字母表示无显著差异(P﹥0.05)
2.2功能多样性与功能冗余的变异性
T-检验结果显示,功能多样性的变异系数值均大于功能冗余的变异系数值,且在不刈割-施肥(NH-F)和重度刈割-施肥(H1-F)梯度上出现显著差异(P<0.05)(表3)。
表3不同处理组合梯度上功能多样性与功能冗余变异性的T-检验
Table 3T-test for the variability for functional diversity and functional redundancy under different treatment combinations with clipping and fertilizing
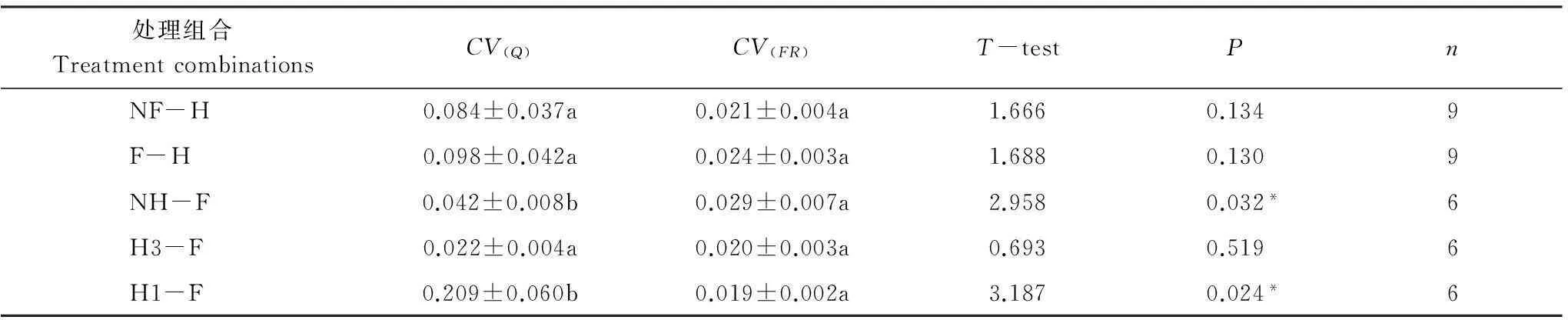
处理组合TreatmentcombinationsCV(Q)CV(FR)T-testPnNF-H0.084±0.037a0.021±0.004a1.6660.1349F-H0.098±0.042a0.024±0.003a1.6880.1309NH-F0.042±0.008b0.029±0.007a2.9580.032*6H3-F0.022±0.004a0.020±0.003a0.6930.5196H1-F0.209±0.060b0.019±0.002a3.1870.024*6
*P<0.05;CV(Q)和CV(FR)分别表示功能多样性和功能冗余的变异系数;n表示样本量;NF-H:不施肥-刈割强度;F-H:施肥-刈割强度;NH-F:不刈割-施肥;H3-F:中度刈割-施肥;H1-F:重度刈割-施肥; 表中同行平均值后的相同字母表示无显著差异(P>0.05)
2.3物种多样性、功能多样性、功能冗余和群落稳定性间的关系
回归分析显示,功能多样性与物种多样性(Q-D)为正相关(图2),但最优模型随处理有所不同(表4)。不施肥时(NF-H),由于幂值(1.131)大于1,Q将随D增速递增,施肥后(F-H)则线性增加。不刈割时(NH-F),Q随D线性增加,刈割后(H3-F, H1-F),Q随D减速递增(图2)。说明施肥或刈割会降低Q随D的增速。
功能冗余与物种多样性(FR-D)也为正相关(图2)。不施肥和施肥时(NF-H, F-H)的最优模型都为幂函数(表4),且幂值在0—1之间,FR为D的减速递增函数,但不施肥时幂值(0.881)大于施肥时(0.562),因此,施肥后FR的增速较低(图2)。不刈割时(NH-F),FR-D关系也为幂函数(表4),幂值为0.702,FR随D减速递增(图2)。刈割后,FR-D关系变为指数函数(表4),由于底数e大于1,FR为D的增速递增函数。与中度刈割(H3-F, 图2)相比,重度刈割(H1-F, 图2)会降低FR随D的增速。
表4不同处理组合梯度上物种多样性、功能多样性、功能冗余和群落稳定性关系的最优回归模型
Table 4Optimal regression models between species diversity, functional diversity, functional redundancy and community stability on gradients by different treatment combinations with clipping and fertilizing

处理组合TreatmentcombinationsQ(y)-D(x)FR(y)-D(x)Q(y)-FR(x)ICV(y)-Q(x)ICV(y)-FR(x)NF-Hy=0.523x1.131y=0.478x0.881y=e(-0.425-0.191/x)y=0.030e5.544xy=0.022e6.664xF-Hy=0.714x-0.195y=0.479x0.562—y=0.063e3.946xy=0.041e4.704xNH-Fy=0.659x-0.142y=0.484x0.702y=0.357e0.424xy=0.059e4.047xy=0.047e4.393xH3-Fy=e(0.429-1.087/x)y=0.203e0.863x—y=0.044e4.741xy=0.028e5.995xH1-Fy=1.106-0.582/xy=0.272e0.536x—y=0.049e4.521xy=0.052e4.421x
功能多样性与功能冗余(Q-FR)在不施肥时(NF-H)为正相关,最优模型为S形曲线,施肥后(F-H)两者间无相关(表4, 图2)。Q-FR在不刈割时(NH-F)也为正相关,表现为指数函数,但刈割后(H3-F, H1-F)两者间无相关(表4, 图2)。
群落稳定性与功能多样性(ICV-Q)以及与功能冗余(ICV-FR)间均为正相关,且为指数函数关系(表4)。由于施肥后指数的系数减小(表4),因此施肥降低了ICV随Q或FR的增速(图2)。与不刈割相比,刈割后指数的系数增大(表4),提高了ICV随Q或FR的增速(图2)。
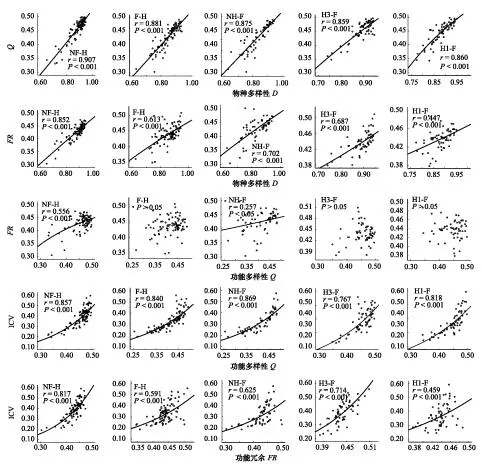
图2 刈割和施肥处理组合梯度上物种多样性(D)、功能多样性(Q)、功能冗余(FQ)与群落稳定性(ICV)之间的最优回归关系Fig.2 Optimal regressive relations between species diversity (D), functional diversity (Q), functional redundancy (FQ), and community stability (ICV) on various combined gradients of different levels of clipping and fertilizing
图2结果还显示,在同一处理组合梯度上,功能多样性与物种多样性的相关性(由相关系数r表示)均大于功能冗余与物种多样性的相关性,功能多样性与群落稳定性的相关性也大于功能冗余与群落稳定性的相关性。
逐步回归分析显示,增加功能多样性和功能冗余都能提高群落稳定性,R2值的大小表明两者能共同解释群落稳定性83.1%—89.0%的变化。但由于回归模型中功能多样性的标准化偏回归系数均大于功能冗余的标准化偏回归系数,因此,功能多样性对群落稳定性的影响大于功能冗余的影响。由于各模型自变量的容忍度值较大,功能多样性和功能冗余之间不存在共线性(表5)。
3讨论和结论3.1功能多样性和功能冗余与群落稳定性
由于物种多样性是产生功能多样性和功能冗余的基础,因此,物种多样性对群落稳定性的正效应是通过功能多样性(互补效应)和功能冗余(保险效应)的增加实现的。大量研究表明,物种多样性对群落稳定性具有正效应[3- 8],并且与功能多样性和功能冗余正相关[12]。本研究中结果(表4, 图2)为此提供了新的证据。本研究同时表明,功能多样性对群落稳定性的影响要大于功能冗余的影响(表5)。因此,尽管功能冗余的保险效应对维持群落稳定性有促进作用[15],但功能多样性的互补效应更大。可能有3个原因导致上述结果:第一,功能多样性和群落稳定性在刈割或施肥处理间保持着同步变化,而功能冗余则保持相对恒定(表2)。同时,功能多样性和功能冗余的平均变异系数分别为9.10%和2.26%(表3),功能多样性比功能冗余具有更高的变异性(表3);第二,功能多样性与物种多样性的相关性强于功能冗余与物种多样性的相关性(图2),即实验处理引起的物种多样性变化导致种间趋异性变化程度大于趋同性变化程度,说明物种间通过更强的功能互补性维持群落稳定性;第三,功能多样性与群落稳定性的相关性也强于功能冗余与群落稳定性的相关性(图2)。而在Pillar等的研究中,上述3个方面正好与本研究相反,因此群落稳定性就仅由功能冗余所决定[16]。综合这些证据,我们认为群落物种功能多样性和功能冗余对扰动发生响应变化的程度确实与其对群落稳定性影响的相对强弱正相关,即功能多样性和功能冗余两者中与物种多样性关系更为密切且变异性较高者对群落稳定性的影响也将越大。因此,在本研究刈割扰动及土壤资源变化的条件下,种间功能性状差异的互补效应才是维持高寒草甸群落稳定性的主要动力。证实了本文假定(2)。
表5不同处理组合梯度上功能多样性(x1)和功能冗余(x2)对群落稳定性(y)影响的逐步回归分析
Table 5Stepwise regressive analysis of the effects of functional diversity (x1) and functional redundancy (x2) on community stability (y) under different treatment combinations with clipping and fertilizing
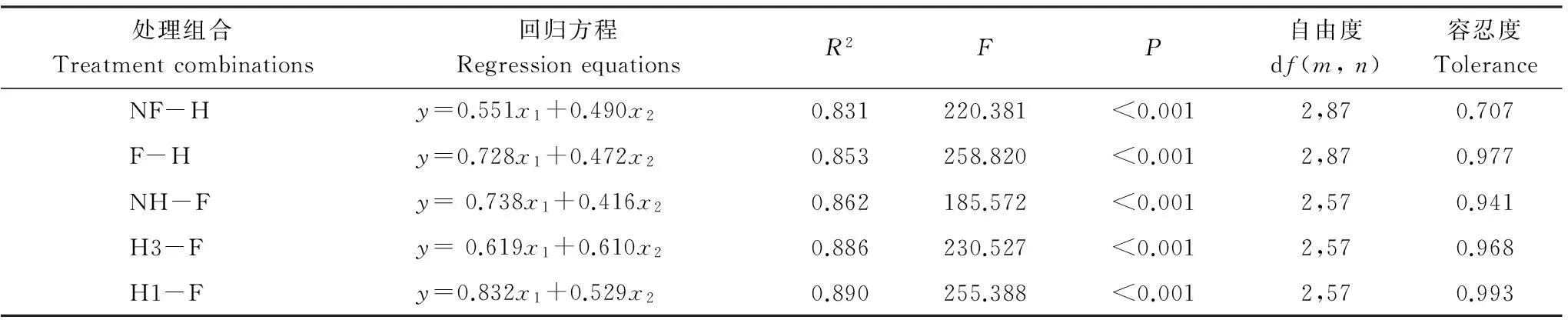
处理组合Treatmentcombinations回归方程RegressionequationsR2FP自由度df(m,n)容忍度ToleranceNF-Hy=0.551x1+0.490x20.831220.381<0.0012,870.707F-Hy=0.728x1+0.472x20.853258.820<0.0012,870.977NH-Fy=0.738x1+0.416x20.862185.572<0.0012,570.941H3-Fy=0.619x1+0.610x20.886230.527<0.0012,570.968H1-Fy=0.832x1+0.529x20.890255.388<0.0012,570.993
功能冗余的低变异性可能是群落本身的内在属性。Petchey等认为[30],一个群落的功能冗余程度由内在冗余(intrinsic redundancy)和外在冗余(extrinsic redundancy)共同决定,内在冗余源于种间的功能相似性,而外在冗余由物种组成的非随机变化引起的植物功能性状的非随机变化产生。例如,植物对长期放牧选择压力的趋同响应形成的抗牧或耐牧性状[53]使群落产生内在冗余,而家畜选择性地采食高适口性物种[9]以及放牧或刈割对竞争优势物种的抑制效应[29]则会增加低适口性和次要物种的相对多度或多样性,引起性状组成的非随机变化,从而产生外在冗余。因此,除非遭受特别强烈的环境变化或扰动影响,特定群落的功能冗余程度应该相对恒定。本研究中,功能冗余不受刈割或施肥的影响(表1)且与功能多样性变化相独立的结果[16]就说明了这点。在此前提下,功能多样性表现出的较高变异性就成为决定该群落稳定性的主要因素。
本研究群落的物种多样性可能尚未饱和,因为功能多样性和功能冗余都随物种多样性而增加(图2),群落稳定性也随功能多样性或功能冗余的增加而增加(图2)。有研究认为物种多样性(以Shannon-Wiener指数H′值表示)一般在1.5至3.5之间,很少超过4.5[54],本实验样地的研究表明[35],功能多样性将在H′ = 3.99至4.28时达到饱和。因此,尽管物种多样性对群落稳定性的正效应是通过功能多样性和功能冗余的增加实现的,但物种多样性下降或物种丧失必将引起群落或生态系统中功能性状丢失、功能性状组成变化、或性状空间维度减小,进而导致功能多样性和功能冗余降低。因此,较高的物种多样性对于维持群落或生态系统的功能稳定性仍是至关重要的。
3.2实验处理效应
刈割和施肥对物种多样性、功能多样性和群落稳定性确实具有相反的影响,刈割为增加效应,施肥为降低效应,且刈割×施肥的交互作用也无显著效应。同时,刈割和施肥对功能冗余都不具有显著影响(表1,表2)。这些结果证实了本文假定(1)。增加效应与以往一些放牧或刈割实验的结果[33- 34,45,51,56]相同,这主要是因为放牧或刈割提供了适于物种定居的小生境[57],以及由此产生的竞争释放效应增加了物种均匀度[58],从而提高了物种多样性。同时,竞争释放也能导致群落植物功能特性多样化,有利于物种以不同方式对有限资源进行最大利用[34,55]。因此,物种多样性提高以及种间功能互补性增加都对群落稳定性具有促进作用。施肥的降低效应也在很多研究中[3,32- 34,59- 61]得到证实。该效应主要是由施肥后快速生长的高大禾本科植物对其它植物的光竞争抑制作用所致[59]。施肥降低物种丰富度的作用还与氮和磷组合的负效应及铵盐肥料引起土壤的酸化效应有关[32]。
Yang等在中国北部温带草原7年的野外实验表明[3],刈割和养分添加分别增加和降低了种群和群落的稳定性,而稳定性与种群、功能群和群落水平的物种丰富度正相关。这与本研究中施肥和刈割分别降低和提高了物种多样性和群落稳定性的结果(表2)一致。本研究进一步说明,出现这种结果与功能多样性或功能冗余对群落稳定性的影响程度(表4, 图2)有直接关系。但如果长期大量施肥使物种多样性降至很低水平,功能多样性或功能冗余对群落稳定性的影响也会随之降低或消失。Yang等的研究[32]显示,高寒草甸在不放牧且连续施肥10年后,群落优势度明显增加,物种丰富度显著下降,群落稳定性与物种多样性效应无关,转而受优势种的种群动态控制。说明在低多样性条件下(如长期施肥后),群落稳定性将不再受控于由物种多样性产生的功能多样性和功能冗余效应。因此,施肥降低群落稳定性是由于施肥对物种多样性的负效应(表2)降低了功能多样性或功能冗余对物种多样性的依赖程度(表4, 图2),进而降低功能多样性或功能冗余对群落稳定性的影响(图2)。此结果的启示是,如果在草地生态系统的管理或退化草地恢复实践中单纯大量增施化肥,虽能获得较高的生产力,但必将引起物种多样性下降或物种丧失,改变群落稳定性的维持机制。由于刈割和施肥对物种多样性和群落功能稳定性具有相反效应,采取适当放牧(或刈割)与施肥相结合的措施,应该能够获得较为平衡的多样性-生产力-生产力稳定性的结果,从而保持生态系统的可持续性。这需要设计更有针对性的实验进行长期研究。
致谢:感谢中国科学院海北高寒草甸生态系统定位研究站的支持,野外取样得到本实验室吕美强、陈超和李艳的帮助,特此致谢。
参考文献(References):
[1]Loreau M, Naeem S, Inchausti P, Bengtsson J, Grime J P, Hector A, Hooper D U, Huston M A, Raffaelli D, Schmid B, Tilman D, Wardle D A. Biodiversity and ecosystem functioning: current knowledge and future challenges. Science, 2001, 294(5543): 804- 808.
[2]Hooper D U, Chapin F S III, Ewel J J, Hector A, Inchausti P, Lavorel S, Lawton J H, Lodge D M, Loreau M, Naeem S, Schmid B, Setälä H, Symstad A J, Vandermeer J, Wardle D A. Effects of biodiversity on ecosystem functioning: a consensus of current knowledge. Ecological Monographs, 2005, 75(1): 3- 35.
[3]Yang H J, Jiang L, Li L H, Li A, Wu M Y, Wan S Q. Diversity-dependent stability under mowing and nutrient addition: evidence from a 7-year grassland experiment. Ecology Letters, 2012, 15(6): 619- 626.
[4]Tilman D. The ecological consequences of changes in biodiversity: a search for general principles. Ecology, 1999, 80(5): 1455- 1474.
[5]Cottingham K L, Brown B L, Lennon J T. Biodiversity may regulate the temporal variability of ecological system. Ecology Letters, 2001, 4(1): 72- 85.
[6]Valone T J, Hoffman C D. A mechanistic examination of diversity-stability relationships in annual plant communities. Oikos, 2003, 103(3): 519- 527.
[7]Tilman D, Reich P B, Knops J M H. Biodiversity and ecosystem stability in a decade-long grassland experiment. Nature, 2006, 441(7093): 629- 632.
[8]Isbell F L, Polley H W, Wilsey B J. Biodiversity, productivity and the temporal stability of productivity: patterns and processes. Ecology Letters, 2009, 12(5): 443- 451.
[9]Diaz S, Cabido M. Vive la difference: plant functional diversity matters to ecosystem processes. Trends in Ecology and Evolution, 2001,16(11): 646- 655.
[10]Diaz S, Lavorel S, De Bello F, Quetier F, Grigulis K, Robson T M. Incorporating plant functional diversity effects in ecosystem service assessments. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(52): 20684- 20689.
[11]Elmqvist T, Folke C, Nyström M, Peterson G, Bengtsson J, Walker B, Norberg J. Response diversity, ecosystem change, and resilience. Frontiers in Ecology and the Environment, 2003, 1(9): 488- 494.
[12]de Bello F, Lepš J, Lavorel S, Moretti M.Importance of species abundance for assessment of trait composition: an example based on pollinator communities. Community Ecology, 2007, 8(2): 163- 170.
[13]Walker B H. Biological diversity and ecological redundancy. Conservation Biology, 1992, 6(1): 18- 23.
[14]Naeem S. Species redundancy and ecosystem reliability. Conservation Biology, 1998, 12(1): 39- 45.
[15]Yachi S, Loreau M. Biodiversity and ecosystem productivity in a fluctuating environment: the insurance hypothesis. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(4): 1463- 1468.
[16]Pillar V D, Blanco C C, Müller S C, Joner F, Duarte L D S, Sosinski E E, Joner F. Functional redundancy and stability in plant communities. Journal of Vegetation Science, 2013, 24(5): 963- 974.
[17]Joner F, Specht G, Müller S C, Pillar V D. Functional redundancy in a clipping experiment on grassland plant communities. Oikos, 2011, 120(9): 1420- 1426.
[18]Valone T J, Barber N A. An empirical evalution of the insurance hypothesis in diversity-stability models. Ecology, 2008, 89(2): 522- 531.
[19]Tilman D. Functional diversity.In: Encyclopedia of biodiversity. 2nd ed. San Diego: Academic Press, 2001: 109- 120.
[20]Hillebrand H, Matthiessen B. Biodiversity in a complex world: consolidation and progress in functional biodiversity research. Ecology Letters, 2009, 12(12): 1405- 1419.
[21]Tilman D, Knops J, Wedin D, Reich P, Ritchie M, Siemann E. The influence of functional diversity and composition on ecosystem processes. Science, 1997, 277(5530): 1300- 1302.
[22]Chapin F S III, Zavelata E S, Eviner V T, Naylor R L, Vitousek P M, Reynolds H L, Hooper D U, Lavorel S, Sala O E, Hobbie S E, Mack M C, Díaz S. Consequences of changing biodiversity. Nature, 2000, 405(6783): 234- 242.
[23]Tilman D. Causes, consequences and ethics of biodiversity. Nature, 2000, 405(6783): 208- 211.
[24]Lepš J, de Bello F, Lavorel S, Berman S. Quantifying and interpreting functional diversity of natural communities: practical considerations matter. Preslia, 2006, 78(4): 481- 501.
[25]Lawton J H, Brown V K. Redundancy in ecosystems // Schulze E D, Mooney H A, eds. Biodiversity and Ecosystem Function. Springer Study Edition Volume 99. Berlin Heidelberg: Springer, 1994: 255- 270.
[26]Rosenfeld J S. Functional redundancy in ecology and conservation. Oikos, 2002, 98(1): 156- 162.
[27]Walker B. Conserving biological diversity through ecosystem resilience. Conservation Biology, 1995, 9(4): 747- 752.
[28]张全国, 张大勇. 生物多样性和生态系统功能: 最新的进展与动向. 生物多样性, 2003, 11(5): 351- 363.
[29]Sasaki T, Okubo S, Okayasu T, Jamsran U, Ohkuro T, Takeuchi K. Management applicability of the intermediate disturbance hypothesis across Mongolian rangeland ecosystems. Ecological Applications, 2009, 19(2): 423- 432.
[30]Petchey O L, Evans K L, Fishburn I S, Gaston K J. Low functional diversity and no redundancy in British avian assemblages. Journal of Animal Ecology, 2007, 76(5): 977- 985.
[31]赵新全. 高寒草甸生态系统与全球变化. 北京: 科学出版社, 2009: 78- 78.
[32]Yang Z L, van Ruijven J, Du G Z. The effects of long-term fertilization on the temporal stability of alpine meadow communities. Plant and Soil, 2011, 345(1- 2): 315- 324.
[33]王海东, 张璐璐, 朱志红. 刈割、施肥对高寒草甸物种多样性与生态系统功能关系的影响及群落稳定性机制. 植物生态学报, 2013, 37(4): 279- 295.
[34]李晓刚, 朱志红, 周晓松, 袁芙蓉, 樊瑞俭, 许曼丽. 刈割、施肥和浇水对高寒草甸物种多样性、功能多样性和初级生产力关系的影响. 植物生态学报, 2011, 35(11): 1136- 1147.
[35]陈超, 姚天华, 潘石玉, 李英年, 朱志红. 高寒草甸种间性状差异和物种均匀度对物种多样性与功能多样性关系的影响. 生态学报, 2016,36(3):661-674
[36]李英年, 王勤学, 古松, 伏玉玲, 杜明远, 赵亮, 赵新全, 于贵瑞. 高寒植被类型及其植物生产力的监测. 地理学报, 2004, 59(1): 40- 48.
[37]王长庭, 龙瑞军, 王启基, 景增春, 丁路明. 高寒草甸不同草地群落物种多样性与生产力关系研究. 生态学杂志, 2005, 24(5): 483- 487.
[38]周兴民, 吴珍兰. 中国科学院海北高寒草甸生态系统定位站植被与植物检索表. 西宁: 青海人民出版社, 2005, 3- 14.
[39]李燕, 朱志红. 高寒草甸对刈割、施肥和浇水发生响应的最优植物性状集和功能型. 植物生态学报, 2013, 37(5): 384- 396.
[40]Pakeman R J. Consistency of plant species and trait responses to grazing along a productivity gradient: a multi-site analysis. Journal of Ecology, 2004, 92(5): 893- 905.
[41]Bady P, Doledec S, Fesl C, Gryrand S, Bacchi M, Scholl F. Use of invertebrate traits for the biomonitoring of European large rivers: the effects of sampling effort on genus richness and functional diversity. Freshwater Biology, 2005, 50(1): 159- 173.
[42]de Bello F, Lepš J, Sebastia M T. Predictive value of plant traits to grazing along a climatic gradient in the Mediterranean. Journal of Applied Ecology, 2005, 42(5): 824- 833.
[43]Diaz S, Lavorel S, Mcintyre S, Falczuk V, Cananoves F, Milchunan D G, Skarpe C, Rusch G, Sternberg M, Noy-meir I, Landsberg J, Zhang W, Clark H, Campbell B D. Plant trait responses to grazing: a global synthesis. Global Change Biology, 2007, 13(2): 313- 341.
[44]Sasaki T, Okubo S, Okayasu T, Jamsran U, Ohkuro T, Takeuchi K. Two-phase functional redundancy in plant communities along a grazing gradient in Mongolian rangelands. Ecology, 2007, 90(9): 2598- 2608.
[45]Zhu Z H, Wang X A, Li Y N, Wang G, Guo H. Predicting plant traits and functional types response to grazing in an alpine shrub meadow on the Qinghai-Tibet Plateau. Science China: Earth Sciences, 2012, 55(5): 837- 851.
[46]马克平. 生物群落多样性的测度方法Ⅰ: α 多样性的测度方法(上). 生物多样性, 1994, 2(3): 162- 168.
[47]Izsák J, Papp L. A link between ecological diversity indices and measures of biodiversity. Ecological Modelling, 2000, 130(1/3): 151- 156.
[48]Botta-Dukát Z. Rao′s quadratic entropy as a measure of functional diversity based on multiple traits. Journal of Vegetation Science, 2005, 16(5): 533- 540.
[49]Ricotta C. A note on functional diversity measures. Basic and Applied Ecology, 2005, 6(5): 479- 486.
[50]Petchey O L, Gaston K J. Functional diversity: back to basics and looking forward. Ecology Letters, 2006, 9(6): 741- 758.
[51]Sasaki T, Lauenroth W K. Dominant species, rather than diversity, regulates temporal stability of plant communities. Oecologia, 2011, 166(3): 761- 768.
[52]Lehman C L, Tilman D. Biodiversity, stability and productivity in competitive communities. The American Naturalist, 2000, 156(5): 534- 552.
[53]Cingolani A M, Noy-Meir I, Diaz S. Grazing effects on rangeland diversity: a synthesis of contemporary models. Ecological Applications, 2005, 15(2): 757- 773.
[54]Magurran A E. Ecological Diversity and Its Measurement. Princeton: Princeton University Press, 1988.
[55]Hooper D U. The role of complementarity and competition in ecosystem responses to variation in plant diversity. Ecology, 1998, 79(2): 704- 719.
[56]de Bello F, Lepš J, Sebastia M T. Variations in species and functional plant diversity along climatic and grazing gradients. Ecography, 2006, 29(6): 801- 810.
[57]王长庭, 龙瑞军, 王启兰, 曹广民, 施建军, 杜岩功. 放牧扰动下高寒草甸植物多样性、生产力对土壤养分条件变化的响应. 生态学报, 2008, 28(9): 4144 - 4152.
[58]Bakker E S, Olff H. Impact of different-sized herbivores on recruitment opportunities for subordinate herbs in grasslands. Journal of Vegetation Science, 2003, 14(4): 465- 474.
[59]Tilman D. Secondary succession and the pattern of plant dominance along experimental nitrogen gradients. Ecological Monographs, 1987, 57(3): 189- 214.
[60]Lepš J. Variability in population and community biomass in a grassland community affected by environmental productivity and diversity. Oikos, 2004, 107(1): 64- 71.
[61]Grman E, Lau J A, Schoolmaster D R Jr, Gross K L. Mechanisms contributing to stability in ecosystem function depend on the environmental context. Ecology Letters, 2010, 13(11): 1400- 1410.
Effects offunctional diversity and functional redundancy on the community stability of an alpine meadow
YAO Tianhua1, ZHU Zhihong1,*, LI Yingnian2, PAN Shiyu1, KONG Binbin1, WEI Xinhua1, DU Jiali1
1CollegeofLifeSciences,ShaanxiNormalUniversity,Xi′an710062,China2NorthwestInstituteofPlateauBiology,ChineseAcademyofSciences,Xining810008,China
Abstract:Functional diversity and functional redundancy are crucial to maintaining the stability of a community, but the strength and relative importance of these effects remains poorly understood. In this study, a field manipulation experiment was conducted in an alpine Kobresia humilis meadow at the Haibei Research Station of the Chinese Academy of Sciences from 2007 to 2012, with the aim of gaining insight into the relationship between community stability, functional diversity, and functional redundancy. The experiment used a split-plot design with three clipping levels (stubbled 1 cm, 3 cm, and unclipped) used on the whole plot, and subplots were treated with or without fertilizer (12.75 g m-2a-1urea + 3.06 g m-2a-1ammonium phosphate or unfertilized). Our results showed that the community stability monotonously increased with increasing functional diversity and functional redundancy; however, the effect of functional diversity on stability was greater than that of functional redundancy, given that the coefficient of variation of functional diversity under different treatment combinations was greater than that of functional redundancy. Furthermore, the degree of positive correlation between functional diversity and species diversity was stronger than that between functional redundancy and species diversity. We also found a closer positive relationship between functional diversity and community stability than that between functional redundancy and community stability. Although the insurance effect from functional redundancy may improve the stability of a community, the complementary effect of functional diversity on stability appears to be much greater. As such, this result suggests that the relative strength of the effects of functional diversity and functional redundancy on community stability is positively correlated with the degree of variation in functional diversity and redundancy, which confirmed our speculations. Meanwhile, functional diversity is more tightly related to the community stability and can be a better predictor of ecosystem stability than species diversity or functional redundancy. Our study provides a critical insight into sustainable management of rangeland ecosystems.
Key Words:alpine meadow; functional diversity; functional redundancy; community stability
DOI:10.5846/stxb201408301725
*通讯作者
Corresponding author.E-mail: zhuzhihong@snnu.edu.cn
收稿日期:2014- 08- 30; 网络出版日期:2015- 07- 29
基金项目:国家自然科学基金项目(31070382)
姚天华, 朱志红, 李英年, 潘石玉, 孔彬彬, 卫欣华, 杜家丽.功能多样性和功能冗余对高寒草甸群落稳定性的影响.生态学报,2016,36(6):1547- 1558.
Yao T H, Zhu Z H, Li Y N, Pan S Y, Kong B B, Wei X H, Du J L.Effects offunctional diversity and functional redundancy on the community stability of an alpine meadow.Acta Ecologica Sinica,2016,36(6):1547- 1558.
