耐有机溶剂α-葡萄糖苷酶的补料分批发酵研究
2016-05-23唐群芳李江华堵国成江南大学工业生物技术教育部重点实验室江苏无锡214122江南大学生物工程学院江苏无锡214122
唐群芳, 李江华, 刘 龙*, 堵国成, 陈 坚(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
耐有机溶剂α-葡萄糖苷酶的补料分批发酵研究
唐群芳1,2,李江华1,2,刘龙*1,2,堵国成1,2,陈坚1,2
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏无锡214122)
摘要:作者研究了Bacillus licheniformis JXC-1在3 L发酵罐上产耐有机溶剂α-葡萄糖苷酶的关键因素,结果表明:pH恒定7.0,初始糖质量浓度25 g/L,搅拌转速600 r/min为最适产酶条件,酶活由104.6 U/L提高到了444.7 U/L。通过4种补料策略对其进行补料分批发酵研究,得出:4~5 h内补料速度为2.25 mL/h,5~6 h内补料速度为6.75 mL/h,6~7 h内补料速度为9 mL/h,7~8 h内补料速度为15 mL/h补加麦芽糖与蛋白胨效果最好,酶活达到872.5 U/L。
关键词:地衣芽孢杆菌JXC-1;α-葡萄糖苷酶;补料分批发酵;耐有机溶剂酶
α-葡萄糖苷酶(α-glucosidaseE.C.3.2.1.20),又名葡萄糖基转移酶,简称α-糖苷酶。可从α-葡萄糖苷、寡糖和葡聚糖等低聚糖类底物[1]的非还原性末端断开α-(1,4)糖苷键,并能将游离出来的葡萄糖残基转移到另一个葡萄糖分子或麦芽糖或麦芽三糖等分子中的α-(1,6)位上[2-3],从而得到非发酵性的低聚异麦芽糖(isomaltooligosaccharides,以下简称IMO,主要包括异麦芽糖、异麦芽三糖和潘糖等)、糖脂或糖肽等[4-7]。该酶既具有水解能力又具有转移能力,故对其命名说法不一。
α-葡萄糖苷酶在人类的糖原降解及动物植物和微生物的糖类代谢方面具有重要的生理功能,它作为工业化生产IMO的关键酶制剂受到国内外食品工业界的重视[8-9]。而在有机介质中的酶催化反应中[10-11],利用耐有机溶剂α-葡萄糖苷酶催化反应不仅可以增加非极性底物的溶解性,更可通过控制反应平衡移动的方向极大地提高产率,通过溶剂体系调节有效成分使定向的转化或修饰成为可能[12-14]。
针对筛选到的耐有机溶剂野生菌株Bacillus licheniformis JXC-1生产α-葡萄糖苷酶产量不高的状况,作者首先在3 L发酵罐上优化了控制产酶的关键因素(pH,初糖浓度和搅拌转速)在此基础上,通过对碳源和有机氮源的补料流加方式的优化,以期进一步提高Bacillus licheniformis JXC-1生产α-葡萄糖苷酶的发酵水平。
1 材料与方法
1.1材料与仪器
菌株:Bacillus licheniformis JXC-1,生物系统与生物加工工程实验室选育并保藏,中国典型培养物保藏中心保藏号是CCTCC NO:M 2011320;仪器:3 L全自动发酵罐;超声波细胞破碎仪;KYC100B培养摇床;其余试剂均为分析纯。
1.2培养基
1.2.1平板培养基胰蛋白胨10 g/L,酵母粉5 g/ L,NaCl 10 g/L,琼脂20 g/L,pH 7.0。
1.2.2种子液培养基胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,pH 7.0。
1.2.3分批发酵培养基麦芽糖30 g/L,胰蛋白胨39 g/L,酵母粉3 g/L,CaCl20.4 g/L,FeSO4·7H2O 0.164 g/L,NaCl 0.076 g/L,pH自然。
1.2.4补料生长培养基碳源流加:麦芽糖500 g/ L;碳氮源混合流加:麦芽糖500 g/L,胰蛋白胨780 g/L。
1.3培养方法
1.3.1摇瓶培养将-80℃保存的菌株采用平板划线法活化后,挑取单菌落,接于装有30 mL液体LB培养基的250 mL三角瓶中,37℃、200 r/min培养12 h。
1.3.2发酵罐培养将液体LB培养基中菌液按体积分数3%接种量接入3 L全自动发酵罐(LiFlus GM BioTRON,Korea)中。装液量1.5 L,以体积分数25%氨水和盐酸溶液控制pH值(恒定6.0,7.0,8.0和不控制),温度37℃,搅拌转速(500,600,700,800 r/min),发酵到一定时间按要求方式补加一定量的碳源和有机氮源。发酵过程由发酵罐控制系统软件进行在线控制和数据采集。
1.4分析测定
1.4.1菌体干重的测定取10 mL发酵液置于离心管中,8 000 r/min离心10 min,弃上清液,将离心菌体置于105℃,烘至恒重,称量并计算菌体干重(g/L)。
1.4.2α-葡萄糖苷酶活性的测定参见文献[15]。酶活力单位定义:在pH 6.8,37℃的条件下,每分钟催化水解产生1 μmol对硝基苯酚所需要的酶量为一个酶活力单位。
1.4.3残糖浓度的测定参见文献[16]。采用DNS法测量还原糖。取稀释后的糖液1.0 mL于15 mL刻度试管中,加DNS试剂2.0 mL,沸水煮沸15 min,冷却后用水补足到15 mL刻度,在540 nm波长下测定吸光度。从标准曲线查出葡萄糖mg/mL数,求出样品中糖含量。
1.4.4比速率的测定
α-葡萄糖苷酶生产强度=(胞内酶活/发酵时间)
单位菌体胞内产酶量=(胞内酶活/菌体干重)
2 结果与讨论
2.1 pH控制策略对α-葡萄糖苷酶分批发酵过程的影响
在前期摇瓶发酵优化中,发现培养基的初始pH是控制产酶的关键因素。在3 L发酵罐中,考察不同pH控制策略下菌体生长及产酶的情况,结果如图1所示。pH不控制时,2~10 h为对数期,大量产酶,最高酶活为104.6 U/L,DCW在10 h时达到最高19.6 g/L。而pH控制恒定6.0及8.0时,细胞都能良好生长,酶活和DCW均有所上升,而pH控制为恒定7.0对发酵最为有利,此时,最高酶活达到332.6 U/L(12 h),最大DCW达到33.2 g/L。因此,选择pH控制策略为恒定7.0。
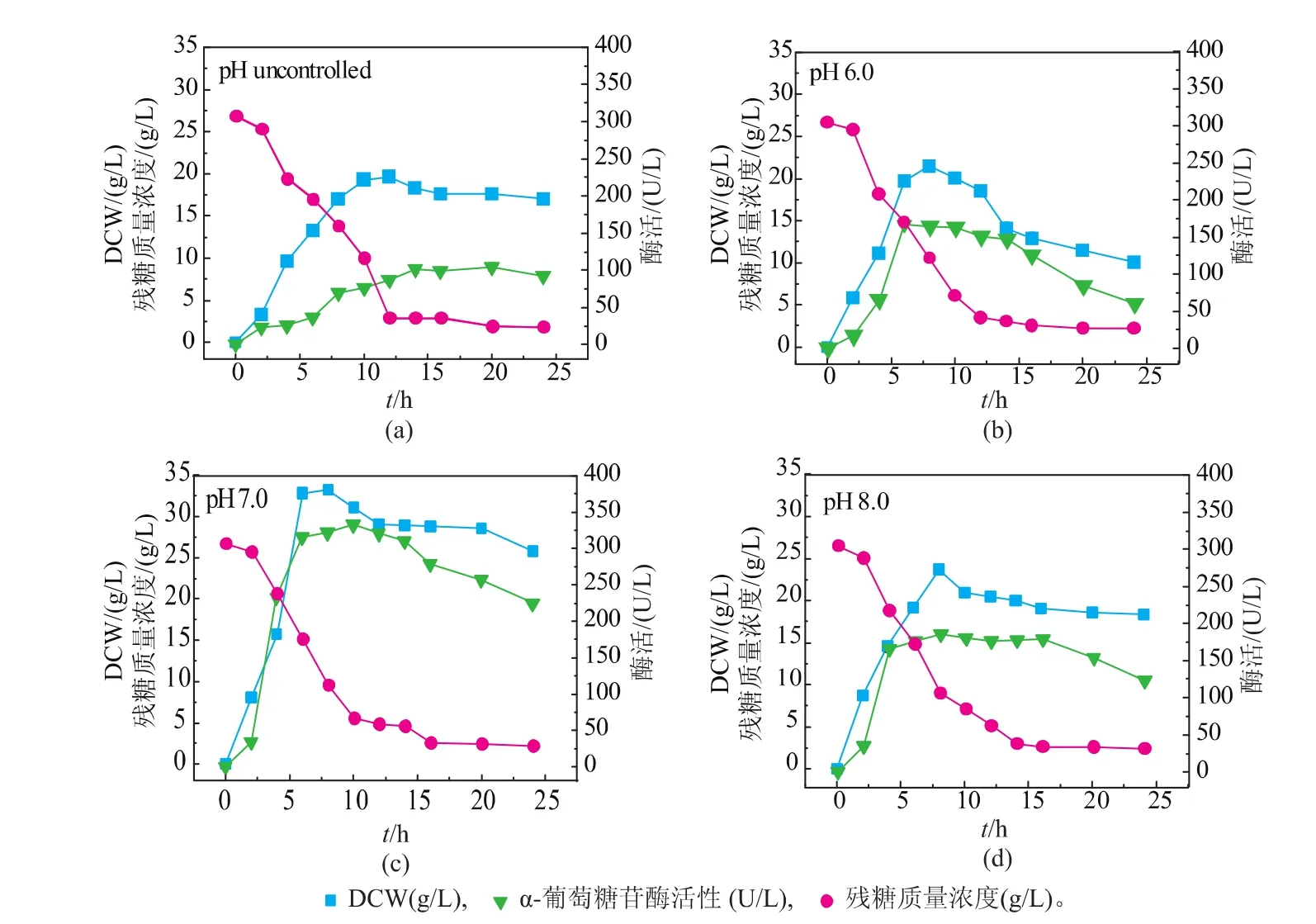
图1 pH对α-葡萄糖苷酶分批发酵过程的影响Fig. 1 Influence of pH on the production of α-glucosidase in batch culture.
2.2初始麦芽糖质量浓度对α-葡萄糖苷酶分批发酵过程的影响
在发酵过程中,菌体的生长受到底物质量浓度的影响。当培养基中的糖质量浓度增加到一定量时,生长就显示饱和型动力学[17],若进一步增加糖质量浓度,由于发酵液渗透压过大,就对菌体的生长产生抑制,菌体比增长速率减小,菌浓度下降,影响菌体生长[18]。
考察了不同初始糖质量浓度(20、25、30和35 g/L)下的菌体生长和产酶情况,结果如图2所示。可以发现,较高的初糖质量浓度(30 g/L)较利于菌体的生长,最大DCW达到33.2 g/L,较低的初糖质量浓度(25 g/L)较利于产酶,最高酶活达到444.7 U/L。因此,选择初糖质量浓度为25 g/L。

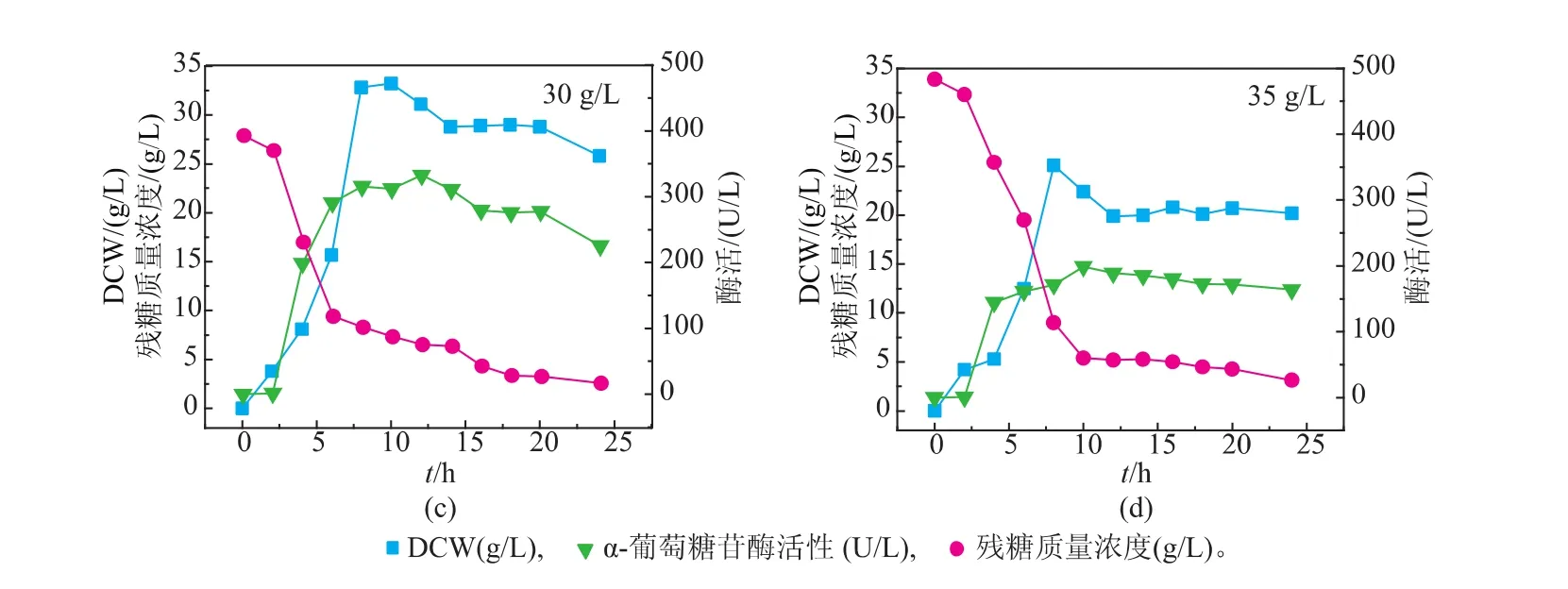
图2 初始麦芽糖质量浓度对α-葡萄糖苷酶分批发酵过程的影响Fig. 2 Influence of initial maltose concentration on the production of α-glucosidase in batch culture
2.3搅拌转速对α-葡萄糖苷酶分批发酵过程的影响
溶解氧是影响微生物生长发酵的重要因素之一,它在细胞生长、产物形成和维持细胞的代谢中起着重要的作用[19]。
控制不同的搅拌转速(500、600、700和800 r/ min)考察其溶氧情况,发现其在前期和中期需要大量溶解氧,对数期DO维持在20%以内。从图3可以看出,溶氧供给的不足会给菌体生长带来负面影响,500 r/min时最大菌体干重比800 r/min时低44.6%。而菌株生长过快并不代表产酶能力的提高,600 r/min时最高酶活比800 r/min时高33.7%,且单位细胞产酶量比800 r/min时高(见表1)。因此,选择搅拌转速600 r/min为初糖质量浓度25 g/L时的最佳搅拌转速。
2.4变速补加碳源对α-葡萄糖苷酶补料-分批发酵过程的影响
根据发酵过程中的残糖质量浓度,2~8 h内糖消耗速率较快,至10 h时残糖质量浓度已经将至1 g/L,而残糖浓度维持在18 g/L时产酶速率最大,故而提出以下几种补料策略:

图3 搅拌转速对α-葡萄糖苷酶分批发酵过程的影响Fig. 3 Influence of agitation speed on the production of α-glucosidase in batch culture
4~8 h内,补料速度恒定为8.25 mL/h;4~6 h内,补料速度为4.5 mL/h:6~8 h内,补料速度为12 mL/h;4~6 h内,补料速度为4.5 mL/h;6~7 h内,补料速度为9 mL/h;7~8 h内,补料速度为15 mL/h;4~5 h内,补料速度为2.25 mL/h;5~6 h内补料速度为6.75 mL/h;6~7 h内,补料速度为9 mL/h;7~8 h内,补料速度为15 mL/h。
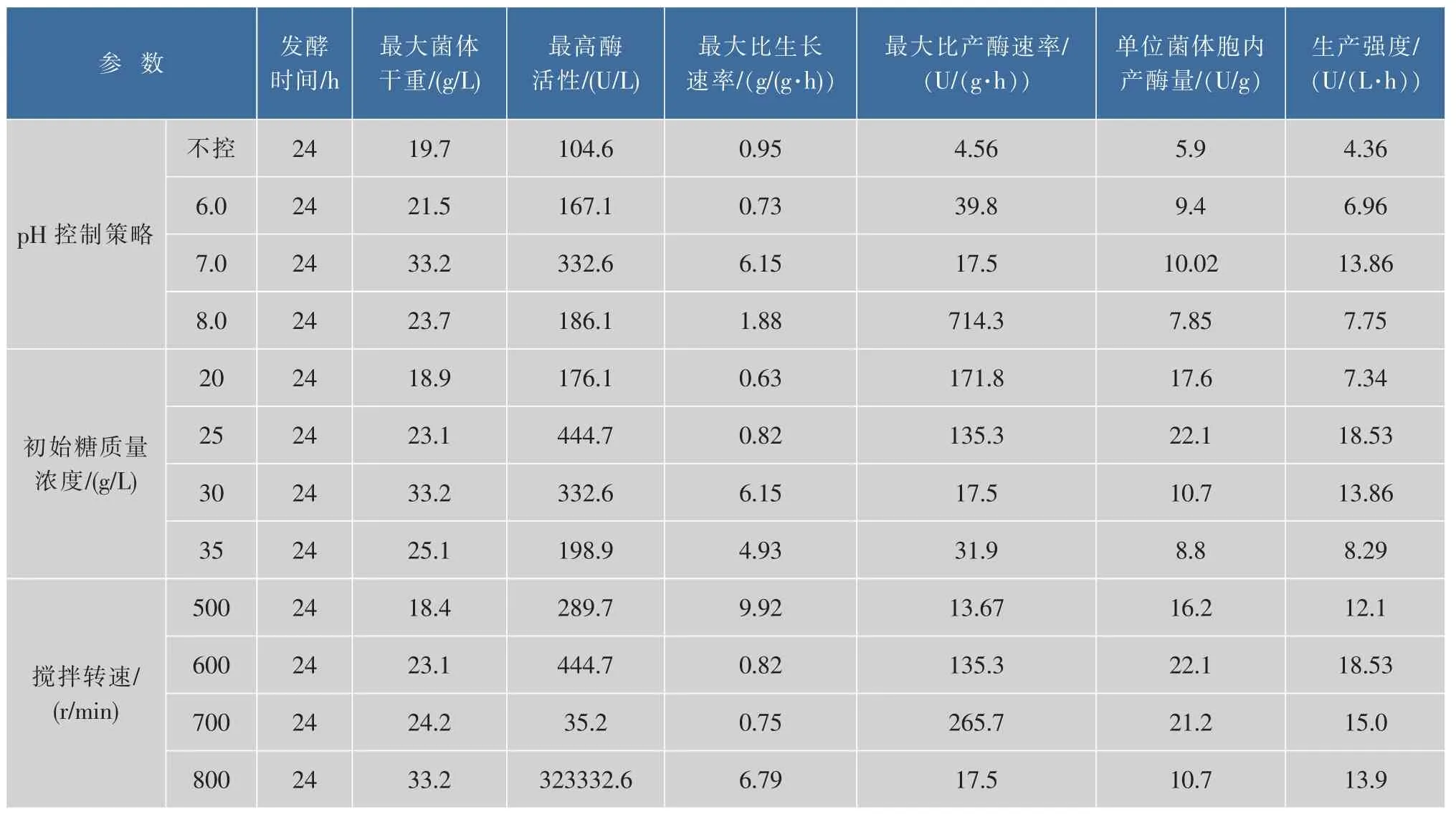
表1 不同3 L发酵罐控制条件对Bacillus licheniformis JXC-1生产α-葡萄糖苷酶的发酵参数比较Table 1 Comparison of fermentation parameters with different control conditions for the production of α-glucosidase from Bacillus licheniformis JXC-1 in batch culture
在补料-分批发酵过程中,碳源的流加方式对发酵有着重要影响。因为碳源匮乏时容易导致细胞没有营养物质可吸收而不能生长、繁殖或合成代谢产物,甚至导致细胞死亡;而碳源浓度过高时,由于底物限制和过量代谢会导致副产物的分泌[20]。因此,选择合适补料方式对实现高产量、高产率和高生产强度发酵生产α-葡萄糖苷酶至关重要。
在上述3 L发酵罐产酶关键因素优化的基础上,采取4种补料策略在4~8 h内进行变速补加麦芽糖,菌体在2-4 h内大量产酶,在4 h后添加碳源麦芽糖使稳定期时间延长,至24 h后进入衰亡期。补加碳源使得酶活和菌体干重都有所上升,菌体生长趋势大致相同,采用策略D可得到最高酶活为633.8 U/L,生产强度及单位菌体胞内产酶量在4种策略里为最高。而采用策略C可得到最大菌体干重45.6 g/L,可能是补加策略C相应质量浓度的麦芽糖利于菌体生长,使得产酶并没有相应幅度地提高。
2.5变速补加碳源和有机氮源对α-葡萄糖苷酶补料-分批发酵过程的影响
在前期的研究中发现,α-葡萄糖苷酶的合成伴随着菌体的生长。为了维持菌体最大生长速率,不仅要提供充足合适的碳源,其余菌体可利用的成分需要得到相应的补充,来源于有机氮源的核苷酸、微量元素等对菌体生长很有必要[21]。
基于此,考察了采用上述4种策略同时补加碳源麦芽糖和氮源蛋白胨时菌株的生长和产酶情况,采用策略D补加可得到最高酶活为872.5 U/L,比未补加氮源前提高了37.7%,说明同时补加碳源和氮源是有效果的,而相较于仅流加碳源,采用策略A时流加碳氮源的效果比策略B和C都有效,可能是由于补加氮源使得菌体生长速度在补料前期得到了提高从而相应增加了对碳氮源的需求.但由表2可知,策略D的生产强度和单位菌体胞内产酶量都优于策略A,故而,采用策略D补加碳源和有机氮源的效果最佳。
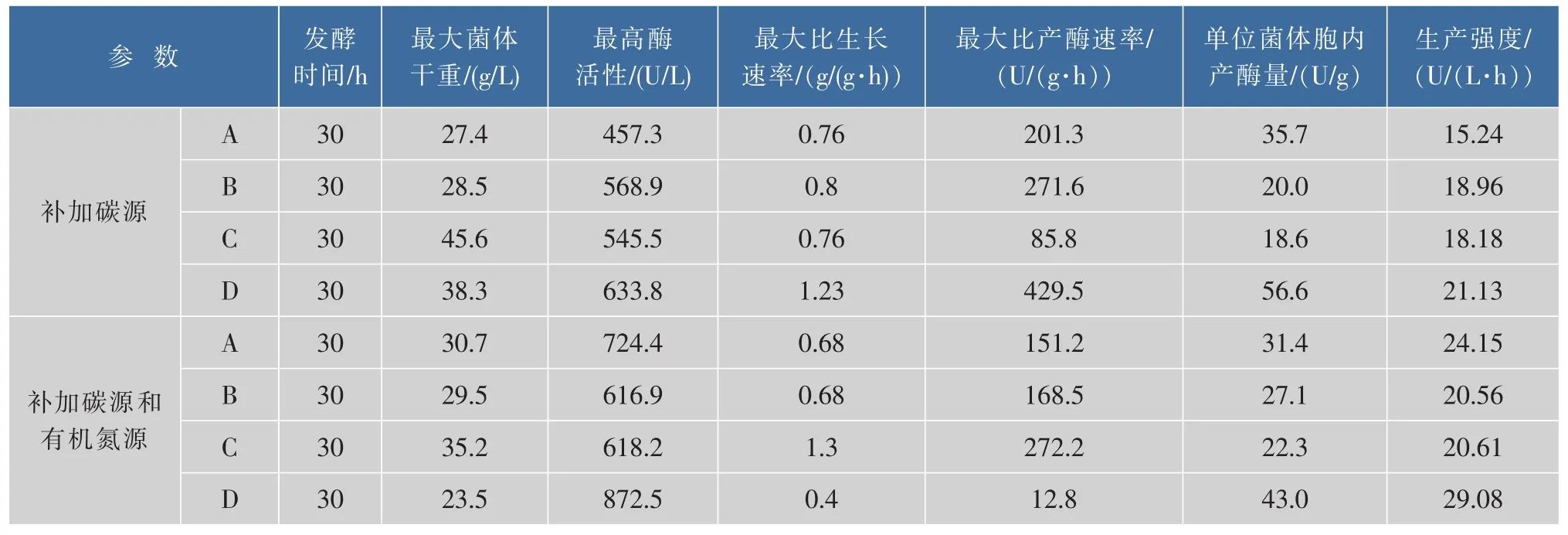
表2 不同碳源和氮源流加方式下Bacillus licheniformis JXC-1生产α-葡萄糖苷酶的发酵参数比较Table 2 Comparison of fermentation parameters with different carbon and organic nitrogen sources feeding approaches for the production of α-glucosidase from Bacillus licheniformis JXC-1 in fed-batch cultures
3 结语
在对产耐有机溶剂α-葡萄糖苷酶地衣芽孢杆菌JXC-1摇瓶发酵条件初步优化的基础上,于3 L发酵罐上研究了其产酶的关键因素,结果表明:pH恒定7.0,初始糖浓度25 g/L,搅拌转速600 r/min为最适产酶条件,酶活由104.6 U/L提高到了444.7 U/ L,提高了3.25倍。通过4种补料策略对其进行补料分批发酵研究,分别补加碳源麦芽糖及碳氮源麦芽糖与蛋白胨,得出:在4~5 h内补料速度为2.25 mL/ h,5~6 h内补料速度为6.75 mL/h,6~7 h内补料速度为9 mL/h,7~8 h内补料速度为15 mL/h补加麦芽糖与蛋白胨效果最好,此时酶活达到872.5 U/L,比未补料之前提高了96.2%,由此可见,采用该种补料策略补加碳源和有机氮源是提升Bacillus licheniformis JXC-1生产α-葡萄糖苷酶的有效途径之一。
参考文献:
[1]Carvalho A F A,Martin N,Da Silva R,et al. Properties of the purified glycosylated alpha-glucosidase produced by thermophilic fungus Thermoascus aurantiacus CBMAI 756 in submerged fermentation[J]. New Biotechnology,2009(1),25:S48
[2]Arzu Coleri Cihan,Birgul Ozcan,Cumhur Cokmus. Characterization of thermostable α-glucosidases from newly isolated Geobacillus sp. A333 and thermophilic bacterium A343[J]. World Journal of Microbiology and Biotechnology,2009,25 (12):2205-2217.
[3]Shimba N,Shinagawa M,Hoshino W,et al. Monitoring the hydrolysis and transglycosylation activity of alpha-glucosidase from Aspergillus niger by nuclear magnetic resonance spectroscopy and mass spectrometry[J]. Analytical Biochemistry,2009,393 (1):23-28.
[4]严晓娟,陈朋,梁宁,等.α-葡萄糖苷酶的制备工艺研究进展[J].中国酿造,2013(9):13-16. YAN Xiaojuan,CHEN Peng,LIANG Ning,et al. Advancement in preparation technology of α-glucosidase[J]. China Brewing,2013,32(9):13-16.(in Chinese)
[5]胡先望,杨震,陈朋,等.α-葡萄糖苷酶的研究进展[J].甘肃科学学报,2011(1):143-148. HU Xianwang,YANG Zhen,CHEN Peng,et al. Progress in Research on α-Glucosidases[J]. Journal of Gansu Science,2011,23(1):143-148.(in Chinese)
[6]岳振峰,陈小霞,彭志英.α-葡萄糖苷酶研究现状及进展[J].食品与发酵工业,2000(3):63-74. YUE Zhenfeng,CHEN Xiaoxia,PENG Zhiying. Status quo and advance of research on α-Glucosidase[J]. Food and Fermentation Industries,2000,26(3):63-74.(in Chinese)
[7]杨震,胡先望,陈朋,等.α-葡萄糖苷酶应用开发现状[J].甘肃科学学报,2011(2):54-57. YANG Zhen,HU Xianwang,CHEN Peng,et al. Present Application and development of α-Glucosidases[J]. Journal of GansuScience,2011,23(2):54-57..(in Chinese)
[8]童星.重组α-葡萄糖苷酶转化废弃薯渣生产低聚异麦芽糖的研究[D].江南大学,2009.
[9]王月宏.嗜热厌氧乙醇杆菌Thermoanaerobacter ethanolicus JW200 α-葡萄糖苷酶的研究[D].江南大学,2012.
[10]周晨,吴薛明,何冰芳.非水相糖苷酶高效催化的研究进展[J].化工进展,2010(7):1292-1299. ZHOU Chen,WU Xueming,HE Bingfang. Development of glyeosidase biocatalysis in non-aqueous phase[J]. Chemical Industry and Engineering Progress,2010,29(7):1292-1299.(in Chinese)
[11]吴薛明,何冰芳.耐有机溶剂极端微生物及酶类与天然产物的生物转化[J].中国天然药物,2007(4):245-250. WU Xueming,HE Bingfang. Organic-solvent-tolerant extremophiles and enzymes applied in biotransformation of natural products[J]. Chinese Journal of Natural Medicines,2007,5(4):245-250..(in Chinese)
[12]吴薛明,许婷婷,储建林,等.黄酮类化合物酶法糖基化修饰的研究进展[J].中国天然药物,2010(5):389-400. WU Xueming,XU Tingting,CHU Jianlin,HE Bingfang. Progress on enzymatic glycosylation of flavonoids[J]. Chinese Journal of Natural Medicines,2010,8(5):389-400.(in Chinese)
[13]江欢,舒正玉,吴继光,等.耐有机溶剂极端微生物的耐受机制及应用[J].微生物学通报,2009(11):1744-1749. JIANG Huan SHU Zhengyu,WU Jiguang,et al. Mechanisms for solvent tolerance and application of extremophile with organic solvent tolerance[J]. Microbiology,2009,36(11):1744-1749.(in Chinese)
[14]唐啸宇,孙洪林,何冰芳.耐有机溶剂微生物及酶类在生物催化中的应用[J].化学进展,2009(12):2726-2733. TANG Xiaoyu,SUN Honglin,HE Bingfang. Organic solvent tolerant bacteria and enzymes for application in biocatalysis[J]. Progress in Chemistry,21(12):2726-2733.(in Chinese)
[15]谢振荣,慕跃林,闫丽娟,等.α-葡萄糖苷酶高产菌株HB-9-5的选育及产酶条件的优化[J].生物技术通报,2010(6):206-211. XIE Zhenrong,MU Yuelin,YAN Lijuan,et al. Study on screening and fermentation conditions of high α-glucosidase-producing strain HB-9-5[J]. Biotechnology Bulletin,2010(6):206-211.(in Chinese)
[16]张永勤,王哲平,宋雨梅,等.还原糖测定方法的比较研究[J].食品工业科技,2010(6):321-323+326. ZHANG Yongqin,WANG Zheping,SONG Yumei,et al. Comparative study on the determination of reducing sugar[J]. Science and Technology of Food Industry,2010,31(6):321-323+326.(in Chinese)
[17]马占龙.谷氨酸发酵过程的控制[J].发酵科技通讯,2006(3):1-2. MA Zhanlong. Process control of glutamic acid fermenation[J]. Fajiao Keji Tongxun,2006(3):1-2.(in Chinese)
[18]卢宗梅,康传利,张伟国. L-谷氨酸补料分批发酵的研究[J].生物加工过程,2011(5):27-31. LU Zongmei,KANG Chuanli,ZHANG Weiguo. Study on fed-batch fermentation conditons of L-glutamic acid[J]. Chinese Journal of Bioprocess Engineering,2011,9(5):27-31.(in Chinese)
[19]彭志坚,房峻,李江华,等.发酵法生产L-异亮氨酸的溶氧控制策略[J].工业微生物,2009,39(3):11-16. PENG Zhijian,FANG Jun,LI Jianghua,et al. Microbial production of L-isoleucine by dissolved oxygen control strategy[J]. Industrial Microbiology,2009,39(3):11-16.(in Chinese)
[20]周海岩. L-苯丙氨酸生产菌株的构建、代谢调控和发酵条件优化[D].无锡:江南大学,2011.
[21]陈旭升,董难,毛忠贵.碳源和氮源流加方式对ε-聚赖氨酸补料-分批发酵过程的影响[J].食品与发酵工业,2013(8):47-52. CHEN Xusheng,DONG Nan,MAO Zhonggui. Enhancement of ε-poly-L-lysine production through optimization of carbon and nitrogen sources feeding approach[J]. Food and Fermentation Industries,2013,39(8):47-52.(in Chinese)
Enhanced Production of Solvent-Stable Alpha Glycosidase from Bacillus licheniformis JXC-1 by an Optimal Feeding Strategy
TANG Qunfang1,2,LI Jianghua1,2,LIU Long*1,2,DU Guocheng1,2,CHEN Jian1,2
(1. Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2. School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Abstract:In previous work,we screened a strain(Bacillus licheniformis JXC-1)producing solvent-stable(10% N,N-Dimethylformamide,short for DMF)α-glucosidase from several different soil samples. In this work,we attempted to determine the key factors for the production of α-glucosidase and optimize the feeding strategy in a 3-L fermenter. Results showed that the enzyme activity reached 444.7 U/L with the optimal condition(pH 7.0,the initial maltose concentration 25 g/L,and agitation speed 600 rpm). The strategy of feeding maltose and tryptone at a rate of 2.25 mL/h(4-5 h),6.75 mL/h(5-6 h),9 mL/h(6-7 h)and 15 mL/h(7-8 h)significantly increased the production of α-glycosidase from 444.7 U/L to 872.5 U/L.
Keywords:Bacillus licheniformis JXC-1,alpha glycosidase,fed-batch fermentation,solvent-stable enzymes
*通信作者:刘龙(1980—),男,山东渚城人,工学博士,教授,博士研究生导师,主要从事发酵过程优化与控制研究。E-mail:longliu@jiangnan.edu.cn
基金项目:国家自然科学基金项目(21006040);国家973计划项目(2012CB720802,2012CB720806);江苏高校优势学科建设工程资助项目。
收稿日期:2014-09-18
中图分类号:Q 814
文献标志码:A
文章编号:1673—1689(2016)01—0012—07
