补肾生髓方和益气活血方对局灶性脑缺血再灌注大鼠额顶叶皮质Notch信号通路Nurr1、SMO mRNA及其蛋白表达的影响
2016-05-23宋祖荣胡建鹏
宋祖荣,徐 伟,王 键,胡建鹏
(1.安徽新华学院药学院,安徽 合肥 230088;2.安徽中医药大学新安医学教育部重点实验室,安徽 合肥 230038)
·实验研究·
补肾生髓方和益气活血方对局灶性脑缺血再灌注大鼠额顶叶皮质Notch信号通路Nurr1、SMO mRNA及其蛋白表达的影响
宋祖荣1,徐伟2,王键2,胡建鹏2
(1.安徽新华学院药学院,安徽 合肥230088;2.安徽中医药大学新安医学教育部重点实验室,安徽 合肥230038)
[摘要]目的 探讨补肾生髓方和益气活血方对脑缺血再灌注大鼠额顶叶皮质Notch信号转导通路Nurr1、SMO mRNA及其蛋白表达的影响。方法采用线栓法复制右侧大脑中动脉阻塞局灶性脑缺血再灌注大鼠模型,将大鼠随机分为假手术组、模型组、补肾生髓方组和益气活血方组。脑缺血2 h后,持续灌注7 d。采用PCR检测额顶叶皮质Nurr1、SMO mRNA表达水平,采用Western blot检测其蛋白表达水平。结果与假手术组比较,模型组Nurr1、SMO mRNA及其蛋白表达水平均明显上调(P<0.05);益气活血方组和补肾生髓方组Nurr1 mRNA及其蛋白、SMO蛋白相对表达水平均较模型组明显下调(P<0.05);模型组、益气活血方组和补肾生髓方组SMO mRNA相对表达水平比较,差异无统计学意义(P>0.05);益气活血方组与补肾生髓方组Nurr1、SMO蛋白表达水平有显著差异(P<0.05)。结论补肾生髓方和益气活血方促进脑组织修复的作用与其下调Notch信号转导通路中Nurr1、SMO mRNA及其蛋白表达有关。
[关键词]脑缺血再灌注;益气活血方;补肾生髓方;Notch信号转导通路
神经干细胞(neural stem cells,NSCs)在一定条件下可增殖分化成神经细胞和胶质细胞[1],参与神经功能的修复过程,对于其在缺血性脑卒中中的修复作用已引起普遍的重视[2]。大量实验证明,通过激活Notch信号通路能够抑制脊椎动物体内神经发生,保持NSCs特性[3]。以往研究证实,补肾生髓方和益气活血方能通过调节Notch信号通路,促进局灶性脑缺血再灌注损伤的脑组织修复[4]。本实验采用大鼠右侧大脑中动脉线栓法复制动物模型,观察两种中药复方对模型大鼠缺血侧额顶叶皮质中Nurr1和SMO基因及其蛋白表达的影响,探讨其作用机制。
1材料
1.1实验动物雄性健康SD大鼠40只,体质量280~320 g,月龄4个月,由安徽省定远县永康青源养殖场提供,生产许可证号为SCXK(皖)2011-002,被随机分为假手术组、模型组、补肾生髓方组、益气活血方组,每组10只。
1.2药物与试剂益气活血方(脑络欣通):川芎、三七各10 g,红花6 g,黄芪30 g,等。补肾生髓方:金毛狗脊、杜仲、鹿角胶、龟板胶等各10 g。两方均由安徽中医药大学第一附属医院中药制剂室制备,分别相当于原生药的1.0、2.4 g/mL,益气活血方和补肾生髓方分别按8.54、10.25 g/kg的中等剂量每天灌胃使用。Nurr1、SMO单克隆抗体均购自美国Stan Cruz公司;山羊抗小鼠IgG、山羊抗兔IgG和β-actin均购置于北京中杉金桥生物技术有限公司;Notch通路PCR芯片购自美国SABiosciences公司;丙烯酰胺、过硫酸氨、Tris碱、TEMED均购自美国sigma公司;RIPA细胞裂解液、BCA蛋白质定量试剂盒均购自碧云天生物技术研究所;电化学发光试剂盒购自美国pierce公司;Trizol试剂购自Invitrogen公司;无RNA酶的糖原购自Ambion公司;RNeasy®MinEluteTM纯化试剂盒购自Qiagen公司;EDTA、MOPS购自华美生物工程公司;RNase Inhibitor购自Epicentre公司。
1.3仪器ND-1000型微量紫外可见分光光度计由美国Thermo公司提供;自动制冰机(AF-10型)由意大利SCOTSMAN公司提供;ABI PRISM7700系统由美国应用生物系统公司提供;EPS 300型电泳仪、VE-180型电泳槽、VE-186型转膜仪由上海天能科技有限公司提供;Modulus多功能光度计由美国Turner BioSystems提供;PVDF膜由美国Millipore公司提供;微量离心机(LX 300型)由海门市其林贝尔仪器制造有限公司提供;X胶片由Kodak提供等。
2方法
2.1模型复制与神经缺损功能评分参照Longa[5]提出的模型复制及评定方法,假手术组仅作颈动脉分离,其余各组脑缺血2 h后再灌注,再灌注后进行神经缺损功能评分,2~3分者入选。
2.2给药按照成人正常剂量换算,补肾生髓方和益气活血方分别按8.54、10.25 g/kg灌胃给药,模型复制前30 min给药1次,其后每日灌胃2次,假手术组与模型组大鼠接受等容量生理盐水灌胃,持续灌胃10 d。
2.3取材分别在脑缺血2 h再灌注,持续10 d给药后,以10%水合氯醛麻醉(3.5 mL/kg腹腔注射)大鼠后,迅速开颅取脑,在冰冻0.9%生理盐水条件下分离取额顶叶皮质,-80 ℃保存备用。
2.4PCR检测依据规范操作流程[6]进行实时定量PCR检测,以2-ΔΔC(T)相对定量方法[7]分析数据。
2.5Western blot法检测取缺血侧额顶叶皮质约100 mg,裂解、离心,分离蛋白、转膜、漂洗,加入封闭液摇动,室温封闭2 h。用抗体稀释液进行稀释,抗β-actin为鼠抗(1∶1 000稀释,10%分离胶);抗NR4A2、SMO为兔抗(1∶1 000稀释,10%分离胶)。4 ℃孵育过夜,洗涤,用二抗稀释液稀释辣根过氧化物酶标记的二抗(1∶10 000),室温封闭2 h。加入洗涤液TBST洗涤3次,每次10 min。应用电化学发光试剂盒检测蛋白,X光胶片曝光显影,凝胶图像分析仪分析条带光密度,以其与β-actin的比值表示相对表达水平。

3结果
3.1各组大鼠额顶叶皮质Nurr1、SMO mRNA表达水平比较与假手术组比较,模型组Nurr1、SMO mRNA表达水平均明显上调(P<0.05)。模型组、益气活血方组和补肾生髓方组Nurr1 mRNA相对表达水平比较,差异具有统计学意义(F(2,6)=25.08,P=0.001),益气活血方组和补肾生髓方组Nurr1基因表达均较模型组明显下调(P<0.05);3组SMO mRNA相对表达水平比较,差异无统计学意义(F(2,6)=1.33,P=0.333)。见表1。

表1 各组大鼠额顶叶皮质Nurr1、SMO mRNA
注:与假手术组比较,*P<0.05;
与模型组比较,#P<0.05。
3.2各组大鼠额顶叶皮质Nurr1、SMO蛋白表达水平比较与假手术组比较,模型组Nurr1和SMO蛋白表达水平明显上调(P<0.05)。模型组、益气活血方组和补肾生髓方组Nurr1蛋白和SMO蛋白相对表达水平比较,差异均具有统计学意义(Nurr1蛋白:F(2,6)=741.68,P=0.000;SMO蛋白:F(2,6)=244.61,P=0.000),益气活血方和补肾生髓方组Nurr1和SMO蛋白相对表达水平均较模型组明显减少(P<0.05),益气活血方组与补肾生髓方组Nurr1和SMO蛋白表达水平有显著差异(P<0.05)。见图1、表2。

表2 各组大鼠额顶叶皮质Nurr1、SMO蛋白
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与益气活血方组比较,△P<0.05。
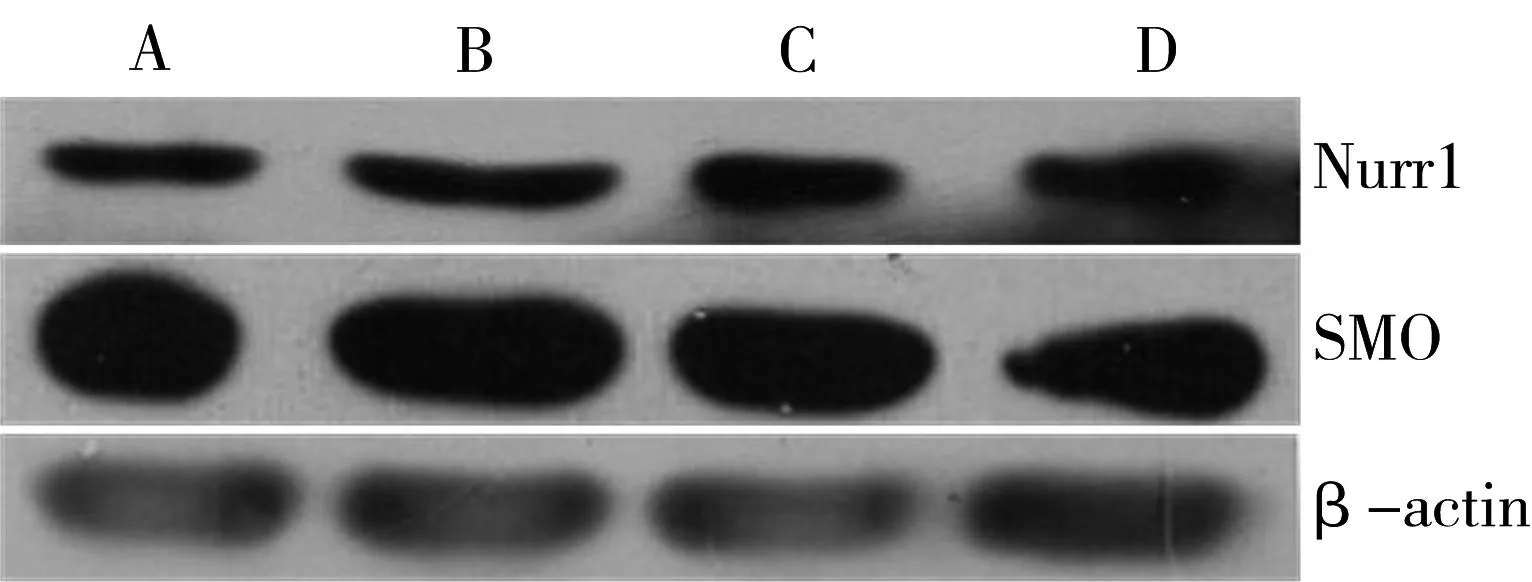
注:A.假手术组;B.模型组;C.益气活血方组;D.补肾生髓方组。
图1各组大鼠额顶叶皮质Nurr1和SMO蛋白
表达水平(Western blot法)
4讨论
由于中国人口逐步进入老龄化,心脑血管病的发病率呈逐年增加的趋势,而其中又以急性脑血管疾病多见。脑卒中在中医学中又被称为“中风”,是属于急性脑血管疾病范畴,其发病率、致残率与病死率均很高,同时也是高复发率的疾病,居中国城市居民死因的首位,其病死率高于心血管疾病及癌症[8],已成为成年人致残的最主要原因,带来了极重的社会负担和经济负担[9]。而这其中又以缺血性中风病最为多见。
近年来通过大量的实验研究证明,NSCs对于缺血性脑卒中的修复起着重要的作用;脑缺血后NSCs的增殖分化为脑缺血损伤的自我修复展示了可喜的前景,但内源性NSCs数量是有限的,如何通过内外源性手段和方法促进自我修复,成为新的研究课题。在胚胎神经系统发育过程中,Notch信号转导通路起着十分重要的作用,在促进内源性NSCs的增殖分化中扮演着非常重要的角色,可以通过多种蛋白质来调节Notch信号转导通路中相关分子的表达、运输和降解等过程[10]。而作为Notch信号转导通路中基因转录蛋白,Nurr1是一种转录因子,属于核受体超家族成员,有研究[11]发现NSCs移植后在脑内分化与Nurr1调控相关,该基因使外源NSCs向神经细胞表型分化增多,通过局灶性脑梗死模型缺血周边区移植转染Nurr1基因的干细胞能显著改善神经功能缺损;SMO蛋白是一种跨膜蛋白,该蛋白能把细胞外Shh信号转换成细胞内Gli信号,以激活Sonic hedgehog信号通路,有研究[12]发现SMO能够参与骨髓基质细胞的神经分化。
在中医学中,作为治疗缺血性脑卒中的常用中医治法益气活血法和补肾生髓法是基于“肾精-脑髓”相关理论和“气血相关”理论而形成的。中医学认为,气与血是脑生长发育和功能活动的物质基础,其中,气是生命之源,包括元气、宗气、营气、卫气,而元气是由肾精所化,是人体中最基本、最重要的气,可激发各脏腑组织的生理功能;而肾精对脑髓的生成和充满起至关重要的作用;而津液也是血液的组成部分,营气与津液同行脉中,从而形成血液;因此气血是化生脑髓的重要源泉,是脑生长发育和维持其生理功能活动的物质基础;“气虚血瘀”与“肾精不足”是缺血性脑卒中的主要病因病机,其治疗核心环节是益气活血和补肾生髓,通过益气活血来改善脑血液循环状态,通过补肾生髓使髓海得养、脑髓充满、神机运转。
本实验研究发现,局灶性脑缺血再灌注大鼠额顶叶皮质模型大鼠Nurr1、SMO mRNA及其蛋白表达显著升高,提示脑缺血后Nurr1、SMO mRNA及其蛋白是一种高表达的状态,其原因是大鼠脑组织在脑缺血再灌注后Notch信号通路被激活。Notch信号通路被激活后,对影响NSCs增殖分化的报道不相一致:有人认为,Notch信号通路抑制后,NSCs进入分化程序;也有人认为,Notch信号通路激活后,NSCs进入增殖程序。益气活血方和补肾生髓方能降低Nurr1、SMO mRNA或蛋白表达。因此认为Notch信号通路Nurr1、SMO mRNA及其蛋白表达可被这两种中药复方抑制,进而影响脑缺血再灌注后NSCs增殖分化,有利于修复损伤脑组织,但其具体分子作用机制尚有待于进一步研究。
参考文献:
[1]Gage FH.Mammalian neural stem cells[J].Science,2000,287(5457):1433-1438.
[2]Lie DC1,Colamarino SA,Song HJ,et a1.Wnt signalling regulates adult hippocampal neurogenesis[J].Nature,2005,437(7063):1370-1375.
[3]Pierfelice T,Alberi L,Gaiano N.Notch in the vertebrate nervous system: an old dog with new tricks[J].Neuron,2011,69(5):840-855.
[4]徐伟,胡建鹏,王键,等.益气活血方和补肾生髓方对局灶性脑缺血再灌注大鼠Ctnnb1和Krt1基因及其蛋白表达的影响[J].北京中医药大学学报,2014,37(2):44-48.
[5]Longa EZ,Weinstein PR,Carlson S,et a1.Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke,1989,20(1):84-91.
[6]Forster T,Roy D,Ghazal P.Experiments using microarray technology: limitations and standard operating procedures[J].J Endocrinol,2003,178(2):195-204.
[7]Livak KJ,Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J].Methods,2001,25(4):402-408.
[8]张国瑾.国外脑血管疾病研究进展[M].北京:中国医药科技出版社,2000:187-197.
[9]Ansari S, Rahmanm,Waters MF,et a1. Recanalization therapy for acute ischemic stroke, part 1: surgical embolectomy and chemical thrombolysis [J]. Neurosurg Rev,2011,34 (1):1-9.
[10]Baron M,Aslam H,Flasza M,et a1. Multiple levels of Notch signal regulation[J].Mol Membr Biol,2002,19(1):27-38.
[11]黎祥喷,沈庆煜,王艺东,等.NURR1基因修饰C17.2神经干细胞移植治疗脑梗死[J].中国组织工程研究与临床康复,2007,11(24):4760-4763.
[12]黄家贵,沈长波,刘舒,等.白藜芦醇诱导大鼠骨髓基质细胞的神经元样细胞分化伴Shh信号激活[J].第三军医大学学报,2013,35(4):280-283.
Effects of Bushen Shengsui Prescription and Yiqi Huoxue Prescription on mRNA and Protein Expression of Nurr1 and SMO in Notch Signaling Pathway in Frontal and Parietal Cortex of Rats with Focal Cerebral Ischemia-Reperfusion
SONGZu-rong1,XUWei2,WANGJian2,HUJian-peng2
(1.SchoolofPharmaceuticalSciences,AnhuiXinhuaUniversity,AnhuiHefei230088,China; 2.KeyLaboratoryofXin’anMedicine,MinistryofEducation,AnhuiUniversityofChineseMedicine,AnhuiHefei230038,China)
[Abstract]ObjectiveTo investigate the effects of Bushen Shengsui Prescription (for tonifying the kidney to regenerate bone marrow) and Yiqi Huoxue Prescription (for tonifying qi and activating blood circulation) on the mRNA and protein expression of Nurr1 and SMO in the Notch signaling pathway in the frontal and parietal cortex of rats with focal cerebral ischemia-reperfusion. MethodsA rat model of right middle cerebral artery occlusion and focal cerebral ischemia-reperfusion was established by suture method. The rats were randomly divided into sham-operation group, model group, Bushen Shengsui group, and Yiqi Huoxue group. The perfusion started at 2 hours after cerebral ischemia and lasted for 7 days. PCR and Western blot were used to measure the mRNA and protein expression of Nurr1 and SMO, respectively. ResultsCompared with the sham-operation group, the model group had significantly upregulated mRNA and protein expression levels of Nurr1 and SMO (P<0.05). Compared with the model group, the Yiqi Huoxue group and Bushen Shengsui group had significantly down-regulated mRNA and protein expression levels of Nurr1 and protein expression of SMO (P<0.05). The mRNA expression of SMO showed no significant differences between the model group, Yiqi Huoxue group, and Bushen Shengsui group (P>0.05). The protein expression levels of Nurr1 and SMO showed significant differences between the Yiqi Huoxue group and Bushen Shengsui group (P<0.05). ConclusionBushen Shengsui Prescription and Yiqi Huoxue Prescription can promote the repair of injured cerebral tissues, which is associated with its ability to down-regulate the mRNA and protein expression of Nurr1 and SMO in the Notch signaling pathway.
[Key words]Cerebral ischemia-reperfusion; Yiqi Huoxue Prescription; Bushen Shengsui Prescription; Notch signaling pathway
(收稿日期:2015-12-14;编辑:曹健)
[中图分类号]R285.5[DOI]10.3969/j.issn.2095-7246.2016.02.020
通信作者:胡建鹏, hujianpeng351@126.com
作者简介:宋祖荣(1977-),女,硕士,讲师
基金项目:国家科技支撑计划项目(2012BAI26B01);国家自然科学基金项目(30973692);安徽省教育厅自然科学研究重点项目(KJ2014A098)
