复方呋塞米螺内酯胶囊的处方筛选
2016-05-18李美珍上官可可杨金荣房志仲
李美珍,上官可可,杨金荣,房志仲
(1.天津医科大学第二医院药剂科,天津300211;2.天津医科大学药学院药剂学教研室,天津市临床药物关键技术重点实验室,天津300070)
论著
复方呋塞米螺内酯胶囊的处方筛选
李美珍1,上官可可1,杨金荣2,房志仲2
(1.天津医科大学第二医院药剂科,天津300211;2.天津医科大学药学院药剂学教研室,天津市临床药物关键技术重点实验室,天津300070)
目的:利用均匀设计法及相关分析优选复方呋塞米螺内酯胶囊处方。方法:以不同处方配比的崩解剂、粘合剂、填充剂、润滑剂为载药辅料,以崩解时限、装量差异、体外溶出度等作为考察指标,采用均匀设计法及相关分析筛选最优处方。测定自制与市售制剂在不同溶出介质中的体外溶出度,并计算f2因子进行比较。结果:确定最佳处方中辅料的种类及其用量,羧甲基淀粉钠(CMS-Na)为崩解剂,水为粘合剂,微晶纤维素(MCC)、乳糖为填充剂,硬脂酸镁、滑石粉为润滑剂。自制与市售制剂在不同溶出介质中溶出度行为并无显著差异(50≤f2≤100)。结论:该试验筛选出的优化复方制备处方和工艺条件,所得颗粒均匀、硬度适宜,制得胶囊外观整洁、崩解迅速。
复方胶囊;呋塞米;螺内酯;处方筛选;f2因子
呋塞米为强效利尿剂,临床上主要用于治疗心脏性水肿、肾性水肿、肝硬化腹水等[1],长期或大剂量应用,可引起低钾血症、低钠血症和代谢性酸中毒,严重时因血容量降低,导致休克甚至死亡[2]。螺内酯为人工合成的类固醇类药物,单独应用效力较弱,与呋塞米等合用,方可取得显著利尿作用,并可抵消相互引起的低钾血症[3-5]。有研究显示呋塞米螺内酯联用可安全有效的治疗轻中度原发性高血压,有良好的耐受性,并且副作用小,不引起血糖、血脂代谢和血清中钾、尿酸浓度的变化[6]。国外已有呋塞米螺内酯复方制剂上市,两种药物的联合应用可减少单独使用所引起的不良反应,增强利尿作用,改善患者的顺应性。但国内目前并无相关药物制剂报道。本研究将呋塞米与螺内酯组成复方制剂,进行处方筛选,并与上市制剂进行体外溶出度比较,为国内仿制制剂研究提供思路。
1 材料和方法
1.1 仪器与试剂
1.1.1 仪器 高效液相色谱仪(美国Spectraphysics、Spectra Focus紫外检测器、输液泵SP8810、Anstar色谱工作站);ZDY-Ⅱ-1 IKVA高精密度单相交流稳压电源(国营启东电讯厂);ALC-210.4电子分析天平(ACCULAB Sartorius group,北京赛多利斯仪器系统有限公司);ZB-1B型智能崩解仪(天津大学精密仪器厂);智能药物溶出仪ZCR-8A(天津市鑫洲科技有限公司);烘箱(天津市中环实验电炉有限公司),0号胶囊板。
1.1.2 试剂 呋塞米原料药(东北制药厂,批号090312),螺内酯原料药(天津天天药业,批号090829),对照(市售)制剂Lasilactone Capsules(Sanofiaxentis,127386A),羧甲基淀粉钠(湖州展望化学药业有限公司,20101014),微晶纤维素-102(山东聊城阿华制药有限公司,20100602),乳糖(上海华茂药业有限公司,100609),硬脂酸镁(湖州展望化学药业有限公司,20101101),滑石粉(山东聊城阿华制药有限公司,091280),聚维酮(山东聊城阿华制药有限公司,100245),0号胶囊壳(苏州胶囊有限公司,28095),其它试剂均为市售分析纯,重蒸水(自制)。
1.2 实验方法
1.2.1 胶囊的制备 称取处方量的CMS-Na作为崩解剂,MCC、乳糖作为填充剂,与呋塞米、螺内酯原料药用等量递加法将其混合均匀,缓慢将黏合剂加入到混合物中制软材,用24目筛制粒,40℃烘干后过24目筛整粒。加入滑石粉、硬脂酸镁作为润滑剂混合均匀后装入0号胶囊壳中,每粒重400 mg,其中含药颗粒300 mg。
1.2.2 考察方法
1.2.2.1 崩解时间测定:取供试品6粒,分别置吊篮的玻璃管中,每管各加1粒,加挡板,按《中国药典》2010版(二部)附录XA崩解时限检查法进行测定,各粒均应在30 min内全部崩解。如有1粒不能完全崩解,应另取6粒复试,均应符合规定。
法拉利所使用的V12发动机能够输出澎湃的动力,兰博基尼的V10发动机能制造出震撼人心的排气声线,迈凯伦行驶起来则拥有如钻石切割般的精准,奥迪的品质感正诠释着其对生活品质的追求,阿斯顿·马丁当然会流露出令人魂牵梦绕的英伦气息。
1.2.2 2 体外溶出度的测定:(1)呋塞米溶出度测定方法:呋塞米溶出度测定按照《中国药典》2010年版(二)附录XC第二法进行测定,以磷酸盐缓冲液(pH6.8)1 000 mL为溶出介质,温度(37.0±0.5)℃,50 r/min,依法操作,于不同时间点取样10 mL(取出后迅速补加37℃等量新鲜介质),经0.45 μm微孔滤膜滤过,取续滤液在239 nm波长下,按照液相色谱条件进行测定。分别计算不同时间的累积溶出百分率,绘制溶出曲线。30 min时应不少于标示量的65%。(2)螺内酯溶出度测定方法:螺内酯溶出度测定按照《中国药典》2010年版第二部附录XC第二法进行测定,以0.1%十二烷基硫酸钠的0.1 mol/L盐酸溶液1 000 mL为溶出介质,温度(37.0±0.5)℃,50 r/min,依法操作,于不同时间点取样10 mL(取出后迅速补加37℃等量新鲜介质),经0.45 μm微孔滤膜滤过,取续滤液在239 nm波长下,按照液相色谱条件进行测定。分别计算不同时间的累积溶出百分率,绘制溶出曲线。60 min时应不少于标示量的80%。
1.2.3 处方设计[7-10]通过预试验,确定对复方制剂制备工艺影响较大的因素主要有崩解剂、填充剂、粘合剂的种类等几方面。
1.2.3.1 崩解剂的选择:预试验表明,崩解剂的种类对胶囊的崩解时限有很大影响。本试验选用不同的崩解剂类型,即PPVP、CMS-Na和L-HPC进行崩解剂的考察,以崩解时限为主要指标进行筛选。如表1所示。

表1 崩解剂加入方式的考察Tab 1 Investigation of disintegrating agents
1.2.3.2 填充剂的确定:填充剂的种类对胶囊的装量差异与溶出度等有很大影响。选用乳糖、MCC及联用进行试验,以装量差异及30 min时呋塞米累积溶出百分率(A)、60 min时螺内酯累积溶出百分率(B)为指标进行筛选。如表2所示。
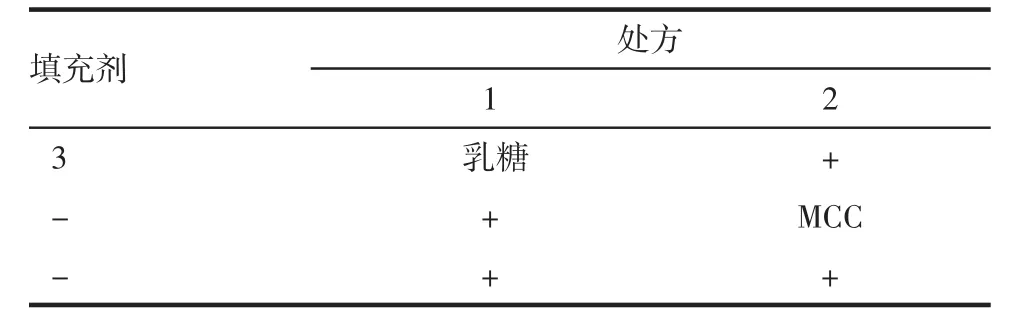
表2 填充剂的筛选Tab 2 Selection of filling agents
1.2.3.3 黏合剂或润湿剂的筛选:按以上处方筛选结果,分别以8%淀粉浆、5%PVPK30醇溶液、水为黏合剂或润湿剂,湿法制粒,制备制剂,以装量差异及崩解时限为指标进行筛选。
1.2.4 处方优化[11-12]
1.2.4.1 均匀设计优化处方:根据以上单因素考察的试验,其中崩解剂、填充剂的种类及用量是主要影响因素。本试验拟考察MCC(X1)和CMS-Na(X2)的用量,采用U5*(53)均匀设计方法,以30 min时呋塞米累积溶出百分率(A)、60 min时螺内酯累积溶出百分率(B)为标准,其满分各为50分,两者总和为该制剂评价得分,选取最优处方。其设计水平见表3,U5*(53)均匀设计表见表4,U5*(53)均匀设计使用表见表5。

表3 试验因素水平设计表(%)Tab 3 Factors and levels for homogeneous design(%)
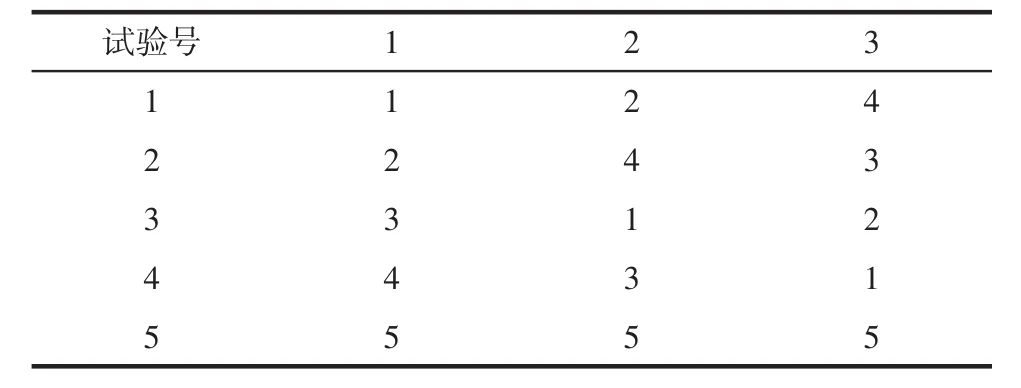
表4 U5*(53)均匀设计表Tab 4 Homogeneous design list

表5 U5*(53)使用表Tab 5 U5*(53)usage list
1.2.4.2 数据处理:由DPS软件分别对制剂评价得分数据做出线性回归、逐步回归、二次多项式逐步回归、多因子及互作项逐步回归、多因子及平方项逐步回归,选取最佳函数模型,筛选出最佳MCC(X1)和CMS-Na(X2)的用量。
1.2.4.4 最佳处方溶出度试验:根据筛选的最佳处方制备制剂,按照“1.2.2.2项下”溶出度测定方法,分别测定自制与市售胶囊在0.1 mol/L HCl、水、PBS4.5、PBS6.8 4种介质中的溶出度,并采用f2相似因子法进行复方胶囊中呋塞米、螺内酯体外溶出曲线的统计分析。
2 结果
2.1 胶囊壳崩解时限的测定 按照“1.2.2.1项下”进行试验,胶囊壳的崩解时间为6 min左右,全溶时间15 min左右,符合中国药典规定。
2.2 崩解剂的选择 按照“1.2.3.1项下”试验方法,对6个处方以崩解时限及30 min时呋塞米累积溶出百分率(A)、60 min时螺内酯累积溶出百分率(B)为指标考察,对制剂进行综合评价。结果见表6。表明不同类型的崩解剂及其联用对制剂的崩解时限影响显著。《中国药典》2010版(二部)附录XA规定,硬胶囊剂应在30 min内全部崩解,处方4~6崩解较快,呋塞米、螺内酯体外溶出速度快;处方1、3崩解较慢;处方2崩解时间适宜,且根据呋塞米、螺内酯体外溶出度试验绘制的溶出曲线均较平缓,故选CMS-Na为崩解剂。

表6 崩解剂考察结果Tab 6 Results of disintegrating agent
2.3 填充剂的选择 按照“1.2.1项下”制备胶囊,结果表明乳糖、MCC单用时装量差异较大,而二者联合应用时装量差异较小,符合规定,且30 min时呋塞米累积溶出百分率(A)、60 min时螺内酯累积溶出百分率(B)也均符合规定,溶出曲线也较平缓,故采用乳糖与MCC联合应用。
2.4 黏合剂或润湿剂的筛选 试验结果表明分别以8%淀粉浆、5%PVPK30醇溶液、水为黏合剂或润湿剂,湿法制粒,所得颗粒流动性均良好,装量差异、崩解时限均符合要求,体外溶出30 min时呋塞米累积溶出百分率、60 min时螺内酯累积溶出百分率也无显著性差异,考虑到用水作润湿剂时简单方便,故选用水为复方胶囊的润湿剂。
2.5 均匀设计优化处方结果
2.5.1 均匀设计试验 采用U5*(53)均匀设计方法,以30 min时呋塞米累积溶出百分率(A)、60 min时螺内酯累积溶出百分率(B)为标准,其满分各为50分,两者总和(Y)为该制剂评价得分,其结果见表7。

表7 均匀设计试验结果Tab 7 Results of uniform design
2.5.2 均匀设计法试验结果数据处理 经DPS软件分别对所得实验数据做出线性回归、逐步回归、二次多项式逐步回归、多因子及互作项逐步回归、多因子及平方项逐步回归,根据所得各函数各项参数,最终选取二次多项式逐步回归和多因子及平方项逐步回归作为最佳函数模型。其拟合方程均为:Y=8.86954593+0.04050321826X1+15.598048274X2 -0.650 331 334 1X2*X2。最高指标时各因素组合:Y=100.623 5,X1=19.914 2,X2=10,即每粒胶囊中MCC含量为60 mg(20%),CMS-Na含量为30 mg(10%)。
2.6 最佳处方的确定 处方/粒:呋塞米20.0 mg,螺内酯50.0 mg,羧甲基淀粉钠30.0 mg,微晶纤维素60.0 mg,乳糖122.0 mg,滑石粉15 mg,硬脂酸镁3.0 mg,总重300.0 mg。
2.7 最佳处方溶出度试验结果 自制与市售复方胶囊中呋塞米与螺内酯不同溶出介质体外溶出度测定结果见表8~11。
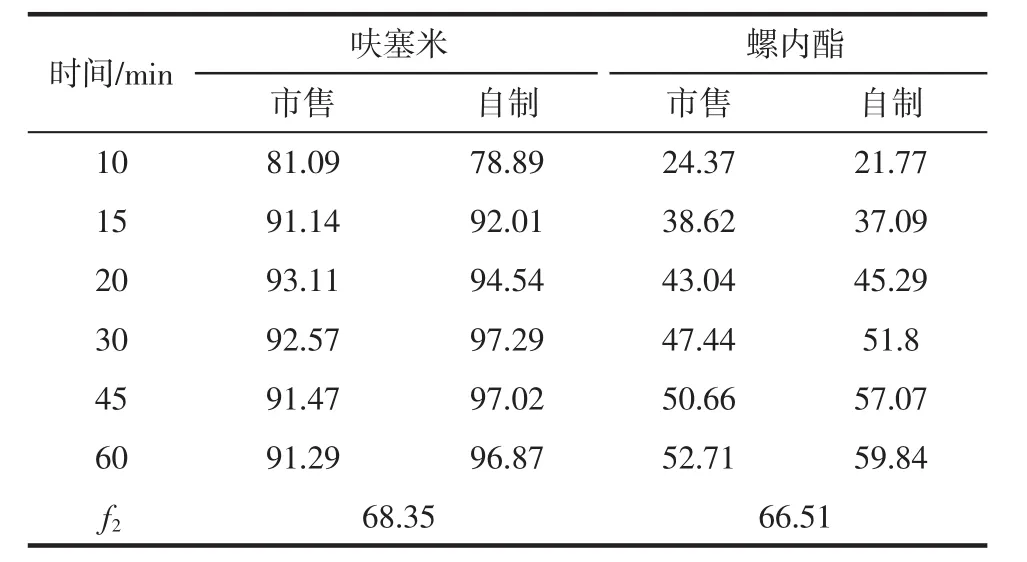
表8 PBS6.8溶出度的测定结果(%)Tab 8 Results of dissolution in PBS6.8(%)
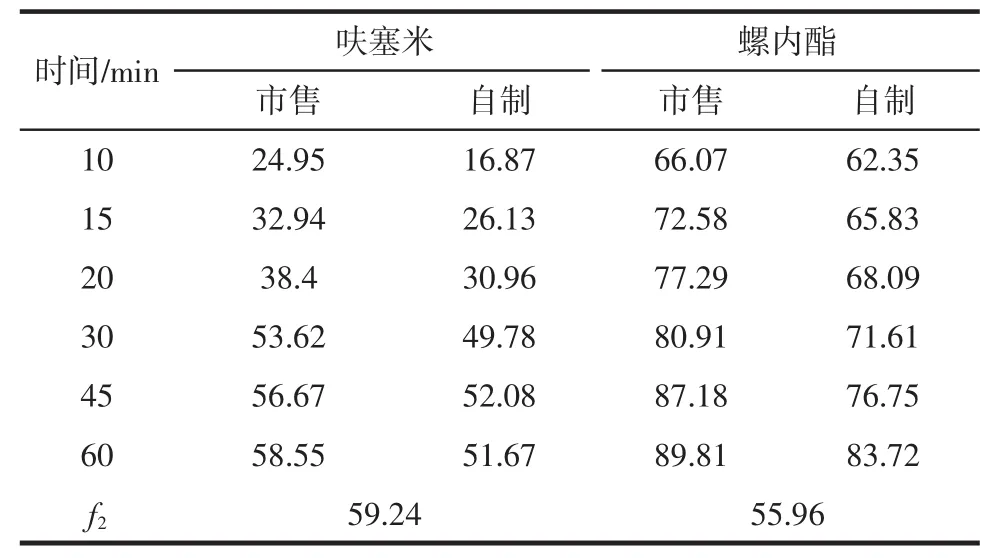
表9 0.1 mol/L盐酸溶液溶出度测定结果(%)Tab 9 Results of dissolution in 0.1 mol/L HCl(%)
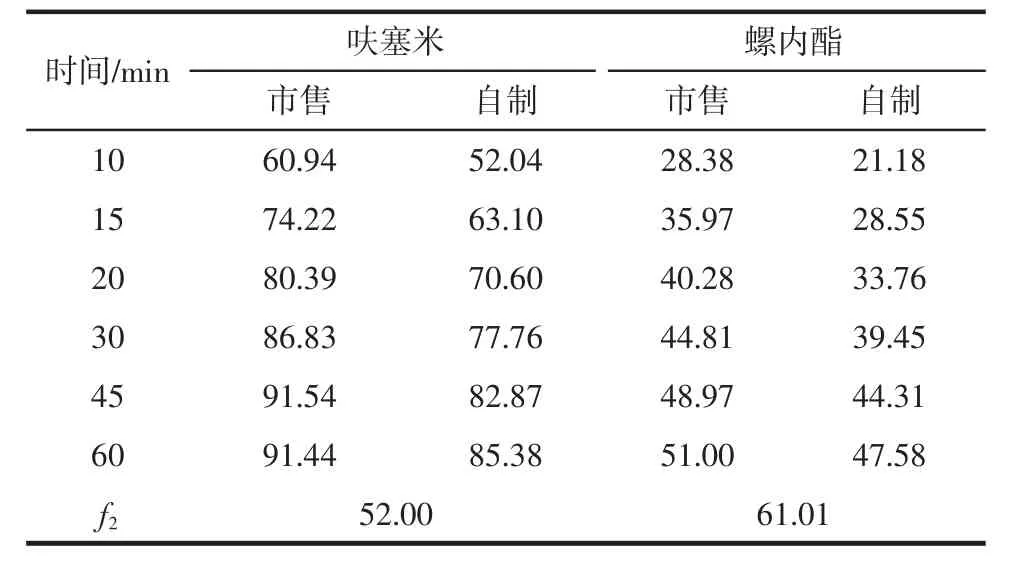
表10 水中溶出度测定结果(%)Tab 10 Results of dissolution in water(%)

表11 PBS4.5中溶出度测定结果(%)Tab 11 Results of dissolution in PBS4.5(%)
由以上试验结果可知,自制与市售复方胶囊中呋塞米、螺内酯在PBS6.8、0.1 mol/L盐酸、水、PBS4.5 4种溶出介质中的溶出度行为并无显著差异(50≤f2≤100)。
3 讨论
3.1 空胶囊壳崩解时限的测定[13-14]本试验在空胶囊中装满滑石粉,加挡板进行测定。《中国药典》2000年版二部正式收载,但2005年版《中国药典》修订时,没再收录空心胶囊及肠溶空心胶囊标准。前3个标准的崩解时限为20 min,后一个标准为10 min,而判断标准都是全溶或崩解。GB1371-92是国家标准,现阶段国内的空心胶囊标准相当于有两个。由于空心胶囊已纳入药品管理,故国内大多数生产厂家和药厂都执行《中国药典》2000年版(二部)标准,查阅相关文献表明空心胶囊在10 min内全溶的很少。
3.2 药物晶型[15]药物晶型不同,导致晶格能不同,药物的熔点、溶解速度、溶解度等也不同,对药物溶出度有一定影响。本试验所用呋塞米原料药有晶型,用其进行处方设计制备制剂,呋塞米溶出度测定时,呋塞米不能完全溶出,累积溶出百分率低,当把呋塞米原料药粉碎过100目筛后进行试验,呋塞米可完全溶出。故本试验制剂处方中所用呋塞米为原料药粉碎后过100目筛所得。
3.3 均匀设计试验 固体药物制剂的体外溶出度数据是评价其质量的重要依据,而根据“1.2.3项下”处方设计试验中单因素考察结果可知,其中崩解剂、填充剂的种类及其用量是体外溶出度试验的主要影响因素,故采用U5*(53)均匀设计方法考察MCC(X1)和CMS-Na(X2)的用量,并以30 min时呋塞米累积溶出百分率(A)、60 min时螺内酯累积溶出百分率(B)为标准,其满分各为50分,两者总和(Y)为该制剂评价得分。其中A以65%、B以80%为满分50分。
3.4 不同溶出介质确定[16]日本于1998年推出《药品品质在评价工程》,其主要理念如下:药物主要在消化道吸收,由于人体内环境千差万别,故消化道内的体液pH值也各不相同。一个优良的药物,应不受pH值的影响,在各种环境下均能有所释放从而被吸收;而一个低品质药物,则可能只在一种pH值介质中释放,在其它pH值介质中就难有表现了。故本文同时考察药物在0.1 mol/L HCl、水、PBS4.5、PBS6.8 4种介质中的溶出度。
3.5 溶出度分析方法[17]固体药物制剂的体外溶出度数据是评价一种药物制剂不同品种、不同厂家产品、不同批次间质量的重要依据。在制剂的开发研究中,通过对比不同处方之间的溶出曲线,可以准确的反映药物处方、工艺、生产场地以及规模等因素变化对药物体外释放行为的影响。根据文献报道,比较体外溶出度曲线的方法一般有(1)方差分析法;(2)非模型依赖法;(3)模型依赖法。每一种又包括多种具体方法。其中非模型依赖法的f2相似因子法可直接对释药数据进行统计分析,无需拟合各种释药速率,可灵敏、准确的反映制剂的体外溶出或释放曲线之间的差异,被FDA推荐为比较两条溶出曲线相似性的首选方法。当50≤f2≤100时,表明制剂具有相似的体外溶出或释放特性。本试验采用f2相似因子法进行复方胶囊中呋塞米、螺内酯体外溶出曲线的统计分析。
[1]王芳.利尿剂概述[J].临床肾脏病杂志,2011,10(11):484
[2]马艳华.呋塞米的临床新用途[J].黔南民族医专学报,1998(2):26
[3]张国胜.螺内酯的临床应用[J].健康大视野·医学分册,2007,2(2):23
[4]张芳,张兴元,张洁,等.醛固酮拮抗剂临床应用的研究[J].滨州医学院学报,2010,33(5):378
[5]贺秀玲.浅谈螺内酯的新用途[J].中外健康文摘,2011,8(23):286
[6] Birbarl A E,Daouk M M,Mukaddam-daher S.Efficacy and safety oflasilactone,anewcombinationdiuretic,inessentialhypertension[J]. General Pharmacology,1987,18(6):609
[7]张崭,王玲,屈凌波.福多司坦胶囊的制备及其处方优化[J].河南师范大学学报:自然科学版,2010,38(6):98
[8]张树生,赵山山.头孢呋辛酯胶囊的制备工艺[J].河北化工,2010,33(8):47,60.
[9]侯国枝,田治科,张茹英,等.巴洛沙星胶囊的制备工艺及溶出度研究[J].中国药业,2009,18(12):53
[10]史银基,刘砥威,石雪,等.克拉霉素胶囊中粘合剂及用量的确定[J].新疆医学,2011,18(4):132,140
[11]冯李文.均匀设计法及其在新产品开发中的应用[J].川化,2005,30(2):18
[12]郭东星,仇丽霞,张满栋.均匀设计方法及其应用[J].数理医药学杂志,2005,18(1):69
[13]周涛.空心胶囊崩解时限的讨论[J].中国药事,2002,16(9):45
[14]郑琴,陈青阳,杨明,等.空胶囊的研究现状及解决中药胶囊吸潮问题的思考[J].江西中医学院学报,2007,19(6):74
[15]阳长明,侯世祥.药物溶出度研究进展[J].中成药,2000,22(7):53
[16]谢沐风,张启明,陈洁,等.国外药政部门采用溶出曲线评价口服固体制剂内在品质情况简介[J].中国药事,2008,22(3):257
[17]陈贤春,吴清,王玉蓉,等.关于溶出曲线比较和评价方法[J].中国医院药学杂志,2007,27(5):662
(2015-07-29收稿)
Optimizing prescription of the compound furosemide and spironolactone capsules
LI Mei-zhen1,SHANGGUAN Ke-ke1,YANG Jin-rong2,FANG Zhi-zhong2
(1.Department of Pharmacy,The Second Hospital,Tianjin Medical University,Tianjin 300211,China;2.Department of Pharmacy, College of Pharmacy,Tianjin Medical University,Tianjin Key Laboratory on Technologies Enabling Development of Clinical Therapeutics and Diagnostics(Theranostics),Tianjin 300070,China)
O bjective:To Use uniform design method and correlation analysis to optimize the prescription of compound capsules.Methods:Many different formulations were designed by the uniform experimental of statistics,the blank capsules of all formulations were made,and the disintegration time,the packing amount divergent,and dissolution experiments of capsule as inspection indexes were added to set up the best formulations.Determination of the dissolution of self-made and marketed preparations in different dissolution media,and calculation of the f2factor were carried out.Results:The kind and dosage of accessories in the best formulations were determined,CMSNa was disintegrant,water was binding agent,MCC and lactose were used as fillers,and magnesium stearate and French chalk were used as lubricants.There was no significant difference in the dissolution behaviors of the self-made and marketed preparations in different dissolution media.Conclusion:The selected optimal preparation and the formulation of compound capsules have good process conditions, and the uniform particles,hardness is appropriate,the capsule appearance neat,sputtering quickly.
compound capsules;furosemide;spironolactone;formulation optimization;f2factor
R9
A
1006-8147(2016)02-0171-05
李美珍(1986-),女,硕士,研究方向:临床药学;通信作者:房志仲,E-mail:fangzhizhong@tmu.edu.cn。
