前列腺导管腺癌诊疗分析(附6例报道)
2016-05-18李鹏昊杨同张志宏徐勇杜娥
李鹏昊,杨同,张志宏,徐勇,杜娥
(天津医科大学第二医院泌尿外科,天津市泌尿外科研究所,天津300211)
论著
前列腺导管腺癌诊疗分析(附6例报道)
李鹏昊,杨同,张志宏,徐勇,杜娥
(天津医科大学第二医院泌尿外科,天津市泌尿外科研究所,天津300211)
目的:探讨前列腺导管腺癌(DAP)的临床特征和治疗方法,提高对DAP的认识和诊疗水平。方法:回顾性分析6例前列腺导管腺癌患者的临床资料。患者年龄67~80岁,平均76.8岁,6例均有不同程度的排尿困难,2例伴肉眼血尿,3例血清前列腺特异性抗原(PSA)高于正常值,6例均由病理证实为DAP,根据患者不同病情行手术或药物治疗。结果:所有患者术后随访5~48个月,4例患者死亡,2例未见肿瘤复发或转移。结论:DAP早期较难诊断,恶性程度较高,预后较差,早期确诊后建议行根治性手术治疗。
前列腺导管腺癌;鉴别诊断;治疗
前列腺导管腺癌(ductal adenocarcinoma of the prostate,DAP)是一种罕见的前列腺癌类型,约占前列腺穿刺活检病理总数的0.4%~1%,通常它被认为比同期的前列腺腺泡癌预后更差[1-2]。DAP被认为是从前列腺导管上皮发展而来,多数位于尿道周围移行带大导管和外周带次级导管中[3]。一部分DAP在尿道移行带呈外生型生长,临床表现为血尿和早期的下尿路梗阻症状[4],一部分DAP无明显临床表现,前列腺特异性抗原(prostate specific antigen,PSA)也处于正常值范围,早期难以诊断,发现时往往分期较晚,预后不佳[5]。本文回顾性分析我院2010年6月—2014年9月收治的6例确诊为DAP患者的资料,并结合相关文献,对其临床及病理特征和诊疗方法进行分析。
1 资料与方法
1.1 临床资料 本组6例,年龄67~80岁,平均76.8岁。入院时6例患者均有不同程度排尿困难症状,其中2例发现肉眼血尿。入院后查血清PSA,3例PSA高于正常值(4ng/mL),其余均在正常范围。行直肠指检,4例患者前列腺呈III°肿大,2例前列腺为I°肿大,6例患者前列腺整体触及均韧,其中1例于前列腺左叶外侧可触及硬结。B超及MRI检查发现1例患者前列腺左后方结节影,伴双侧输尿管扩张和双肾积水,骨扫描提示全身多处转移癌,其余病例相关辅助检查均提示前列腺增生。入院时4例误诊为前列腺增生,2例怀疑前列腺癌行前列腺穿刺活检。在所有患者中,3例伴肾功能不全,4例伴尿道感染。6例均经B超引导下穿刺或术后病理检查确诊为DAP,进行Gleason评分均为8~9分。
1.2 治疗方法 1例行经直肠超声引导下前列腺穿刺活检确诊为DAP,限期行耻骨后根治性前列腺切除术,术后分期为T3bN0M0;2例行耻骨后经膀胱前列腺切除术,2例行经尿道前列腺切除术,术后病理证实为DAP,分期分别为T1aN0M0,T3N0M1b,T4N0M0,T3N0M0,上述5例患者确诊后均行内分泌治疗(比卡鲁胺或氟他胺+醋酸戈舍瑞林或曲谱瑞林),因患者高龄且身体一般情况较差,未再次行手术治疗以及放疗或化疗。1例因行前列腺穿刺确诊前列腺癌后行骨扫描检查发现肿瘤多发骨转移,失去手术时机,仅行内分泌治疗(比卡鲁胺+醋酸戈舍瑞林)和抗骨转移治疗(帕米膦酸二钠)。
2 结果
经直肠B超引导下穿刺或术后病理检查结果均为DAP(图1),其中3例伴腺泡癌,2例伴浸润癌,2例伴筛状癌,1例伴实体癌,1例尿道部黏膜受侵并伴脉管瘤栓,1例精囊受侵。其中2例病理标本进行免疫组化染色:1例PSA(+),P504s(+),CK7(-),P63(-),34BE12(-);1例P504s(-),CK7(-),P63(-),34BE12(-)。随访5~48个月,4例患者于术后5~28个月死亡,其余2例患者定期复查未见肿瘤复发或转移(表1)。
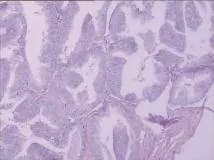
图1 前列腺导管腺癌,大量乳头状结构伴导管扩张(HE×100)
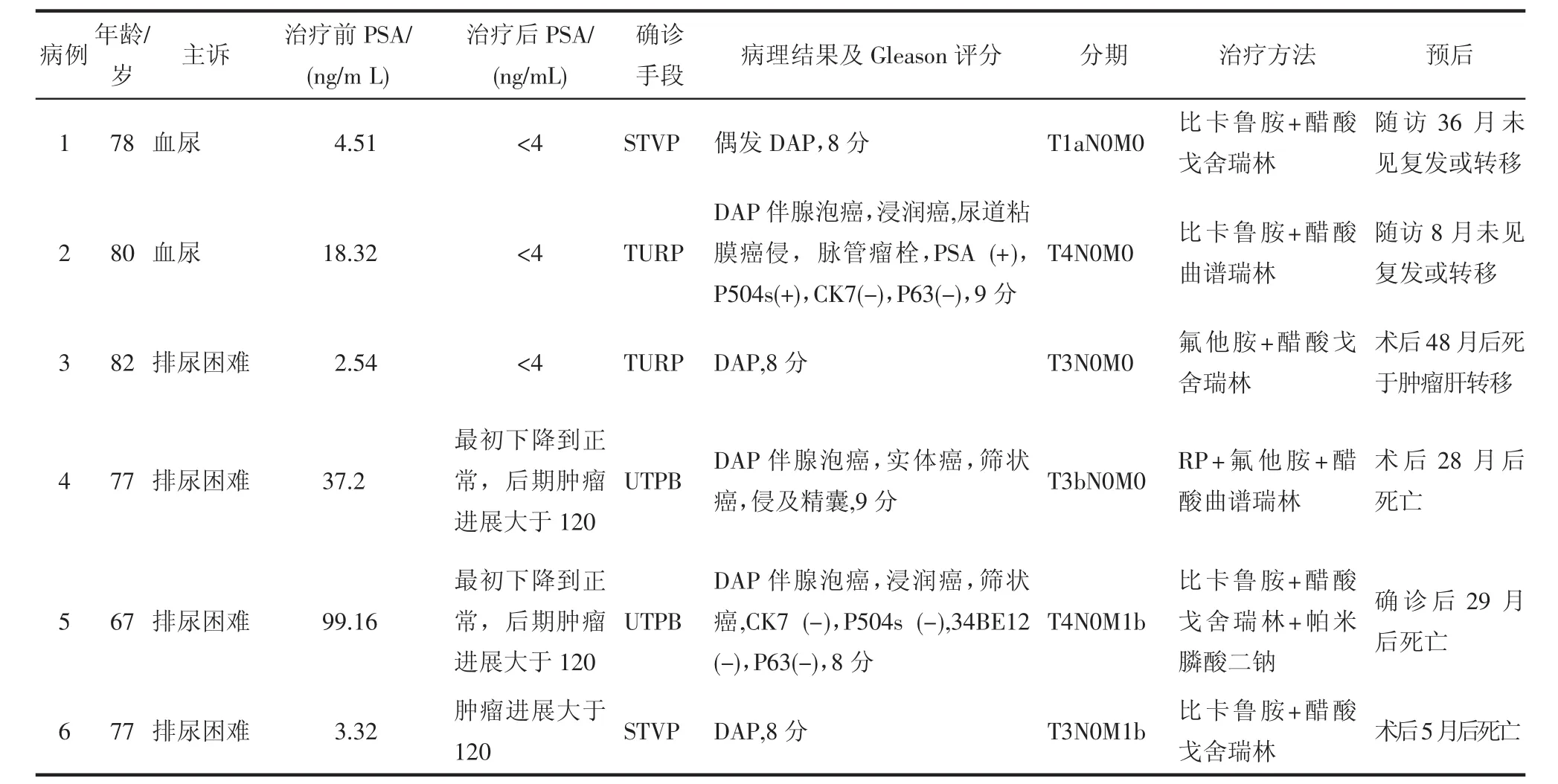
表1 6例前列腺导管腺癌患者的临床及病理资料
3 讨论
3.1 病理特征 前列腺癌是一种在老年男性人群中常见的恶性肿瘤,在西方国家是主要的死因之一[6],在我国发病率约为2.1%,死亡率约为1.2%[7]。作为前列腺癌的一种罕见亚型,单纯DAP的发病率只占前列腺癌的0.4%~1%[1-2],其中多数合并腺泡腺癌,也有部分合并浸润癌、筛状癌或实体癌,约占前列腺癌总数的5%[8]。
根据生长部位的不同,DAP分为中央型和周围型。中央型DAP起源于前列腺移行带的大导管,肿物呈外生型生长,表现为息肉状或菜花状,突出于前列腺尿道内,并沿大导管播散;周围型DAP起源于前列腺次级导管,可在周围腺体实质中浸润型生长,引起前列腺体积变大,质地变硬。组织学上DAP主要表现为前列腺导管高柱状假复层细胞,部分可见肿瘤细胞呈乳头状增生伴纤维血管轴心,扩张的腺体呈“背靠背”形态并形成筛网状结构。然而,随着肿瘤进展并发生转移,DAP的病理形态会发生改变,可能由最初的筛状变为实性或粉刺样坏死型[9],预后更差。
一般的前列腺癌细胞免疫组化染色PSA和PSAP阳性,同时CK7和CK20阴性,AMACR一般呈高表达阳性,但是基底细胞对p63和HMWCK阴性[10]。个别DAP免疫组化中PSA阴性,但却伴随CK20阳性,这可能被误诊为原发性膀胱癌[11]。多数前列腺癌细胞中,P504s呈阳性表达,其定位于癌细胞的胞浆中,但是胰腺癌、结肠癌也会有表达。本组病理结果中3例伴腺泡癌,2例伴浸润癌,2例伴筛状癌,1例伴实体癌,其中2例行免疫组化染色,PSA阳性1例,P504s阳性和阴性各1例,CK7和P63均为阴性。
3.2 临床特点、诊断及鉴别诊断 DAP临床上主要见于老年人,本组病例发病年龄均为67岁以上。一般来说,DAP临床症状主要取决于原发肿瘤和前列腺的位置关系,部分DAP在尿道移行带呈外生型生长,临床表现为血尿和早期的尿道梗阻症状。本组病例中,全部6例均有不同程度的下尿路梗阻症状,其中2例伴有肉眼血尿。由于肿瘤发生在前列腺导管,早期多数DAP患者直肠指检不易触及前列腺硬结,本组病例只有1例触及前列腺异常硬结,其余5例直肠指检均未发现异常。部分DAP患者早期就诊时PSA不高也增加了诊断的难度,本组病例中2例低PSA患者,在肿瘤扩散后PSA才发现升高。
本组6例患者中4例被误诊为前列腺增生,没有进一步行前列腺穿刺活检。反思其原因,一种情况是低PSA同时阴性的直肠指检结果增加了早期诊断的难度,但另一种情况是偏高的PSA患者由于前列腺体积较大,下尿路梗阻时伴有一定程度的前列腺感染或炎症,也可能使PSA增高,这种状况往往使就诊医师诊断时忽视了前列腺癌的可能。因此,对任何怀疑为前列腺癌的患者都提倡行前列腺穿刺活检,取得病理并做免疫组化,从而提高确诊率,减少误诊。对于PSA偏低(<10 ng/mL),前列腺体积较大(>40 mL),PSA密度(<0.25 ng/mL/g)偏低的患者,行经会阴前列腺饱和穿刺比传统的经直肠前列腺穿刺更能提高穿刺的阳性率[12]。此外,经会阴比经直肠入路安全性高,从解剖学上分析经会阴穿刺的进针方向几乎平行于该处尿道走行方向,降低了损伤尿道的概率[13]。
临床上DAP诊断时需要以下疾病相鉴别:(1)前列腺高级上皮内瘤样病变(HGPIN):DAP的腺体一般较大或呈特殊的“背靠背”形态,而HGPIN通常为正常腺体大小,病理中若出现乳头状或筛状结构,则提示DAP可能性大;(2)前列腺移行细胞癌:DAP免疫组化中PSA和PSAP染色多为阳性,可证实前列腺起源,但少数PSA阴性,CK20阳性表达的患者易被误诊为起源于膀胱的移行细胞癌;(3)膀胱或直肠腺癌:发生于膀胱或直肠的腺癌均可累及前列腺,PSA和PSAP染色可鉴别,相关的影像学检查也能帮助诊断;(4)尿道黏膜皱折或增殖性乳头状尿道炎:膀胱镜下取病理活检并行免疫组化染色可帮助确诊;(5)筛状G4腺泡腺癌:p63及HMWCK免疫染色阳性提示基底细胞存在,可帮助鉴别G4腺泡腺癌。
3.3 治疗及预后 目前DAP尚无统一的治疗原则,主要采用与其Gleason评分相同的前列腺腺泡癌的治疗方案,包括根治性前列腺切除术、前列腺粒子植入、局部外放疗,抗雄激素内分泌治疗、全身化疗等,伴骨转移的给予相应的抗骨转移治疗。值得注意的是DAP对内分泌治疗和放疗是敏感的,在临床已被用于治疗晚期进展型的患者。Eade等[14]报道了6例DAP患者在经历放疗后血清PSA水平显著下降,在随访的过程中没有发现肿瘤局部复发,使生存期显著延长。本组4例表现为PSA升高的DAP患者行内分泌治疗后,PSA均下降到正常,表明其治疗有效。
关于DAP的预后,近期一些研究发现,对于局部晚期前列腺癌病理类型为DAP的患者行根治性手术切除或放疗,比一般前列腺腺泡癌更易生化复发,预后更差[15-16]。而Aydin[17]和Tu等[18]考虑DAP患者可能不比一般前列腺腺泡癌患者预后差。还有一些研究者认为,DAP的预后与临床分期,肿瘤的原发部位及侵及深度,还有是否合并前列腺病变等多因素相关。Tu[18]和Samaratunga等[19]对行根治性前列腺切除术后患者的病理进行研究,发现多于60%的DAP患者处于T3期,而一般的前列腺腺泡癌这一比例只有30%。本组6例患者,5例确诊时明确分期处于或晚于T3期或M1期,分析本组资料发现当肿瘤出现远处转移,经手术或内分泌治疗后PSA控制欠佳的患者预后较差,最快于确诊后5个月死亡,若PSA控制较好,生存期可延长到48个月,若是处于T1期的偶发DAP,经内分泌治疗后PSA控制在正常范围内,预后较好,目前随访36个月,未发现肿瘤复发或转移。本组病例中,4例Gleason评分大于8分,显示DAP恶性程度较高。
作为前列腺癌的一种罕见亚型,DAP发病率较低,临床表现不典型,难以早期诊断,主要通过前列腺穿刺活检病理及免疫组化来确诊,具有病理分期晚、恶性程度高、易远处转移的特点,预后较差。建议对任何怀疑为前列腺癌的患者都行经直肠前列腺穿刺活检,注意不能凭经验误诊为前列腺增生,丧失最佳的根治性手术时机。对于PSA偏低(<10 ng/mL),前列腺体积较大(>55 mL),PSA密度偏低(<0.25 ng/ mL/g)的患者,建议行经会阴前列腺饱和穿刺,提高阳性率。早期确诊后行根治性手术治疗,术后密切随访,监测PSA水平,根据病情选择内分泌治疗或放化疗,采取综合治疗方法求得最长的生存期。
[1] Meeks J J,Zhao L C,Cashy J,et al.Incidence and outcomes of ductal carcinoma of the prostate in the USA:analysis of data from the Surveillance,Epidemiology,and End Results program[J].BJU Int, 2012,109(6):831
[2] Mikuz G.Histologic classification of prostate cancer[J].Anal Quant Cytopathol Histopathol,2015,37(1):39
[3] GrignonDJ.UnusualsubtypesofprostateCancer[J].ModPathol,2004, 17(3):316
[4]Shazer R L,Luthringer D,Agus D B,et al.Ductal adenocarcinoma of the prostate[J].Clin Adv Hematol Oncol,2004,2(6):393
[5] Morgan T M,Welty C J,Vakar-Lopez F,et al.Ductal adenocarcinoma of the prostate:increased mortality risk and decreased serum prostate specific antigen[J].J Urol,2010,184(6):2303
[6] Siegel R,Ma J M,Zou Z H,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9
[7] Ferlay J,Shin H R,Bray F,et al.Estimates of worldwide burden of Cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12): 2893
[8] Christensen W N,Steinberg G,Walsh P C,et al.Prostatic duct adenocarcinoma.Findings at radical prostatectomy[J].Cancer,1991, 67(8):2118
[9] Zhao Tao,Liao Banghua,Yao Jin,et al.Is there any prognostic impact of intraductal carcinoma of prostate in initial diagnosed aggressively metastatic prostate cancer[J].Prostate,2015,75(3):225 [10]HerawiM,EpsteinJI.Immunohistochemicalantibodycocktailstaining (p63/HMWCK/AMACR)of ductal adenocarcinoma and Gleason pattern 4 cribriform and noncribriform acinar adenocarcinomas of the prostate[J].AmJSurgPathol,2007,31(6):889
[11]Leite K R,Mitteldorf C A,Srougi M,et al.Cdx2,cytokeratin 20, thyroidtranscriptionfactor1,andprostate-specificantigenexpression inunusualsubtypesofprostateCancer[J].AnnDiagnPathol,2008,12 (4):260
[12]Jiang X,Zhu S,Feng G,et al.Is an initial saturation prostate biopsy scheme better than an extended scheme for detection of prostate cancer.A systematic review and meta-analysis[J].Eur Urol,2013, 63(6):1031
[13]薛健,梁磊,姜文弟,等.经会阴饱和穿刺与传统前列腺穿刺活检法诊断前列腺癌对比分析[J].天津医药,2013,41(9):920
[14]Eade T N,Al-Saleem T,Horwitz E M,et al.Role of radiotherapy in ductal(endometrioid)carcinoma of the prostate[J].Cancer,2007, 109(10):2011
[15]Van der Kwast T,Al Daoud N,Collette L,et al.Biopsy diagnosis of intraductal carcinoma is prognostic in intermediate and high risk prostate Cancer patients treated by radiotherapy[J].Eur J Cancer, 2012,48(9):1318
[16]Kimura K,Tsuzuki T,Kato M,et al.Prognostic value of intraductal carcinoma of the prostate in radical prostatectomy specimens[J]. Prostate,2014,74(6):680
[17]Aydin H,Zhang J,Samaratunga H,et al.Ductal adenocarcinoma of the prostate diagnosed on transurethral biopsy or resection is not always indicative of aggressive disease:implications for clinical management[J].BJU Int,2010,105(4):476.
[18]Tu S M,Lopez A,Leibovici D,et al.Ductal adenocarcinoma of the prostate:clinical features and implications after local therapy[J]. Cancer,2009,115(13):2872
[19]Samaratunga H,Duffy D,Yaxley J,et al.Any proportion of ductal adenocarcinoma in radicalprostatectomy specimens predicts extraprostatic extension[J].Hum Pathol,2010,41(2):281
(2015-08-24收稿)
R737.25
A
1006-8147(2016)02-0150-04
天津市科技计划项目基金资助(11ZCGYSY02300)
李鹏昊(1988-),男,硕士在读,研究方向:泌尿外科;通信作者:张志宏,E-mail:zhihongzhang1967@163.com。
