新型含吡啶基吡唑酰胺类化合物的合成与抗肿瘤活性
2016-05-18蔡文玺王润玲董卫莉刘艾林
蔡文玺,王润玲,董卫莉,刘艾林
(1.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070;2.中国医学科学院药物研究所,国家药物筛选中心,北京 100050)
论著
新型含吡啶基吡唑酰胺类化合物的合成与抗肿瘤活性
蔡文玺1,王润玲1,董卫莉1,刘艾林2
(1.天津医科大学药学院,天津市临床药物关键技术重点实验室,天津300070;2.中国医学科学院药物研究所,国家药物筛选中心,北京 100050)
目的:设计合成一系列新型的含吡啶基吡唑酰胺类化合物,并测试其生物活性。方法:以取代氨基苯甲酸和吡唑羧酸为起始原料,设计并合成了含吡啶基吡唑酰胺类化合物,测试化合物4a~4d对人肺癌A-549,人肝癌Bel7402和人肠癌HCT-8细胞的体外抗肿瘤活性。结果:合成了4个结构全新的含吡啶基吡唑酰胺类化合物,其结构通过1H NMR、红外光谱和元素分析进行了表征。体外抗肿瘤活性实验研究表明,化合物4d对Bel7402细胞株在浓度为5 μg/mL时有较好的抑制活性,其他化合物也表现出一定的抑制活性。结论:化合物4d显示了较好的抑癌作用,值得进一步研究。
吡唑酰胺类;合成;抗肿瘤活性
吡唑类化合物是一类应用广泛的五元含氮杂环化合物,吡唑环上的取代位点可以连接不同的取代基从而开发出更多具有抗癌、抗炎、抗菌及杀虫等生物活性的吡唑类衍生物[1-4]。活性高、毒性小和配位能力较高等优点使该类化合物的使用越来越广泛,被更多的应用到药物的研发和生产中。含吡唑杂环酰胺类化合物因其作用机制新颖、环境友好,在医药、农药等领域备受关注[5-8]。Cankara Pirol[9]等合成了一系列含喹啉基的吡唑酰胺类化合物,并发现它们对人肝癌、乳腺癌和结肠癌细胞有很好的抑制活性。研究发现,在分子中引入两个杂环活性中心,通过不同药效基团的协同作用,能产生更好的生物、生理活性,从而有利于获得应用价值更高的化合物。本文以取代氨基苯甲酸和吡唑羧酸为起始原料,通过脲桥将苯甲酰胺结构和含有吡啶、吡唑双杂环结构连接起来,设计并合成了4个1-(3-氯吡啶-2-基)-N-苯氨基甲酰基-1H吡唑-5-酰胺类化合物(4a~4d),其结构经1H NMR,红外光谱和元素分析表征,期望从中筛选出具有抗癌等生物活性的新型化合物。
1 材料与方法
1.1 仪器与试剂 X-4型数字显示显微熔点测定仪(北京泰克仪器有限公司);Bruker AVANCE-300MHz和Varian Mercury Vx 400 MHz核磁共振仪(DMSO-d6为溶剂,TMS为内标);Yanaco CHN CORDER MT-3型元素分析仪,ZF-I型三用紫外分析仪。实验所用试剂均为分析纯或化学纯。
1.2 化合物的合成 目标化合物的合成路线见图1。
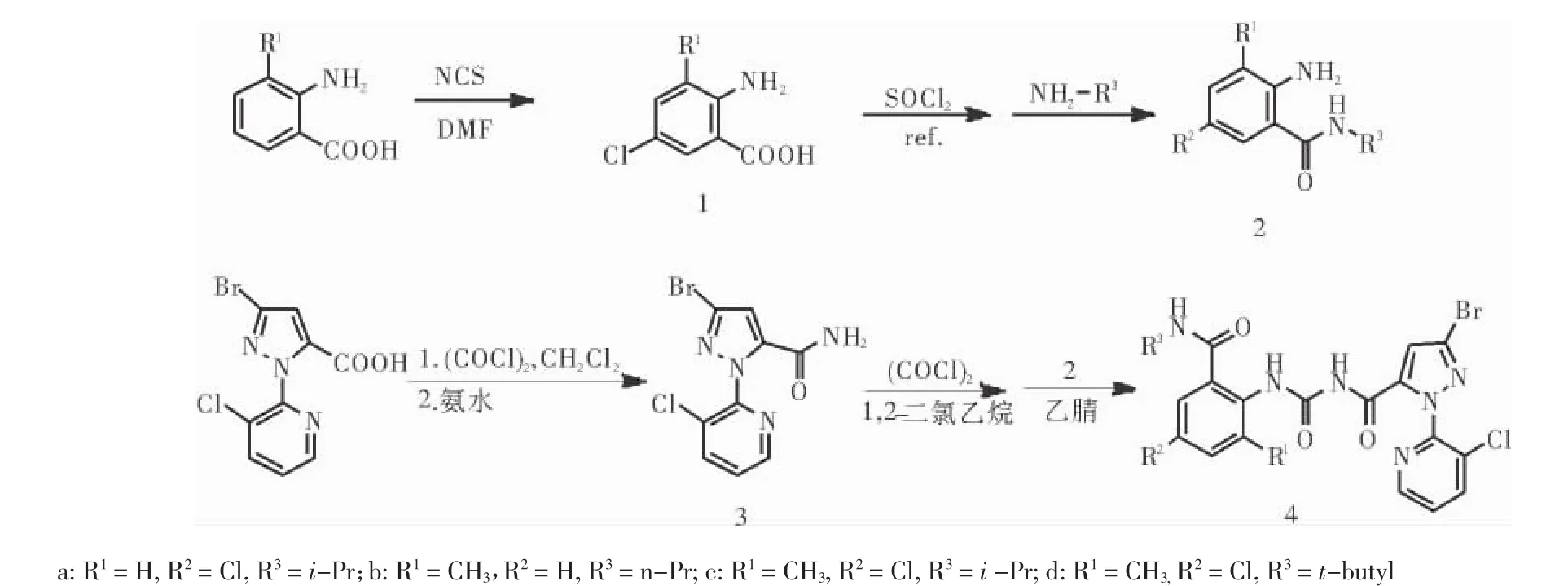
图1 目标化合物的合成路线Fig 1 Synthetic route of the title compounds
1.2.1 中间体1的合成 将取代氨基苯甲酸(10mmol)溶于DMF(20 mL)中,加热至60℃,分批加入NCS(11 mmol),加热回流30 min。减压蒸馏脱去大部分溶剂,加入20 mL水,冰水浴下充分搅拌1 h,抽滤,蒸馏水洗涤得中间体1。
1.2.2 中间体2的合成 将化合物1(1 mmol)加入到15 mL SOCl2中,70℃下回流1 h,冷却至室温后减压蒸馏,除去多余的SOCl2。将得到的残液溶于10 mL甲苯,0℃下,将其缓慢加入到烷基胺(1 mmol)的甲苯溶液(15 mL)中,0℃下搅拌4 h。反应完成后,将反应液倒入冰水(40 mL)中,用甲苯(20 mL×3)萃取。将有机相用水(40 mL)洗涤两次,NaSO4干燥,抽滤后,用硅胶柱层析纯化得到中间体2。
1.2.3 中间体3的合成 把草酰氯(10 mmol)滴入吡啶基吡唑羧酸(5 mmol)和二氯甲烷(50 mL)的混悬液中,然后加入两滴DMF,室温反应12 h,减压蒸馏得到酰氯粗品。把酰氯粗品溶于10 mL THF中,在冰盐冷却下,慢慢滴加到5倍量的氨水和100 mL水的混合物中,有大量白色固体生成,在冰水冷却下搅拌30 min,抽滤得到中间体3。
1.2.4 目标化合物4的合成[11]向50 mL圆底烧瓶中加入中间体3(1.5 g,5 mmol),30 mL 1,2-二氯乙烷,搅拌均匀后,加入草酰氯(1.3 g,10 mmol),回流12 h,减压脱去过量的草酰氯及溶剂得中间体异氰酸酯的粗品。把上述粗品溶于10 mL乙腈中,在室温下滴加到取代邻氨基苯甲酰胺2(5 mmol)的乙腈(30 mL)溶液中,室温搅拌反应12 h,有大量白色固体析出,抽滤得固体,用乙醇洗涤固体或重结晶得到目标产物4的纯品。
1.3 目标化合物的抗肿瘤活性初步测试[11]选用对数生长期的贴壁A549、Bel7402和HCT-8 3种肿瘤细胞,分别用胰酶消化后,用10%小牛血清的RPMI1640培养液配成15 000个/mL的细胞悬液,接种在96孔培养板中,每孔接种190 μL,37℃,5% CO2培养24 h。实验组加样品10 μL,每孔终体积为200μL,用1640培养液补足。37℃,5%CO2培养3d。弃上清液,每孔加入100 μL新鲜配制的0.5 mg/mL MTT的无血清培养液,37℃继续培养4 h。小心弃上清,并加入150 μL DMSO溶解MTT formazon沉淀,用微型振荡器混匀,在酶标仪上测定波长544 nm处的光密度值。用下面公式计算化合物对细胞生长的抑制率,实验平行3次。
抑制率=(阴性对照OD值-加药组OD值)/(阴性对照组OD值-空白对照组OD值)×100%
2 结果
2.1 化合物的表征数据
2.1.1 中间体化合物的表征数据
1:白色固体,产率92.1%,m.p.226~228。
2a:白色固体,产率58.0%,m.p.161~162℃;1H NMR(CDCl3,300 MHz)δ:1.25[d,6H,J=6.6 Hz,CH (CH3)2],4.16-4.28[m,1H,CH(CH3)2],5.48(br,1H,NH2), 5.78(br,1H,NH),6.60-7.24(m,3H,Ar-H)。
2b:白色固体,产率88.0%,m.p.119~123℃;1H NMR(CDCl3,400 MHz)δ:0.99(t,3H,J=7.6 Hz, CH2CH3),1.64(q,2H,J=7.2 Hz,CH2CH3),2.25(s,3H, CH3),3.35-3.40(m,2H,NHCH2),6.17(br,1H,NH), 7.15(d,1H,J=1.6 Hz,Ar-H),7.22(d,1H,J=2.4 Hz, Ar-H)。
2c:白色固体,产率89.0%,m.p.161~162℃;1H NMR (CDCl3,400 MHz)δ:1.25 (d,6H,J=6.4 Hz, CH3),2.14(s,3H,CH3),4.15-4.26(m,1H,CH),5.52 (br,2H,NH2),5.78(br,1H,NH),7.10-7.17(m,2H, Ar-H)。
2d:白色固体,产率95.0%,m.p.89~90℃;1H NMR(CDCl3,400 MHz)δ:1.45(s,9H,CH3),2.13(s,3H, CH3),5.46(br,2H,NH2),5.79(br,1H,NH),7.07-7.12 (m,3H,Ar-H)。
3:白色固体,产率84.2%,m.p.200~202℃;1H NMR(CDCl3,400 MHz)δ:5.52(br,1H,NH2),6.01(br, 1H,NH2),6.71(s,1H,pyrazolyl-H),7.36(dd,1H,J= 4.8,8.0 Hz,pyridyl-H),7.83 (d,1H,J=8.0 Hz, pyridyl-H),8.41(d,1H,J=4.4 Hz,pyridyl-H)。
2.1.2 目标产物的表征
4a:白色固体,产率83.6%,m.p.204~206℃;1H NMR(DMSO,400 MHz)δ:1.03[d,6H,J=6.4 Hz,CH (CH3)2],3.80-3.88[m,1H,CH(CH3)2],7.51-7.52(m,2H, Ar-H),7.60(s,1H,pyrazolyl-H),7.68(dd,1H,J=4.8, 8.0Hz,pyridyl-H),8.13(d,1H,J=9.6 Hz,Ar-H),8.25 (d,1H,J=8.0 Hz,pyridyl-H),8.46(d,1H,J=8.0 Hz, NHCH),8.54(d,1H,J=4.8 Hz,pyridyl-H),11.06(br, 1H,CONHCO),11.41(br,1H,NHCO).Anal.Calcd for C20H17BrCl2N6O3:C 44.47,H 3.17,N 15.56;found C 44.43,H 3.28,N 15.21。
4b:白色固体,产率86.4%,m.p.186~189℃;1H NMR (DMSO,400 MHz)δ:0.81 (t,3H,J=7.6 Hz, CH2CH3),1.39(q,2H,J=7.2 Hz,CH2CH3),2.16(s,3H, CH3),3.02-3.07(m,2H,NHCH2),7.28(d,1H,J=2.4Hz, Ar-H),7.45(d,1H,J=2.0 Hz,Ar-H),7.64(s,1H, pyrazolyl-H),7.69(dd,1H,J=4.8,8.0Hz,pyridyl-H), 8.27(d,1H,J=8.0 Hz,pyridyl-H),8.34(t,1H,J=4.8 Hz,NHCH2),8.56(d,1H,J=4.4 Hz,pyridyl-H),9.82 (br,1H,CONHCO),11.39(br,1H,NHCO).Anal.Calcd for C21H19BrCl2N6O3:C 45.51,H 3.46,N 15.16;found C 45.73,H 3.24,N 15.37。
4c:白色固体,产率82.3%,m.p.202~203℃;1H NMR(DMSO,400 MHz)δ:1.01[d,6H,J=6.4 Hz,CH (CH3)2],2.16(s,3H,CH3),3.82-3.91[m,1H,CH(CH3)2], 7.25(s,1H,Ar-H),7.43(s,1H,Ar-H),7.65(s,1H, pyrazolyl-H),7.69(dd,1H,J=4.8,8.0Hz,pyridyl-H), 8.15(d,1H,J=7.6 Hz,NHCH),8.26(d,1H,J=8.0 Hz, pyridyl-H),8.55(d,1H,J=4.4 Hz,pyridyl-H),9.77 (br,1H,CONHCO),11.41(br,1H,NHCO).Anal.Calcd for C21H19BrCl2N6O3:C 45.51,H 3.46,N 15.16;C 45.63, H 3.12,N 14.86。
4d:白色固体,产率79.5%,m.p.187~189℃;1H NMR(DMSO,400 MHz)δ:1.19[s,9H,C(CH3)3],2.15 (s,3H,CH3),7.18(d,1H,J=2.0 Hz,Ar-H),7.39(d, 1H,J=2.0 Hz,Ar-H),7.67(s,1H,pyrazolyl-H),7.69 (dd,1H,J=4.8,8.0 Hz,pyridyl-H),7.82[s,1H,NHC (CH3)3],8.25(d,1H,J=8.0 Hz,pyridyl-H),8.54(d,1H, J=4.8Hz,pyridyl-H),9.73(br,1H,CONHCO),11.43 (b r,1H,NH CO).Anal.Calcd for C22H21BrCl2N6O3:C 46.50,H3.72,N14.79;found C 46.39,H 3.47,N 14.98。
2.2 目标化合物的抗癌活性 对目标化合物4a~4d进行了体外抗癌活性的初步筛选,结果见表1。
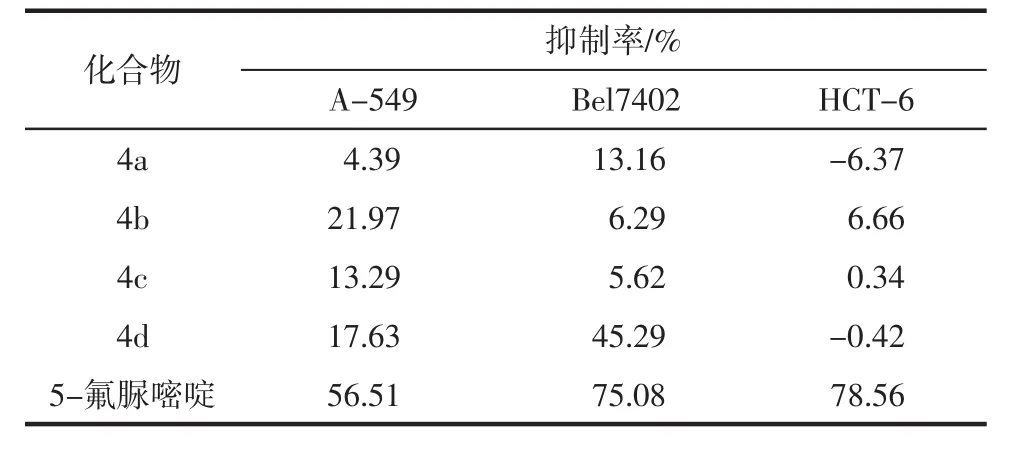
表1 化合物4a~4d对A-549、Bel7402和HCT-6癌细胞的抑制率Tab 1 Inhibition rates of compounds 4a~4d against A-549、Bel7402 and HCT-6 cell lines
3 讨论
3.1 化合物的合成 杂环酰胺3在草酰氯的作用下生成中间体异氰酸酯,不用分离直接进行下一步反应即可。中间体异氰酸酯和中间体2的反应采用乙腈为溶剂,得到的白色固体能从溶剂中析出来,直接抽滤就能得到目标化合物4,可用乙醇洗涤固体或者重结晶就能得到纯的产品。
3.2 化合物的1H NMR表征 以化合物4c为例说明。7.65(s,1H,pyrazolyl-H)是吡唑环上的CH峰;吡啶环上的三个氢的化学位移:7.69 ppm处是pyridyl-H5的峰,由于受邻位pyridyl-H4及pyridyl-H6的耦合而裂分成dd峰,耦合常数分别为8.0 Hz和4.8 Hz,8.26 ppm处是pyridyl-H4的峰,由于受邻位pyridyl-H5的耦合而裂分成d峰,耦合常数为8.0 Hz,8.55 ppm处是pyridyl-H6的峰,由于受邻位pyridyl-H5的耦合而裂分成d峰,耦合常数为4.4 Hz;8.15 ppm处是脂肪酰胺的NH峰,9.77 ppm处是脲桥中杂环酰胺的NH峰,11.41 ppm处是脲桥中苯甲酰胺的NH峰。
3.3 化合物的红外光谱表征 以化合物4c为例说明。3422 cm-1,3317 cm-1,3208 cm-1处分别是脲桥中苯甲酰胺、脲桥中杂环酰胺和脂肪酰胺的氮氢伸缩振动吸收峰;2972 cm-1处是烷烃的饱和C-H的吸收峰,1 696 cm-1,1 652 cm-1和1 577 cm-1分别是酰胺羰基的伸缩振动吸收峰,1 341~1 541 cm-1之间是苯环上的碳碳双键的伸缩振动吸收峰。
3.4 目标化合物的抗癌活性及构效关系分析 从表1数据可知,在5 μg/mL浓度下,所合成化合物4d对人肝癌细胞Bel7402有较高的抑制作用,其它化合物的抗癌活性也对于3种癌细胞有着不同程度的抑制作用,提示引入叔丁基可提高其生物活性。由上述结果可以看出,该系列化合物显示出一定的抗癌活性,其构效关系正在进一步的研究中。
[1] Tian A X,Ning Y L,Ying J,et al.Three multi-nuclear clusters and one infinite chain induced by a pendant 4-butyl-1H-pyrazole ligand for modification of Keggin anions[J].Dalton T,2015,44(1):386
[2] Wang T,Banerjee D,Bohnert T,et al.Discovery of novel pyrazolecontaining benzamides as potent RORgamma inverse agonists[J]. Bioorg Med Chem Lett,2015,25(15):2985
[3] Ahsan N,Mishra S,Jain M K,et al.Curcumin pyrazole and its derivative(N-(3-nitrophenylpyrazole)curcumin inhibit aggregation, disrupt fibrils and modulate toxicity of Wild type and Mutant alpha-Synuclein[J].Sci Rep,2015,5:9862
[4] Chae E,Shin Y J,Ryu E J,et al.Discovery of biological evaluation of pyrazole/imidazole amides as mGlu5 receptor negative allosteric modulators[J].Bioorg Med Chem Lett,2013,23(7):2134
[5] Du S,Tian Z,Yang D,et al.Synthesis,antifungalf Activity and structure-activity relationships of novel 3-(difluoromethyl)-1-methyl-1H-pyrazole-4-carboxylic acid amides[J].Molecules,2015, 20(5):8395
[6] Wu J,Song B A,Hu DY,et al.Design,synthesis and insecticidal activities of novel pyrazole amides containing hydrazone substructures[J].PEST MANAG SCI,2012,68(5):801
[7] Xiong L,Zhu X L,Shen Y Q,et al.Discovery of N-benzoxazol-5-yl-pyrazole-4-carboxamides as nanomolar SQR inhibitors[J].Eur J Med Chem,2015,95:424
[8] Oliveira S,Pizzuti L,Quina F,et al.Anti-Candida,anti-enzyme activity and cytotoxicity of 3,5-diaryl-4,5-dihydro-1H-pyrazole-1-carboximidamides[J].Molecules,2014,19(5):5806
[9] Cankara Pirol S,Caliskan B,Durmaz I,et al.Synthesis and preliminary mechanistic evaluation of 5-(p-tolyl)-1-(quinolin-2-yl)pyrazole-3-carboxylic acid amides with potent antiproliferative activityonhumancancercelllines[J].EurJMedChem,2014,87:140 [10]Wang S,Allan R D,Skerritt J H,et al.Development of a classspecific competitive ELISA for the benzoylphenylurea insecticides [J].J Agric Food Chem,1998,46,3330
[11]孙强稳,王杰,方唯硕,等.新型酰胺类鬼臼毒素衍生物的合成及体外抗肿瘤活性[J].天津医科大学学报,2015,21(4):282
(2015-11-05收稿)
医学论文中被误用为单位符号的“ppm、ppb、ppt”英文缩写的换算
在医学论文中,“ppm、ppb、ppt”这类英文缩写常常被作者作为单位符号使用,而“ppm、ppb、ppt”不是量纲一的量的单位的专门名称,也不是数学符号,更不是单位符号,只是表示数量份额的英文名词缩写(英文全称分别为parts per million、parts per billion、parts per trillion)。在实际研究中,仪器测量的数值可能会以“ppm、ppb、ppt”形式给出结果,作者在撰写文章进行数据描述时则需对“ppm、ppb、ppt”进行换算。
对溶液而言,换算前需了解体积比还是质量比。1 μg/mL是质量-体积比,如果溶液的密度是1 g/mL,则1 μg/mL相当于1 ppm;如果溶液密度不是1 g/mL,则需要进行换算。
对大气中的污染物而言,常用体积浓度和质量-体积浓度来表示其在大气中的含量。体积浓度是用每立方米大气中含有污染物的体积数来表示(如cm3/m3、mL/m3),换算关系是:1 ppm=1 cm3/m3=10-6,1 ppb=10-9,1 ppt=10-12;质量-体积浓度是用每立方米大气中污染物的质量数来表示(如mg/m3、g/m3),换算关系是:C= 22.4X/M,式中:X为污染物以mg/m3表示的浓度值;C为污染物以ppm表示的浓度值;M为污染物的分子质量。
在土壤、动植物、固体废弃物中“ppm、ppb、ppt”与质量含量的换算关系为:1 ppm=1 mg/kg=1 000 μg/kg;1 ppb=1 μg/kg=10-3mg/kg;1 ppt=1 ng/kg=10-6mg/kg。
本刊编辑部
Synthesis and biological activity of novel amides containing 1-(pyridin-2-yl)pyrazole derivatives
CAI Wen-xi1,WANG Run-ling1,DONG Wei-li1,LIU Ai-lin2
(1.School of Pharmacy,Tianjin Medical University,Tianjin Key Laboratory on Technologies Enabling Development of Clinical Therapeutics and Diagnostics,Tianjin 300070,China;2.Institute of Materia Medica,Chinese Academy of Medical Sciences,National Center for Pharmceuticalscreening,Beijing 100050,China)
Objective:To design and synthesize a series of novel amides containing 1-(pyridin-2-yl)pyrazole derivatives,and to evaluate their biological activities in vitro.Methods:A series of amides containing 1-(pyridin-2-yl)pyrazole derivatives were synthesized using substituted aminobenzoic acid and pyrazole carboxylic acid as starting materials and the biological activity of the title compounds 4a~4d were tested against A-549,Bel7402 and HCT-8 cell lines.Results:Four new types of amides containing 1-(pyridin-2-yl)pyrazole derivatives were synthesized and characterized by1H NMR,IR and Elemental Analysis.The preliminary results indicated that the compound 4d showed inhibiting effects on Bel7402 cell line in vitro at the concentration of 5 μg/mL,while showing no notable inhibiting activity against other cell 1ines.Conclusion:Compound 4d may have anticancer activity,and is worth further studying.
amides containing 1-(pyridin-2-yl)pyrazole;synthesis;anticancer activity
R9
A
1006-8147(2016)02-0115-04
国家自然科学基金青年基金资助项目(21102103),中国博士后科学基金特别资助项目(2014T70222),中国博士后科学基金面上项目(2011M500532)
蔡文玺(1989-),男,硕士在读,研究方向:药物化学;通信作者:董卫莉,E-mail:dongweili@tijmu.edu.cn;刘艾林,E-mail: liuailin@imm.ac.cn。
