长江口滨海湿地原生海三棱藨草种群恢复的实验研究
2016-05-17胡忠健马强曹浩冰张秩通汤臣栋张利权葛振鸣
胡忠健, 马强, 曹浩冰, 张秩通, 汤臣栋, 张利权, 葛振鸣,*
长江口滨海湿地原生海三棱藨草种群恢复的实验研究
胡忠健1,†, 马强2,†, 曹浩冰1, 张秩通2, 汤臣栋2, 张利权1, 葛振鸣1,*
1. 华东师范大学河口海岸学国家重点实验室, 上海 200062
2. 崇明东滩鸟类自然保护区, 上海 202183
我国滨海湿地外来物种入侵威胁较为严重。以长江口湿地为例, 快速蔓延的互花米草(Spatina alterniflora)逐渐替代了中国特有的原生种—海三棱藨草(Scirpus mariqueterTs. Tang & F.T. Wang)。基于正在实施的外来入侵种生态控制工程, 开展了海三棱藨草在新生湿地的种群恢复实验。实验采用两种恢复策略, 即建立种子库和植物球茎(地下繁殖体)种植, 并实施了低、中、高密度种植处理以比较其成本效益。研究结果表明, 海三棱藨草种子在实验室条件下有较高的出苗率, 且5 cm的种植深度最佳。但由于潮滩湿地泥沙淤积的掩埋胁迫, 在5 cm的种植深度下, 即使采用高密度种植处理也仅有极少数种子能萌发生成植株, 且不同种植密度处理间的幼苗存活率和植株密度没有显著差异。而将海三棱藨草球茎作为植被恢复的种植材料时, 其出苗率和植株密度远优于种子种植策略, 多数球茎能实现出苗和定居, 并通过地下分蘖和地下根茎发育迅速形成密集的种群。密度处理结果表明, 中密度和高密度种植处理下的生长季后期的植株密度没有显著差异, 说明在滨海湿地原生植物种群重建时宜选择经济高效的中密度种植策略。据此可为大规模的长江口原生植被恢复工程提供参考。
滨海湿地; 原生植物; 生态恢复; 地下繁殖体; 种子库
1 引言
滨海湿地具有丰富的生态系统服务功能, 包括生物多样性保育、调节气候、净化水质和提供人类所需的产品资源等[1]。但滨海湿地也极易受到人类活动和生物入侵的危害, 后者可能引发湿地结构改变、生境退化和生物多样性锐减等生态风险[2–4]。因此, 湿地的保护与恢复问题已经成为当今恢复生态学研究的主要内容[5]。在许多生物入侵治理案例中,原生种群的生态恢复都是一项重要的研究课题[6–8]。
长江口滨海湿地位于亚太候鸟迁徙路线东线中段, 其中崇明东滩湿地于2001年正式列入“拉姆萨国际湿地公约”, 是国际迁徙鸟类的重要栖息地, 也是中国濒海湿地生物多样性的关键地区[9]。海三棱藨草(Scirpus mariqueter Ts. Tang & F.T. Wang)作为中国特有种[10], 主要分布于江苏、上海和浙江等省市的海岸带区域, 是整个长江口滨海湿地的先锋种和建群种, 是湿地水鸟最重要的栖息地和觅食地[11–13]。自20世纪90年代后期, 围垦引种的互花米草(Spatina alterniflora)在长江口滨海湿地快速蔓延, 对海三棱藨草生境造成极大的威胁, 近年来海三棱藨草分布面积急剧减少[14–16]。因此, 上海市政府启动了“崇明东滩湿地互花米草生态控制与鸟类栖息地优化工程”, 该工程对崇明东滩湿地互花米草进行了圈围处理, 阻断了互花米草进一步扩散的途径。自2013年后, 由于上游来沙的持续淤积,工程区域以外形成了大面积的新生滩涂湿地, 这为海三棱藨草种群的重建和恢复提供了良好条件。
目前, 国内外研究大多认为种子播种(建立种子库)是一种理想的自然恢复途径, 对植被恢复有着极其重要的作用[6,17–20]。然而, 环境因子的剧烈干扰会影响种子库的组成、数量以及出芽率, 并直接制约植被恢复的成功率[21]。因此, 环境因子干扰对植被恢复策略的制定具有指导性作用。尤其在滨海湿地这一海陆交界的生态过渡带, 水文(潮汐)和泥沙(淤积)作用较为剧烈, 对海三棱藨草种群的重建和恢复提出了严峻挑战。另一方面, 研究发现长江口滨海湿地植被具有较发达的地下繁殖体(根茎、球茎等)[22–23], 地下繁殖体系统的生长和扩增是植物种群定居和扩散的主要途径。本研究采用两种植被恢复策略, 即建立不同密度的种子库和植物球茎(地下繁殖体)种植方式, 通过对比研究, 提出适宜滨海湿地区域特征的海三棱藨草种群恢复的可行方案, 为海岸带区域原生植物和湿地生境恢复工程提供科学依据。
2 材料与方法
2.1研究区概况
崇明东滩湿地(31°25′—31°38′N, 121°50′—122°05′E)位于长江河口处的上海崇明岛东端, 地势低平, 属亚热带海洋性气候, 四季分明, 平均日照时数2138 h, 年均气温15.3 °C, 全年平均无霜期为320 d左右, 年均降雨量1022 mm, 受非正规半日潮作用, 每日潮汐有昼夜两次变化, 平均潮差为2.66 m。崇明东滩湿地属于典型的淤涨型潮滩, 长江携带的大量泥沙促使东滩湿地处于不断淤涨之中[24–26]。海三棱藨草种群恢复实验地位于“崇明东滩湿地互花米草生态控制与鸟类栖息地优化工程”南侧围堤外新生湿地(见图1)。
2.2海三棱藨草种子采集与室内萌发实验
本研究在2014年10—12月(海三棱藨草结籽期),于崇明东滩湿地现存的海三棱藨草生境采集种子约100公斤, 挑选成熟饱满的种子清洗干净, 以1︰2的体积比与细沙均匀搅拌, 置于4 ℃的人工气候箱中保存、备用。本研究于2015年1月开展室内预实验以检测所采集种子的质量。将潮滩土壤(采自崇明东滩湿地)装入直径10 cm、高25 cm的无口圆柱塑料瓶中, 将50粒海三棱藨草种子均匀播种其中, 覆土后制成种植深度分别为0 cm、5 cm、10 cm、15 cm和20 cm的处理, 各组设置5个重复。实验材料置于植物培养箱28 ℃内恒温培养, 实验期间每天浇灌水分。连续培养1个月, 记录出土的幼苗数量以获得不同种植深度的出苗率, 计算公式为:
出苗率(%) =n / N×100%
式中: n为萌发出土的幼苗株数, N为种子数。
2.3海三棱藨草种子野外种植实验
本研究于2015年3—4月开展海三棱藨草种子野外种植实验, 在互花米草控制工程南侧堤外设置了不同种子种植密度。由于海三棱藨草种子小而轻,千粒重仅约为5 g, 因此种子种植密度设置为高密度(4000 ind·m–2)、中密度(2000 ind·m–2)、低密度(1000 ind·m–2)3个处理, 掩埋深度均为5 cm(根据室内萌发实验效果, 见结果3.1部分), 每个密度种植200 m2(见表1)。
2.4海三棱藨草球茎采集与野外种植实验
2014年3—4月, 于崇明东滩湿地现存的海三棱藨草生境采集海三棱藨草球茎(带土球茎微系统, Microcosm)。采样工具为自制不锈钢柱状采样器, 直径为7.5 cm, 采集深度为15 cm。随机选取20个带土球茎微系统, 在实验室使用0.2 mm孔径筛洗出球茎, 所采集的微系统平均含有15个活体球茎。所采集的带土球茎微系统装于转运箱后运往实验地点(互花米草控制工程南侧堤外)进行种植。设置3个球茎种植密度处理(低密度—15 ind·m–2, 中密度—30 ind·m–2, 高密度—60 ind·m–2), 每个密度种植400 m2(见表1)。在种植过程中将带土球茎微系统掩埋至滩面地下5 cm深度, 覆土与滩面齐平。
为避免海三棱藨草种子和球茎种植实验之间的相互干扰, 两处实验区域相隔距离约为100 m。
2.5海三棱藨草出苗率与植株密度测定
本研究在种植实验后展开每月上旬和下旬(4—10月)的跟踪监测。在每个实验样方内, 随机选取10个2 m×2 m的小样方, 分别测量出苗率(幼苗存活率)和植株密度。其中出苗率能够反映植物繁殖体(种子或球茎)成功萌发和存活的概率, 所有样方中幼苗萌发的数量除以总样方数量即得出苗率。植株密度通过测量每个小样方内的所有植株数量(包括分蘖)获得。
2.6潮滩泥沙沉积动态测定
每月上旬和下旬(4—10月)跟踪监测实验样地的沉积动态过程(包括淤积和冲蚀)。监测通过设置在潮滩上标记物的高度变化来推算, 即标记桩法[25]。本研究在种植样方旁边约5 m处设置两条相距5 m的平行横带, 每条横带包括8根间距为5 m的垂直于地面的木杆, 其中每根长度为1.5 m的木杆都有0.6 m的部分暴露在滩面以上。将滩面的初始高程设为0 m以作为高程零点, 再通过定期测量每根木杆暴露在滩面以上部分的高度并取平均值, 与上次测量的平均高度作比较, 即可推算出该实验样地的冲淤动态变化。
2.7数据处理与分析
本研究采用Microsoft Execl 2007和SPSS 19.0统计学软件进行数据处理并制图。通过单因素方差分析法(one−way ANOVA, 被检数据为正态分布)和非参数Kruskal−Wallis检验法(被检数据为非正态分布), 检测实验样地中不同种植密度处理对海三棱藨草出苗率和植株密度影响差异的显著性(P<0.05)。图表中的数值结果形式均为平均值±标准误。

图1 长江口崇明东滩湿地和海三棱藨草种群恢复实验地点Fig. 1 Location of the Chongming Dongtan wetland and the study area of S. mariqueter revegetation in the Yangtze Estuary
3 结果
3.1海三棱藨草种子质量与最佳种植深度
通过30天的海三棱藨草种子萌发实验发现, 海三棱藨草结籽期所收集的种子具有较好的活性。在不同种植深度上的出苗率有显著(P<0.05)的差异(见图2), 其中0 cm深度(即土壤表层)的种子出苗率约为36.8%, 5 cm深度的种子出苗率最高, 达到约66.8%, 显著(P<0.05)高于其它种植深度。随种植深度加深, 种子出苗率显著下降。10 cm、15 cm和20 cm深度的种子出苗率分别约为11.6%、9.2%和2.4%。20 cm的种植深度可能是海三棱藨草种子耐受掩埋胁迫并实现出苗的最低阈值, 而5 cm的种植深度是种子种植的最佳深度。

表1 海三棱藨草种子萌发、野外种子和球茎种植实验设置Tab. 1 Layout of the germination (in the laboratory) and revegetation experiment (in the field) with the seeds and corms of S. mariqueter

图2 不同种植深度的海三棱藨草种子出苗率Fig. 2 Rate of seedling emergency rate of S. mariqueter under different treatments of initial planting density
3.2海三棱藨草种子野外种植效果
根据实验室萌发结果, 在野外潮滩湿地将海三棱藨草种子种植于5 cm的深度, 但其出苗率极低。在6月初高密度种植处理和中密度种植处理下的种子出苗率分别仅约为0.3%和0.2%, 而低密度种植处理的种子则没有萌发。直至8月末, 高密度种植处理和中密度种植处理的种子出苗率仅达到约1.1%和1.0%, 而低密度种植处理的种子出苗率仅约为0.6%。低出苗率直接导致了较低的植株生长密度。直至8月末, 高、中、低3种密度种植处理下的植株密度分别约为0.50 ind·m–2、0.20 ind·m–2和0.06 ind·m–2。
选取海三棱藨草生长季的早期(5月初)、中期(6月末)和晚期(8月末)3个代表性时段, 通过非参数Kruskal−Wallis检验法分析实验样地中不同种子种植密度处理对海三棱藨草群落恢复效果的影响(见表2)。结果发现, 各生长阶段不同种植密度处理下的出苗率和植株密度均无显著差异。

表2 不同密度海三棱藨草种子种植后出苗率和植株密度的差异性检验Tab. 2 Statistical analysis for the difference of seedling emergency rate and shoot density of S. mariqueter under different treatments of initial planting density, by using the seed-planting approach
3.3海三棱藨草球茎野外种植效果
通过球茎野外种植实验发现, 幼苗成活率显著高于种子种植策略(见图3)。高密度种植的海三棱藨草幼苗存活率最高, 在5—6月间约为40.0%, 在6月初达到最大值, 约为42.0%, 随后略有下降并维持在28.5%—35.0%。中密度种植和低密度种植的幼苗存活率在5月初达到最大值, 继而略有下降, 至6月下旬, 稳定在16.5%—25.0%。在海三棱藨草幼苗定居的早期, 即从4月末到5月初, 3个种植密度处理下的海三棱藨草的植株密度在适应陌生生境的过程(演替早期)中均有减少的现象, 从5月开始球茎通过营养分蘖和地下根茎生长形成初步定居的草丛, 而植株密度也呈快速增高趋势。高密度种植和中密度种植处理下的植株密度显著(P<0.05)高于低密度种植处理。自8月末进入秋季后, 植株密度随着植物自然衰老和潮水冲刷的加强而呈下降趋势。

图3 不同密度球茎种植后的出苗率(a)和植株密度(b)Fig. 3 Measurements of the seedling emergency rate (a) and shoot density (b) of S. mariqueter under different treatments of initial planting density, by using the cormplanting approach
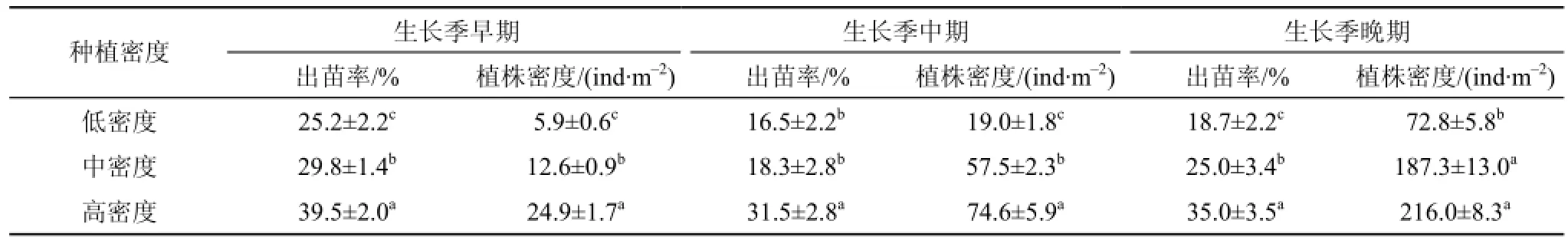
表3 不同密度海三棱藨草球茎种植后出苗率和植株生长密度的差异性检验Tab. 3 Statistical analysis for the difference of seedling emergency rate and shoot density of S. mariqueter under different treatments of initial planting density, by using the corm-planting approach
选取海三棱藨草生长季的早期(5月初)、中期(6月末)和晚期(8月末)3个代表性时段来分析实验样地中不同球茎种植密度处理对海三棱藨草种群恢复效果影响的差异(见表3)。结果发现, 3个生长阶段高密度种植处理下的出苗率显著(P<0.05)高于中密度种植和低密度种植处理。生长季早期的低密度种植处理下的植株密度显著(P<0.05)低于高密度种植和中密度种植处理。生长季晚期中密度种植处理和高密度种植处理下的植株密度没有显著差异。
3.4潮滩沉积动态
海三棱藨草种群恢复实验区域的滩面泥沙沉积动态监测结果表明(见图4), 2015年4月—8月滩面泥沙始终处于淤积状态, 抬升的相对高程为0.90—5.16 cm, 8月下旬的绝对高程累积抬升约19.05 cm。10月的滩面开始出现小幅的冲刷状态。整个海三棱藨草生长季均处于滩面持续抬高的泥沙淤积期。
4 讨论
本研究的主旨是探究适合滨海湿地原生植被恢复的有效方法。在不同生境中, 大多数植被修复工程采取建立种子库或将种子混合泥浆后喷播等方式[6,19–20]。然而滨海湿地植物的存活、定居和生长主要是由植物生理特征与非生物因子相互作用决定的, 潮滩上显著的潮汐冲刷作用和泥沙沉积作用往往对植被恢复产生决定性的影响[27–28]。
本研究首先通过建立海三棱藨草种子库的方式进行植被恢复。所采集的种子在实验室条件下有较高的出苗率, 且5 cm种植深度的种子出苗率最高。在滨海湿地野外种植实验中, 只有极少数的种子能萌发生成植株。即使采用4000粒·m–2的高种植密度,也仅有1.1%的出苗率和0.5 ind·m–2的植株密度, 且3种种植密度处理间的出苗率和植株密度没有显著差异(P<0.05)。因此, 幼苗数量和密度过少的植物种群较难在生境复杂的潮滩前沿定居和发展。对潮滩泥沙沉积动态的监测显示, 在海三棱藨草生长季,潮滩高程累积抬升超过15 cm, 高强度的泥沙淤积对种子的出苗影响较大。从室内实验结果也可以发现, 自5 cm掩埋深度以下, 种子出苗率随掩埋深度加深而显著下降。植物生理学研究显示, 土壤掩埋深度能决定植物的形态、耐受胁迫能力和器官生长[29]。Schwarz等的研究也发现种子可能不是自然条件下海三棱藨草在滨海湿地潮滩前沿扩散的主要繁殖体, 水动力条件和泥沙淤积的干扰将显著影响种子的存活及萌发, 而地下根茎能在植物地上部分生成前就形成复杂的网络, 因此地下根茎是海三棱藨草在潮滩前沿最主要的扩散单元[30]。极少数成功萌发的海三棱藨草实生苗的植株低矮且根茎弱小,难以耐受持续的潮汐、波浪冲刷和泥沙掩埋的复合胁迫。
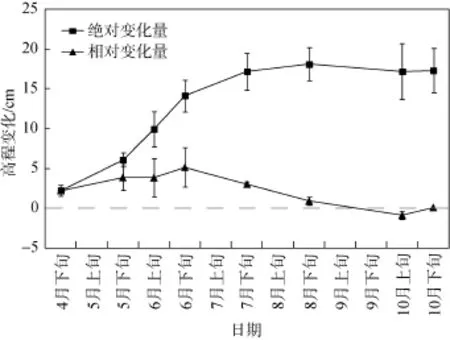
图4 实验地点的潮滩冲淤动态Fig. 4 Accretion/erosion regimes of mudflat in the experimental sites
相比之下, 本研究同时采用了海三棱藨草带土球茎微系统作为新生湿地植被恢复的种植材料。在植入潮滩淤泥后, 多数球茎能在生长季早期开始出苗并实现定居。由于潮汐和波浪冲刷的不利影响,幼苗的存活率虽然会在种植后的初期定居阶段下降约50%, 但存活下来的幼苗能迅速通过地下分蘖和地下根茎发展从土壤基质中萌发并形成密集的种群。适度的泥沙淤积反而能帮助幼苗维持直立生长,促进海三棱藨草种群的定居和扩增。在自然条件下,海三棱藨草种群的生长和横向扩散主要由球茎和地下根茎决定的[16,31], 植物初期定居阶段更是种群重建和恢复成功的关键条件[6]。另一方面, 在泥沙沉积和植物地下繁殖体的共同作用下, 球茎采集区的植被自我恢复良好(本文中未显示数据), 没有受到取样工作的显著干扰。这也侧面证明了地下繁殖体对海三棱藨草建群和恢复的重要性。
此外, 对于大规模的植被恢复工程, 经济成本也是极其重要的因素[32]。首先, 本研究对比了3种有成本差异的种植密度实验。这种成本差异主要体现在种植材料运输和现场种植时的人工费差异。虽然低密度种植处理的支出最少, 但其幼苗存活率相应地偏低, 这导致了海三棱藨草植被恢复的低效性。高密度种植处理实验在海三棱藨草生长季末期取得了最高的植株存活率和植株密度, 但其在取样、运输和种植过程中的人工费用也最高。相比于高密度种植处理, 中密度种植处理也能获得较高的植株密度。这说明在经济成本要素占重要地位的大规模植被恢复工程中, 选择满足海三棱藨草幼苗定居和种群可持续发展的最低种植材料需求的策略将是更经济高效的。
5 结论
(1) 成熟的海三棱藨草种子在实验室条件下有较高的出苗率, 但随着种植深度加深而显著下降。在野外环境下, 由于潮滩湿地泥沙淤积的掩埋胁迫,即使采取高密度种植处理也仅有极少数种子能萌发生成植株, 且不同种植密度处理间的出苗率和植株密度没有显著差异。
(2) 海三棱藨草球茎在作为植被恢复的种植材料时能实现出苗和定居, 并能通过地下分蘖和地下根茎发育迅速形成密集的种群。
(3) 对比不同海三棱藨草球茎种植密度处理的结果表明, 生长季后期中密度和高密度种植处理下的植株密度没有显著差异, 说明在未来大规模的海三棱藨草种群修复工程中应优选经济高效且密度适宜的种植策略。
(4) 综上所述, 在长江口滨海湿地采用球茎营养繁殖的原生植被恢复策略较为可行, 而采用种子繁殖策略具有较大风险。同时, 还需展开进一步的调查研究以检测植被恢复策略的长效性以及环境因子对海三棱藨草种群发展过程的综合影响。
[1] MITSCH W J, GOSSELIN J G. Tidal salt marshes. In: Wetlands, 3rd edition[M]. New York: John Wiley & Sons,Inc, 2000.
[2] GEDAN K B, SILLIMAN B R, BERTNESS M D. Centuries of human-driven change in salt marsh ecosystems[J]. Annual Review of Marine Science, 2009, 1(1): 117–141.
[3] SILLIMAN B R, GROSHOLZ E D, BERTNESS M D (Eds.). Human Impact on Salt Marshes: A Global Perspective[M]. Berkeley (California): University of California Press, 2009.
[4] ZEDLER J B, KERCHER S. Causes and consequences of invasive plants in wetlands: opportunities, opportunists, and outcomes[J]. Critical Reviews in Plant Sciences, 2004, 23(5): 431–452.
[5] 崔保山, 杨志峰. 湿地[M]. 北京: 北京师范大学出版社, 2006.
[6] ALDAY J G, COX E S, PAKEMAN R J, et al. Effectiveness of Calluna-heathland restoration methods after invasive plant control[J]. Ecological Engineering, 2013, 54(2): 218–226.
[7] MITSCH W J. Wetland creation, restoration, and conservation: a wetland invitational at the Olentangy River Wetland Research Park[J]. Ecological Engineering, 2005, 24(4): 243–251.
[8] ZEDLER J B, KERCHER S. Wetland resources: status, trends, ecosystem services, and restorability[J]. Annual Review of Environment and Resources, 2005, 15(30): 39–74.
[9] 葛振鸣, 王天厚, 王开运, 等. 长江口滨海湿地生态系统特征及关键群落的保育[M]. 北京: 科学出版社, 2008.
[10] 上海科学院. 上海植物志(第一卷)[M]. 上海: 上海科学技术出版社, 1999.
[11] GE Zhenming, ZHOU Xiao, WANG Tianhou, et al. Effects of vegetative cover changes on the carrying capacity of migratory shorebird in a newly-formed wetland, Yangtze River Estuary, China[J]. Zoological Studies, 2009, 48(6): 769–779.
[12] MA Zhijun, LI Bo, ZHAO Bin, et al. Are artificial wetlands good alternatives to natural wetlands for waterbirds? – A case study on Chongming Island, China[J]. Biodiversity and Conservation, 2004, 13(2): 333–350.
[13] 赵雨云, 马志军, 李博, 等. 鸭类摄食对海三棱藨草种子萌发的影响[J]. 生态学杂志, 2003, 22(4): 82–85.
[14] LI Bo, LIAO Chengzhang, ZHANG Xiaodong, et al.Spartina alterniflorainvasions in the Yangtze River estuary, China: An overview of current status and ecosystem effects[J]. Ecological Engineering, 2009, 35(4): 511–520.
[15] GE Zhenming, CAO Haobin, ZHANG Liquan. A process–based grid model for range expansion ofSpartina alternifloraon the coastal saltmarshes in the Yangtze Estuary[J]. Ecological Engineering, 2013, 58: 105–112.
[16] GE Zhenming, ZHANG Liquan, YUAN Lin. Spatiotemporal dynamics of salt marsh vegetation regulated by plant invasion and abiotic processes in the Yangtze Estuary: observations with a modeling approach[J]. Estuaries and Coasts, 2015, 38(1): 310–324.
[17] 陶敏, 鲍大川, 江明喜. 三峡库区9种植物种子萌发特性及其在植被恢复中的意义[J]. 生态学报, 2011, 31(4): 909–913.
[18] 邓徐, 刘志民. 可获得种子量和种子出苗对草地裸沙斑植被恢复的相对制约[J]. 生态学杂志, 2011, 30(12): 2679–2684.
[19] FERNÁNDEZ J B G, GARCÍA NOVO F. High–intensity versus low–intensity restoration alternatives of a tidal marsh in Guadalquivir estuary, SW Spain[J]. Ecological Engineering, 2007, 30(2): 112–121.
[20] MATESANZ S, VALLADARES F. Improving revegetation of gypsum slopes is not a simple matter of adding native species: Insights from a multispecies experiment[J]. Ecological Engineering, 2007, 30(1): 67–77.
[21] 刘旭, 程瑞梅, 肖文发. 土壤种子库研究进展[J]. 世界林业研究, 2008, 21(1): 27–33.
[22] DENG Zifa, AN Shuqing, ZHAO Congjiao, et al. Sediment burial stimulates the growth and propagule production ofSpartina alternifloraLoisel[J]. Estuarine, Coastal and Shelf Science, 2008, 76(4): 818–826.
[23] HE Yanlong, LI Xiuzhen, GUO Wenyong, et al. Division of labor in rhizomatous species: Comparative performance of native and invasive species in the tidal marshes of the Yangtze River estuary, China[J]. Journal of Experimental Marine Biology and Ecology, 2012, 422–423: 122–128.
[24] YANG Shilun. Sedimentation on a growing intertidal island in the Yangtze River mouth[J]. Estuarine, Coastal and Shelf Science, 1999, 49(3): 401–410.
[25] 曹浩冰, 葛振鸣, 祝振昌, 等. 崇明东滩盐沼植被扩散格局及其形成机制[J]. 生态学报, 2014, 34(14): 3944–3952.
[26] 葛振鸣, 周晓, 王开运, 等. 长江河口典型湿地碳库动态研究方法[J]. 生态学报, 2010, 30(4): 1097–1108.
[27] BOUMA T J, FRIEDRICHS M, KLAASEN B, et al. Effects of shoot stiffness, shoot size and current velocity on scouring sediment from around seedlings and propagules[J]. Marine Ecology Progress Series, 2009, 388: 293–297.
[28] VAN WESENBEECK B K, VAN DE Koppel J, HERMAN P M J, et al. Potential for sudden shifts in transient systems: distinguishing between local and landscape-scale processes[J]. Ecosystems, 2008, 11(7): 1133–1141.
[29] PEZESHKI S R. Wetland plant responses to soil flooding[J]. Environmental and Experimental Botany, 2001, 46(3): 299–312.
[30] SCHWARZ C, YSEBAERT T, ZHU Zhenchang, et al. Abiotic factors governing the establishment and expansion of two salt marsh species in the Yangtze estuary, China[J]. Wetlands, 2011, 31(6): 1011–1021.
[31] 张利权, 雍学葵. 海三棱蔍草种群的物候与分布格局研究[J]. 植物生态学与地植物学学报, 1992, 16: 43–51.
[32] CHAPMAN M G, UNDERWOOD A J. The need for a practical scientific protocol to measure successful restoration[J]. Wetlands, 2000, 19(1): 28–49.
A trial study on revegetation of the native Scirpus mariqueter population in the coastal wetland of the Yangtze Estuary
HU Zhongjian1,†, MA Qaing2,†, CAO Haobing1, ZHANG Zhitong2, TANG Chendong2, ZHANG Liquan1, GE Zhenming1,*
1.State Key Laboratory of Estuarine and Coastal Research,East China Normal University,Shanghai200062,China
2.Chongming Dongtan Bird Nature Reserve,Shanghai202183,China
Many coastal wetlands were invaded by the exotic species along Chinese coastline. In the Yangtze Estuary, the Chinese endemic community ofScirpus mariqueterTs. Tang & F.T. Wang has been shrunk due to the rapid expansion of exoticSpartina alterniflora. In this study, the experiments involvingS. mariqueterrevegetation were conducted based on an ecological engineering for controlling the invasive species, by using seed-planting and corm-planting approaches. At the same time, three levels of planting density were employed in order to assess their cost-effectiveness through the experiments. Under the condition in laboratory, the rate of seed germination was high, especially when planted in 5-cm depth. However, the rates of seed germination and seedling emergency were extremely low when planted in the field mudflat (5-cm depth), even using the highest planting density, mainly due to the burial stress of sediment deposition during the growing season. There were not significant differences in the rate of seedling emergency and shoot density between different seed-planting densities. In contrast,the approach of corm-planting was feasible when planting in the mudflat, and the rates of seedling emergency and shoot density were significantly higher than those with seed-planting approach. The surviving seedlings sprouting from the soil substrates formed a dense shoot community quickly through underground tillering and rhizome development. Our results also indicated that a medium planting density appeared to be a cost-effective way for establishing the native species in the coastal wetland, because there were not significant differences in the rate of seedling emergency and shoot density between medium and high planting density. We suggested that this study might be helpful for planning further large-scale revegetation of the native species in the Yangtze Estuary.
coastal wetland; native vegetation; ecological restoration; underground propagulum; seed bank
10.14108/j.cnki.1008-8873.2016.05.001
X171.4
A
1008-8873(2016)05-001-07
胡忠健, 马强, 曹浩冰 等. 长江口滨海湿地原生海三棱藨草种群恢复的实验研究[J]. 生态科学, 2016, 35(5): 1-7.
HU Zhongjian, MA Qaing, CAO Haobing, et al. A trial study on revegetation of the nativeScirpus mariqueterpopulation in the coastal wetland of the Yangtze Estuary[J]. Ecological Science, 2016, 35(5): 1-7.
2015-11-05;
2016-01-02
国家自然科学基金(41571083); 上海市科学技术委员会“海洋科技专项”(14DZ1206004); 河口海岸学国家重点实验室自主课题(2015KYYW03)
胡忠健(1991—), 男, 浙江永嘉人, 硕士研究生, 主要从事湿地生态学研究, E-mail: huzj1991@163.com;†共同第一作者
*通信作者: 葛振鸣(1979—), 男, 博士, 研究员, 主要从事湿地生态学, E-mail: zmge@sklec.ecnu.edu.cn;
