利用稻田养萍诱集控制福寿螺危害的效应研究
2016-05-17郭靖章家恩张春霞项瑶
郭靖, 章家恩,2,3,4,*, 张春霞, 项瑶
利用稻田养萍诱集控制福寿螺危害的效应研究
郭靖1, 章家恩1,2,3,4,*, 张春霞1, 项瑶1
1. 华南农业大学资源环境学院生态学系, 广州 510642
2. 农业部热带农业环境重点实验室, 广州 510642
3. 广东省现代生态农业与循环农业工程技术研究中心, 广州 510642
4. 广东省高等学校农业生态与农村环境重点实验室, 广州 510642
利用自制的“T形槽”进行实验室试验, 研究了福寿螺(Pomacea canaliculata)对浮萍(Lemna minor)和不同日龄水稻(Oryza sativa)的偏好选择, 结果发现, 无论水稻日龄是15 d, 还是23 d和30 d, 均有60%以上的福寿螺选择取食浮萍, 且与福寿螺个体大小和选择取食的时间没有明显关联。在模拟稻田生境中, 引入浮萍3 d后, 水稻受福寿螺的啃食危害明显减少, 水稻存活率高出对照组10%以上, 且30日龄水稻秧苗的存活率明显高于15日龄处理。在此基础上, 分析了不同大小福寿螺与浮萍摄入量的关系。这一结果可为浮萍的合理投放提供参考。研究表明, 利用稻田放养浮萍诱集福寿螺取食, 可以减少福寿螺对水稻的危害。
福寿螺; 浮萍; 生物防治; 诱集植物; 生防植物
1 前言
福寿螺(Pomacea canaliculata)又名大瓶螺、苹果螺, 原产于南美洲亚马逊河流域, 是热带和亚热带地区的两栖淡水贝类软体动物。因其蛋白质含量丰富及营养价值高等特点, 1980年前后作为食用经济动物引入到中国台湾、日本和菲律宾等地, 并在80年代迅速推广到中国大陆、马来西亚、印度尼西亚等东亚和东南亚国家[1–2], 少部分作为观赏螺引入多地水族馆[3]。由于引入前未进行生态风险评估及后来的市场化失败, 遭弃养的福寿螺迅速在稻田、河沟等水生生境繁殖并扩散, 严重危害作物生产[4]。同时, 寄生于福寿螺体内的广州管圆线虫(Angiostrongylus cantonensis)可引起人体嗜酸性脑膜炎[5]。2000年, 福寿螺被世界自然保护联盟外来入侵物种专家委员会列入世界100种恶性外来入侵物种的“黑名单”[6]。
面对福寿螺在世界范围内造成的农业和生态危害, 化学杀螺剂作为大部分农民的首选, 被广泛应用于福寿螺防控中, 但会带来严重的环境污染和生物多样性下降问题[7]。而在福寿螺的强密度补偿效应下[8], 单独应用物理防治方法往往效果不理想,故常作为辅助手段使用。生物防治因其具备的可持续性及潜在的生态效益而成为福寿螺防控方法研究中的重点[9], 但已有研究中控制和实施效果较为理想的物种非常有限, 主要包括鸭、鲤鱼(Cyprinus carpio)、中华鳖(Pelodiscus sinensis)等[10–12]。尽管福寿螺适应能力强、繁殖率高、遗传多样性丰富等特点增加了筛选有效天敌的难度, 但就生态安全和食品安全而言, 寻求有效的生物防治方法仍是福寿螺研究中主要工作方向之一。
在现代农业的害虫防治系统中, 往往是利用捕食性或寄生性天敌以及微生物来控制有害生物种群,但事实上, 一些植物本身也发挥了重要作用, 亦是生物防治的重要组成部分[13]。目前能够控制福寿螺危害的生防植物基本集中于杀虫植物的研究, 即提取植物中的有效成分加工成植物源杀螺剂[14–15]。而在植物对福寿螺的直接趋避性的研究方面非常少见,且相关试验使用的均为陆生植物[16], 无法在福寿螺栖息的水生生境中保持长效性。浮萍(Lemna minor),又名青萍、青浮萍, 作为一类生长快、富含蛋白质和氨基酸的水生漂浮植物, 常生于稻田、池沼、水沟等有机质丰富的静水水域, 广布于全世界温带和热带地区。福寿螺和浮萍在我国南方稻田均易出现,而在三者共存条件下, 福寿螺究竟偏向于取食水稻或是浮萍?若福寿螺偏向于取食浮萍, 其对水稻的危害能否减小?为此, 本研究利用自制T形槽装置研究福寿螺对浮萍和不同日龄水稻的取食偏好, 以及在模拟稻田生境中观察有无浮萍条件下福寿螺对水稻的危害差异, 旨在为福寿螺的生态防治和现代有机农业的发展提供新的思路。
2 材料与方法
2.1试验材料
2014年9月初于华南农业大学校内农场(23°09′N, 113°01′E)水渠或稻田中采集供试福寿螺和浮萍。每天投喂福寿螺足量新鲜生菜, 试验前挑选表观正常、活力较强的个体用于试验。在有阳光照射的模拟稻田生境的水箱中放养浮萍, 让其自行繁殖, 以供试验时捞取。供试水稻品种为黄华占。
以Takeichi等[17]和徐武兵等[18]研究作为参考,利用厚度为5 mm的透明有机玻璃制成T形槽(图1),具体规格如图1所示, 高度为20 cm。并将两根适宜长度的圆柱形木棍(直径5 mm)卡在离T形槽底部为5 cm高度的水平面上, 分别与T形槽两臂外侧的距离为5 cm, 即图1中虚线位置。
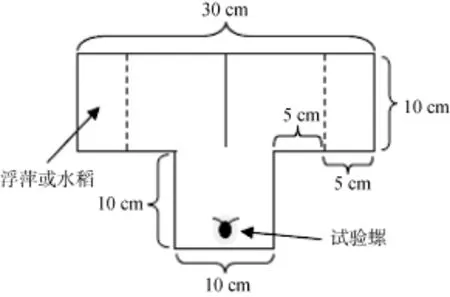
图1 T形槽俯视示意图Fig. 1 T-maze device
2.2试验方法
2.2.1 福寿螺对浮萍和水稻的偏好性测定
分别在水稻日龄为15 d、23 d、30 d时, 利用自制的T形槽进行福寿螺对浮萍和水稻的选择试验,将T形槽放置在人工气候箱中, 提供人工光照, 试验期间温度在28 ℃左右, 透明箱门用报纸遮挡, 避免受到外界光照影响, 只在气候箱门上方正中间留下一个矩形观察窗(20 cm × 4 cm)。T形槽中加曝气水至槽5 cm深, 使木棍正好处在水面上。将0.2 g的水稻叶片剪成约为5 cm长的小段, 随机地放入T形槽一臂外侧5 cm内, 另一臂外侧则放入0.2 g浮萍, 浮萍称重前用滤纸吸干表面水分, 木棍的设计是防止水稻叶片和浮萍飘入T形槽中部。然后随机挑选壳高在10―45 mm之间的福寿螺1只放置在T形槽的底端(图1), 记录30 min内福寿螺的选择结果及做出选择的时间, 以螺到达T形槽两臂外侧5 cm内为准, 超过30 min未做出选择的福寿螺不纳入统计结果。每调查完1次观察结果, 将曝气水、水稻、浮萍和福寿螺全部换掉, 并用自来水清洗T形槽,以避免前后次调查试验之间的干扰。用于观察对浮萍和不同日龄水稻的偏好性选择的福寿螺有效数量均为30只。
2.2.2 浮萍存在条件下福寿螺对水稻的危害情况调查
分别在水稻日龄为15 d和30 d时, 将水稻移入预先准备好的塑料箱(72 cm × 56 cm × 38.5 cm)中,塑料箱底部为水稻土, 土层为10 cm左右, 水深约5 cm。水稻秧苗以4株为1穴, 每箱按20 cm × 15 cm的规格均匀插入9穴秧苗。试验共有6个箱子, 其中3个塑料箱加入15 g新鲜浮萍, 作为处理组, 另外3个设为对照组。每个箱子中投入福寿螺8只, 壳高15―20 mm、20―25 mm、25―30 mm、30―35 mm的各2只。自投放福寿螺后, 每天同一时间统计水稻秧苗受损情况, 整个水稻茎秆被咬断记为死亡, 部分茎秆或叶片被螺啃食掉记为受损, 试验调查持续3 d。
2.2.3 不同大小福寿螺摄入浮萍量调查
随机挑选48只表观正常、不同大小、饥饿1 d的福寿螺用于试验, 测量其壳高及称重后, 将福寿螺分别放入预先准备好的红色小桶(5.8 L, 内口径21.0 cm)中, 每个小桶放入1只福寿螺和2 L曝气自来水, 并投入足够的定量浮萍。小桶一直盖有桶盖, 以防止螺逃逸, 桶盖上钻有小孔, 便于福寿螺呼吸换气。每天不定时观察福寿螺取食浮萍情况, 并补充足够的定量浮萍, 试验持续3 d, 试验后捞取剩余浮萍并称重, 最后计算每只螺平均每日浮萍摄入量。福寿螺壳高用数码游标卡尺量取, 精确到0.02 mm, 福寿螺体重和浮萍重量用电子天平称量, 精确到0.1 mg,试验期间浮萍生长所造成的重量增加忽略不计。
2.3数据分析
采用SPSS 20.0、Excel 2007软件对试验数据进行整理和统计学分析, 对福寿螺选择水稻和浮萍的频数进行二项分布检验, 对福寿螺选择水稻和浮萍的时间及有无浮萍存在条件下福寿螺对水稻植株的危害情况差异比较进行t检验, 数据以平均值+标准误差的形式列出。全文数据整理绘图采用Excel 2007和Origin 8.0进行。
3 结果与分析
3.1福寿螺对浮萍和水稻的偏好性选择
由图2可见, 水稻日龄为15 d时, 有60.0%的福寿螺偏好于取食浮萍, 剩余40.0%的福寿螺选择取食水稻, 通过统计发现, 福寿螺选择15日龄水稻和浮萍的时间分别为(15.17 ± 2.31) min和(15.22 ± 1.71) min,两者无明显差异(P>0.05); 当水稻生长到23 d和30 d时, 选择取食浮萍的福寿螺数量进一步增加, 分别达到76.7%和66.7%, 余下小部分螺选择取食水稻;通过统计福寿螺做出选择取食的时间, 同样无明显差别(P> 0.05)。总体而言, 在不考虑水稻日龄的情况下, 对福寿螺选择水稻和浮萍的频数进行二项分布检验, 发现福寿螺明显偏向于取食浮萍(P<0.01), 说明浮萍对福寿螺有一定的诱集作用。

图2 福寿螺对浮萍和不同日龄水稻的选择取食偏好Fig. 2 The feeding preference selection of P. canaliculata to duckweed and rice in different day-ages
如图3所示, 在不考虑水稻日龄的前提下, 通过统计做出偏好选择的福寿螺个体大小和选择时间, 不论是选择水稻, 或是浮萍, 均未呈现出一个明显的规律性。选择浮萍的福寿螺个体大小(Y1)与时间(X1)的关系是: Y1= –0.03X1+ 24.93 (R2=0.002; P>0.05); 选择水稻的福寿螺个体大小(Y2)与时间(X2)的关系是: Y2= –0.13X2+ 28.14 (R2=0.017; P>0.05)。综合图2和图3可见, 尽管福寿螺偏向于取食浮萍, 但与福寿螺个体大小和做出选择时间没有明显关系。
3.2浮萍存在条件下福寿螺对水稻的危害情况
当福寿螺引入到只有水稻种植的稻田生境中,尤其是水稻秧苗特别幼嫩(日龄15 d)时, 1 d时间后仅有22.2%的秧苗存活下来, 其中还有将近4%的秧苗受损, 但当稻田中引入浮萍后, 部分福寿螺会选择取食浮萍, 从而使水稻的受害率减小, 同样规格的福寿螺引入到稻-萍共生环境1 d后, 水稻存活率为46.3%,高于水稻常规种植, 但并未达到显著差异(P>0.05);当福寿螺引入时间延长至2 d时, 有浮萍和无浮萍存在条件下水稻的存活率分别为27.8%和4.6%, 差异性达到了显著性水平(P<0.05); 常规水稻种植引入福寿螺3 d后, 秧苗全部被螺取食掉, 存活率下降至0,明显低于有浮萍存在的处理(16.7%; P<0.05) (图4A)。
当水稻秧苗移栽日龄从15 d改为30 d, 此时水稻生长得较为“硬朗”, 在福寿螺存在下的水稻受害率明显降低, 常规种植条件下水稻受福寿螺危害1 d后, 存活率为79.6%, 而引入浮萍后, 水稻存活率会更高, 达到91.7%, 但两者差异并不显著(P>0.05); 不管是水稻常规种植还是稻萍共生环境下, 随着遭受螺害时间的延长, 水稻的存活率持续下降, 引入福寿螺3 d后, 稻萍共生下水稻的存活率降至60.2%, 但显著高于同时期的常规水稻种植(48.1%) (图4B)。
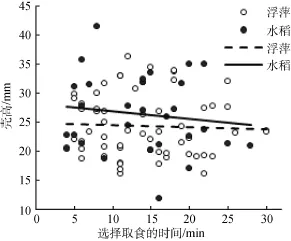
图3 T形槽试验的福寿螺个体大小和对植物取食的选择时间Fig. 3 The body size of P. canaliculata and its selection time for plants in a T-maze test

图4 浮萍存在条件下福寿螺对水稻的危害情况Fig. 4 Harm situation of rice caused by P. canaliculata in the co-culture of duckweed and rice
整个试验过程中, 不计水稻死亡情况在内, 有无浮萍条件下水稻受损率均在7.4%以内(图4)。总体而言, 引入浮萍3 d后, 水稻受福寿螺的啃食危害明显降低, 存活率明显提高(P<0.05)。同时通过比较15和30 日龄秧苗在同等条件处理下受害情况发现,无论是水稻常规种植还是稻-萍共生, 30日龄秧苗存活率均极显著高于同时期调查的15日龄秧苗的存活率(P<0.01)。
3.3不同大小福寿螺摄入浮萍量调查
由图5和图6可以看出, 随着福寿螺体重的增加或壳高的增大, 浮萍摄入量呈现一个逐步增加的趋势, 对不同大小的福寿螺的体重(W)和壳高(H)分别与浮萍每天摄入量(F)进行相关性分析发现它们之间均存在极显著的正相关关系: F = 0.441W + 0.159 (R2= 0.802, P<0.01) (图5); F = 0.138H – 1.549 (R2=0.731, P<0.01) (图6), 表明可以通过调查稻田中福寿螺大小(壳高或体重)和数量情况, 来确定浮萍的大致投放量。
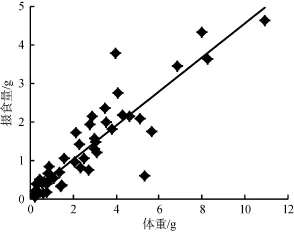
图5 不同大小福寿螺体重与浮萍摄食量的关系Fig. 5 The relationship between P. canaliculata weight of difference sizes and its feeding amount on duckweed
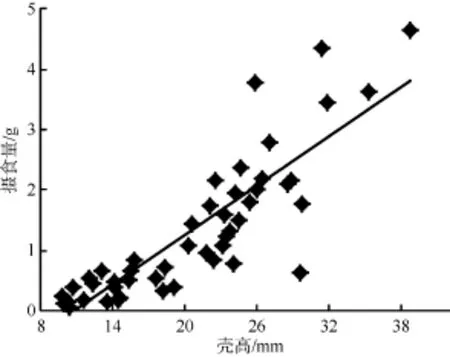
图6 不同大小福寿螺壳高与浮萍摄食量的关系Fig. 6 The relationship between different shell heights of P. canaliculata and its feeding amount on duckweed
4 讨论
4.1利用植物源材料控制福寿螺危害
传统农业中化学药剂的过度使用带来了农产品农药残留问题和较为严重的环境污染, 减少农药残留、确保农产品安全是人们共同关注的问题。为了控制福寿螺的发生为害和克服化学防治带来的不利影响, 国内外已开展利用植物源材料控制福寿螺危害的相关研究, 主要集中在植物提取物的灭螺活性研究, 涵盖了经济作物(藜麦Chenopodium quinoa、烟草)、入侵植物(五爪金龙Ipomoea cairica、马缨丹Lantana camara)、绿化树种(无患子Sapindus saponaria、夹竹桃Nerium indicum)等, 并且部分表现出较好的灭杀效果[14–15,19–21]。植物源杀螺剂的有效成分均为天然物质, 施用后易降解, 对环境污染小, 但达到一定的控螺效果往往提取物的需求量较大, 加之提取过程繁琐且经济成本高, 目前多处于试验阶段。
除此之外, 也有少部分研究植物源材料对福寿螺的趋避性, 以期通过更为简便的操作方法来引诱或驱赶福寿螺, 以减少其对目标作物的危害。徐武兵等[16]研究发现白千层(Melaleuca leucadendra)和扶桑(Hibiscus rosa-sinensis)对福寿螺有较大的吸引作用, 金叶假连翘(Duranta repens)、木麻黄(Casuarina equisetifolia)等则对福寿螺有一定的驱赶作用。也可以通过在农田中放一些如苦楝树叶、芋头、香蕉、木瓜等引诱物来收集福寿螺[22]。但上述引诱物或趋避物均为陆生, 不能在稻田等水生环境中保持长效性。而本研究发现在水稻容易遭受福寿螺危害的苗期, 不考虑水稻的日龄, 选择取食浮萍的福寿螺数量是选择取食水稻的福寿螺的2.10倍(图2)。徐武兵等[16]研究发现, 福寿螺选择对其有吸引作用的白千层、扶桑分别是选择水稻的1.32、1.16倍, 故浮萍对福寿螺的吸引力更明显, 成为减少福寿螺对水稻危害的替代植物(即作为“陷阱”植物被福寿螺优先取食), 从而形成食物的“密度冗余”效应。这可能与浮萍粗蛋白含量高、营养丰富、适口性好等特点有关, 浮萍含有全部必需氨基酸, 相对于其它大多数植物蛋白, 更接近于动物蛋白, 且蛋白质含量占浮萍干重的43%, 加之纤维和其它难消化物质很少[23]。Wong等[24]研究了21种水生植物对福寿螺的适口性, 发现福寿螺最喜食的6种植物(包括浮萍)均具有相当高的营养成分, 且福寿螺摄食量与植物含氮量、碳氮比、含磷量等呈正相关关系, 说明福寿螺能以营养价值为基准来积极有效地选择食物, 这符合Townsend等[25]的最优觅食理论, 即一种动物在花费一定觅食成本下会将摄入能量或摄入营养最大化, 该结果为筛选对福寿螺具有趋避作用的植物提供了思路和依据。
4.2稻田养萍控制福寿螺危害的可行性
浮萍繁殖速度快, 在温度24 ℃、光照12 h的培养条件下, 可达到每4 d繁殖1倍的速度[26], 故利用浮萍去除污水中N、P成为国内外水处理的常见方法[27–28]。但有人认为, 浮萍在稻田中的存在会竞争水稻生长所需的肥料, 并且浮萍的大面积覆盖会消耗水中的氧气和降低水温, 抑制了水稻的生长发育[29]。但不少研究发现, 稻田施用浮萍对水稻产量并无明显影响[29–30], 且对稻田杂草(稗草、鸭舌草、莎草、牛毛毡等)和浮游藻类植物有不同程度的控制作用,并可明显减轻水稻纹枯病的发生[30–31]。
本研究发现, 稻田放养浮萍能够明显减少福寿螺对水稻的危害, 稻萍共生3 d后, 水稻受损率减少10%以上(图4)。而30日龄秧苗存活率明显高于15日龄水稻, 这主要是由于水稻的生物量增大和适口性下降导致的。此研究结果表明, 在不影响水稻生长和产量形成的情况下, 可适当推迟水稻移栽日龄[32]。同时, 为避免浮萍过量导致福寿螺种群快速增长, 浮萍的投放量可大致根据图5或图6来判定,实际调查中以统计成螺(壳高≥25 mm)情况为主, 但受复杂的农田环境条件的影响, 如何科学地投放浮萍尚待进一步研究。一般而言, 当福寿螺危害发生严重(每m2稻田成螺(壳高≥20 mm或体重≥2 g)密度6―10只)时, 则每m2稻田投放浮萍80―120 g,水面覆盖率约为50%―75%; 当福寿螺危害发生处于一般水平(每m2稻田成螺密度1―5只)时, 每m2稻田投放浮萍15―50 g, 水面覆盖率约为10%―30%。浮萍除可在稻田中使用外, 也可以用于水蕹菜、茭白等水生蔬菜田中, 如沈学根等[33]研究发现放养浮萍能够显著促进茭白植株的生长、提高茭白的产量和产值等, 但能否减少福寿螺带来的农业损失, 需在实施前研究福寿螺对浮萍和水生蔬菜的偏好性。浮萍除对福寿螺具有诱集功能外, 还可作为载体植物为福寿螺的天敌, 如鸭、鲤鱼等提供天然饵料[13,23,34]。因此, 可通过构建“稻-萍-鸭”或“稻-萍-鱼”复合农业系统来提高稻田生态系统的稳定性及对福寿螺的防控效率。
[1] HALWART M. The golden apple snailPomacea canaliculatain Asian rice farming systems: Present impact and future threat[J]. International Journal of Pest Management, 1994, 40(2): 199–206.
[2] YOSHIE H, YUSA Y. Effects of predation on the exotic freshwater snailPomacea canaliculata(Caenogastropoda: Ampullariidae) by the indigenous turtleChinemys reevesii(Testudines: Geoemydidae)[J]. Applied Entomology and Zoology, 2008, 43(4): 475–482.
[3] JOSHI R C. Problems with the management of the golden apple snailPomacea canaliculata: an important exotic pest of rice in Asia[M]. Area-Wide Control of Insect Pests. Springer Netherlands, 2007: 257–264.
[4] NAYLOR R. Invasions in agriculture: assessing the cost of the golden apple snail in Asia[J]. Ambio, 1996, 25(7): 443–448.
[5] LV S, ZHANG Y, LIU H X, et al. Invasive snails and an emerging infectious disease: results from the first national survey onAngiostrongylus cantonensisin China[J]. PLoS Neglected Tropical Diseases, 2009, 3(2): e368.
[6] LOWE S, BROWNE M, BOUDJELAS S, et al. 100 of the world’s worst invasive alien species: A selection from the global invasive species database[M]. Auckland, New Zealand: Invasive Species Specialist Group. 2000.
[7] TEO S S. Evaluation of different duck varieties for the control of the golden apple snail (Pomacea canaliculata) in transplanted and direct seeded rice[J]. Crop Protection, 2001, 20(7): 599–604.
[8] TANAKA K, WATANABE T, HIGUCHI H, et al. Densitydependent growth and reproduction of the apple snail,Pomacea canaliculata: A density manipulation experiment in a paddy field[J]. Researches on Population Ecology, 1999, 41(3): 253–262.
[9] CULLINEY T W. Benefits of classical biological control for managing invasive plants[J]. Critical Reviews in Plant Science, 2005, 24(2): 131–150.
[10] TEO S S. Evaluation of different species of fish for biological control of golden apple snailPomacea canaliculata(Lamarck) in rice[J]. Crop Protection, 2006, 25(9): 1004–1012.
[11] DONG S, ZHENG G, YU X, et al. Biological control of golden apple snail,Pomacea canaliculataby Chinese soft-shelled turtle,Pelodiscus sinensisin the wild rice,Zizania latifoliafield[J]. Scientia Agricola, 2012, 69(2): 142–146.
[12] LIANG K, ZHANG J, FANG L, et al. The biological control ofPomacea canaliculatapopulation by rice-duck mutualism in paddy fields[J]. Biocontrol Science and Technology, 2013, 23(6): 674–690.
[13] 肖英方, 毛润乾, 万方浩. 害虫生物防治新概念——生物防治植物及创新研究[J]. 中国生物防治学报, 2013, 29(1): 1–10.
[14] DAI L, WANG W, DONG X, et al. Molluscicidal activity of cardiac glycosides fromNerium indicumagainstPomacea canaliculataand its implications for the mechanisms of toxicity[J]. Environmental Toxicology and Pharmacology, 2011, 32(2): 226–232.
[15] QUIJANO M, RIERA-RUÍZ C, BARRAGÁN A, et al. Molluscicidal activity of the aqueous extracts fromSolanum mammosumL.,Sapindus saponariaL. andJatropha curcasL. againstPomacea canaliculata[J].Emirates Journal of Food and Agriculture, 2014, 26(10): 871–877.
[16] 徐武兵, 钟秋华, 李林峰, 等. 16种植物对福寿螺的趋避效果研究[J]. 广东农业科学, 2010, 37(11): 149–152.
[17] TAKEICHI M, HIRAI Y, YUSA Y. A water-borne sex pheromone and trail following in the apple snail,Pomacea canaliculata[J]. Journal of Molluscan Studies, 2007, 73(3): 275–278.
[18] 徐武兵, 钟秋华, 李林峰, 等. 雌雄福寿螺取食和对异性选择行为的差异[J]. 生态学杂志, 2011, 30(11): 2528–2533.
[19] 曾坤玉, 胡飞, 陈玉芬, 等. 四种与福寿螺(Ampullaria gigas)同源地入侵植物的杀螺效果[J]. 生态学报, 2008, 28(1): 260–266.
[20] JOSHI R C, SAN MARTÍN R, SAEZ-NAVARRETE C, et al. Efficacy of quinoa (Chenopodium quinoa) saponins against golden apple snail (Pomacea canaliculata) in the Philippines under laboratory conditions[J]. Crop Protection, 2008, 27(3): 553–557.
[21] TANGKOONBORIBUN R, SASSANARAKKIT S. Molluscicide from tobacco waste[J]. Journal of Agricultural Science, 2009, 1(1): 76–81.
[22] 王志高, 谭济才, 刘军, 等. 福寿螺综合防治研究进展[J]. 中国农学通报, 2009, 25(12): 201–205.
[23] YALMAZ E, AKYURT İ, GÜNAL G. Use of duckweed,Lemna minor, as a protein feedstuff in practical diets for common carp,Cyprinus carpio, fry[J]. Turkish Journal of Fisheries and Aquatic Sciences, 2004, 4(2): 105–109.
[24] WONG P K, LIANG Y, LIU N Y, et al. Palatability of macrophytes to the invasive freshwater snailPomacea canaliculata: differential effects of multiple plant traits[J]. Freshwater Biology, 2010, 55(10): 2023–2031.
[25] TOWNSEND C R, BEGON M, HARPER J L. Essentials of ecology, third edition[M]. Oxford: Wiley-blackwell. 2008.
[26] HARVEY R M, FOX J L. Nutrient removal usingLemna minor[J]. Journal (Water Pollution Control Federation), 1973, 45(9): 1928–1938.
[27] CHENG J, LANDESMAN L, BERGMANN B A, et al. Nutrient removal from swine lagoon liquid byLemna minor8627[J]. Transactions of the ASAE, 2002, 45(4): 1003–1010.
[28] 雷钧镒, 李猛, 马旭洲, 等. 青萍对富营养化水体氮、磷的去除效果[J]. 江苏农业科学, 2014, 42(1): 325–328.
[29] 宁伟军. 浮萍与稻糠对免耕抛秧稻生长、产量及氨挥发影响研究[D]. 南宁: 广西大学. 2008.
[30] 黄世文, 余柳青, 段桂芳, 等. 稻糠与浮萍控制稻田杂草和稻纹枯病初步研究[J]. 植物保护, 2003, 29(6): 22–26.
[31] PARR L B, PERKINS R G, MASON C F. Reduction in photosynthetic efficiency ofCladophora glomerata, induced by overlying canopies ofLemnaspp[J]. Water research, 2002, 36(7): 1735–1742.
[32] TEO S S. Damage potential of the golden apple snailPomacea canaliculata(Lamarck) in irrigated rice and its control by cultural approaches[J]. International Journal of Dairy Technology, 2003, 49(1): 49–55.
[33] 沈学根, 汪炳良, 高根法, 等. 放养浮萍对双季茭白生长和产量的影响[J]. 浙江农业学报, 2004, 16(4): 206–209.
[34] NGAMSAENG A, THY S, PRESTON T R. Duckweed (Lemna minor) and water spinach (Ipomoea aquatica) as protein supplements for ducks fed broken rice as the basal diet[J]. Livestock Research for Rural Development, 2004, 16(3): 18–24.
Decoy effect of duckweed Lemna minor on Pomacea canaliculata in rice from paddy fields
GUO Jing1, ZHANG Jiaen1,2,3,4,*, ZHANG Chunxia1, XIANG Yao1
1.Department of Ecology, College of Natural Resources and Environment,South China Agricultural University,Guangzhou510642,China
2.Key Laboratory of Agro-Environment in the Tropics,Ministry of Agriculture,Guangzhou510642,China
3.Guangdong Provincial Engineering Technology Research Center of Modern Eco-agriculture and Circular Agriculture,
Guangzhou510642,China
4.Key Laboratory of Agroecology and Rural Environment of Guangzhou Regular Higher Education Institutions,Guangzhou
510642,China
In this paper, a T-maze was used to observe the preference ofPomacea canaliculatabetween duckweed (Lemna minor) and rice (Oryza sativa) plants of different ages. The results revealed that more than 60 percent of snails preferred to feed onL. minor, whenever the rice plants were 15, 23 or 30 days old. This pattern was not clearly associated with the individual size and treatment time ofP. canaliculata. In a simulated paddy habitat, the amount of rice eaten and damaged by the snails significantly decreased after the duckweed was introduced for 3 days, the survival rate of rice plants exceeded that of the control by 10 percent; the survival of 30-day-old rice plants was clearly higher than that of the 15-day-old rice plants. Moreover, the relation of individual size ofP. canaliculataand its ingestion rate ofL. minorwas statistically analyzed, as itmay offer a reference for the calculation of the required duckweed supply. This study showed thatL. minorhas a decoy effect onP. canaliculata, which in turn may reduce the snails’ harm to rice plants.
Pomacea canaliculata;Lemna minor; biological control; trapping plants; bio-control plants
10.14108/j.cnki.1008-8873.2016.05.002
S476
A
1008-8873(2016)05-008-07
郭靖, 章家恩, 张春霞, 等. 利用稻田养萍诱集控制福寿螺危害的效应研究[J]. 生态科学, 2016, 35(5): 8-14.
GUO Jing, ZHANG Jiaen, ZHANG Chunxia, et al. Decoy effect of duckweedLemna minoronPomacea canaliculatain rice from paddy fields[J]. Ecological Science, 2016, 35(5): 8-14.
2015-10-12;
2015-11-02
国家自然科学基金项目(U1131006、30770403、30900187); 广东省科技计划项目(2007B020709007、2011B020309009、2012B020310005、2015B090903077); 广东省高等学校高层次人才项目(粤教师函2010[79号]); 广东省引进国(境)外高层次人才智力项目(粤外专[2010]51号)
郭靖(1989―), 男, 湖南汨罗人, 博士研究生, 主要从事农业生态学和入侵生物等方面的研究, E-mail: jingaj@163.com
*通信作者: 章家恩, 男, 博士, 教授, 主要从事生态学等方面的教学与研究工作, E-mail: jeanzh@scau.edu.cn
