产氢菌的分离鉴定及发酵性能
2016-05-17张存胜王文娟王振斌邵淑萍马海乐江苏大学食品与生物工程学院江苏镇江0固体废物处理与环境安全教育部重实验室清华大学北京00084青岛啤酒股份有限公司山东青岛6600
张存胜,王文娟,王振斌,邵淑萍,,马海乐(江苏大学食品与生物工程学院,江苏 镇江0;固体废物处理与环境安全教育部重实验室(清华大学),北京 00084;青岛啤酒股份有限公司,山东 青岛6600)
产氢菌的分离鉴定及发酵性能
张存胜1,2,王文娟1,王振斌1,邵淑萍1,3,马海乐1
(1江苏大学食品与生物工程学院,江苏 镇江212013;2固体废物处理与环境安全教育部重实验室(清华大学),北京 100084;3青岛啤酒股份有限公司,山东 青岛266100)
摘要:为了获得高性能的产氢菌,从碱处理后活性污泥中分离纯化得到两株产氢菌(H-1和H-2),生物学鉴定表明两株菌均为Enterobacter种属,H-1菌为Enterobacter cancerogeous HG6 2A种属,而H-2与Enterobacter homaechei 83的关系最亲近。发酵实验结果表明,将H-1和H-2菌液进行1∶1混合时发酵性能最佳,对应的发酵时间和产氢量分别为33h和861mL/L,混合发酵克服了H-1菌单独发酵氢产量低和H-2菌发酵时间长的缺陷。发酵液中主要挥发性脂肪酸(VFA)为乙酸和丁酸,表明两株菌的发酵类型均为丁酸型发酵。由于两株菌的协同作用,混合发酵初期VFA的累积速率降低,提高了发酵体系的稳定性。
关键词:产氢菌;16S rDNA;制氢;发酵;协同作用
第一作者及联系人:张存胜(1983—),男,讲师,研究方向为生物质能源、食品废弃物资源化利用。E-mail zhangcs@mail.ujs.edu.cn。
生物暗发酵处理生物质废弃物制氢已逐渐成为生物质能源领域的研究热点之一,传统活性污泥发酵过程中耗氢菌较多,生物质氢转化率较低,非产氢菌产生的有毒物质往往抑制产氢菌活性。纯菌发酵避免了非产氢菌对产氢菌的底物竞争和次级代谢产物的抑制,能够提高生物质的氢转化率。目前的产氢菌主要有包括梭菌(Clostridium)[1]、肠杆菌(Enterobacter)[2]、芽孢杆菌(Bacillus)[3]、埃希氏菌(Escherichia)[4]等几大类,但目前的产氢菌发酵仍存在发酵时间长,产氢效率低等问题,高昂的成本仍然限制产氢菌发酵的工业化应用[5]。为了获得高性能的产氢菌,本文进行了活性污泥产氢菌筛分研究,通过克隆和16S rRNA测序等手段实现产氢菌种属鉴定,并对分离出的产氢菌进行了发酵性能研究。
1 材料与方法
1.1材料
1.1.1菌种
菌种来源:产氢菌是利用碱法处理活性污泥驯化后得到的。初始厌氧污泥取自江苏大学镜湖,经2mm筛过滤去除枝叶等杂质,于40L厌氧发酵罐中驯化3个月备用。利用6mol/L的NaOH溶液将备用污泥调节pH值至12.0±0.1并保持24h[6]。
1.1.2培养基
液体培养基(g/L):葡萄糖 20;胰蛋白胨 4;牛肉膏 2;酵母汁 1;L-半胱氨酸 0.5;NaCl 3;MgCl20.1;FeSO4·7H2O 0.1;K2HPO41.5;维生素液10mL;微量元素液 10mL。
维生素液(g/L):抗坏血酸 0.025;柠檬酸 0.02;对氨基苯甲酸 0.01。
微量元素液(g/L):MnSO4·7H2O 0.01;ZnSO4·7H2O 0.05;H3PO40.01;CaCl20.01;CoCl2·6H2O 0.2。
固体培养基:液体培养基+琼脂(1.6 %~2.0%)。pH值为6.0。
1.2实验方法
1.2.1产氢菌富集培养
取100 g碱处理后的活性污泥于三角瓶中,加入灭菌玻璃珠手动旋转至污泥颗粒捣碎。在超净工作台上,取10mL菌悬液接种于盛有150mL产氢培养基的250mL发酵瓶中,连接产氢密封及气体收集装置后,将发酵瓶置于37℃恒温水浴锅中培养,24h后测量所产气体的成分,若有氢气生成,说明产氢菌得到富集。
1.2.2产氢菌的分离筛选
初筛:取lmL富集好的种子液用无菌生理盐水依次制成10−1~10−5稀释梯度的菌悬液,分别取不同梯度下的菌悬液1mL进行培养(双重叠皿培养法),于生化培养箱中37℃培养12h,挑取产气泡的单个菌落于平板划线培养(平板划线法),观察菌体形态、大小是否一致,重复上述操作直到得到纯化的菌株。
复筛:将分离到的产氢菌株接种于盛有150mL产氢培养基的发酵瓶中,上封5mL液体石蜡,以橡胶塞密封,用氮气扫除发酵瓶中的空气,置于37℃的恒温水浴锅中培养。通过排水法收集产生的气体,采用气相色谱法检测其是否含有H2,判断此菌株是否为产氢菌株。选取产气能力强的菌株进行保藏鉴定。
1.2.3产氢菌种保藏
本实验主要采用液体石蜡保藏法[7],该法是将菌种置于液体培养基中,浸入石蜡进行厌氧封存,于4℃的冰箱中保藏。
1.2.4暗发酵实验
采用间歇实验测定菌株的产气曲线:将富集培养12h的产氢菌按10%的接种量接种于盛有200mL液体培养基的发酵瓶中,上封5mL液体石蜡,以橡胶塞密封,以流速为200mL/min的氮气扫除发酵瓶中的空气5min,在37℃恒温水浴条件下培养,记录每小时的产气量并检测氢气浓度,绘制产氢曲线。
产氢菌按照H-1与H-2为1∶0、0∶1、3∶1、1∶1和1∶3的比例混合,分别考察单菌和混菌发酵产氢性能。
1.3分析方法
1.3.1产氢菌的形态鉴定
通过对菌株的菌落形态、个体形态和革兰氏反应对细菌形态和性质进行初步鉴定[7]。
1.3.2DNA的提取与检测
(1)总DNA提取
将菌种于液体培养基富集培养两次,直接作为样品进行DNA提取。
(2)16S rDNA的PCR扩增
① 扩增引物:采用扩增细菌16S rRNA的通用引物,序列如下。
Forward 27 F:5-AGAGTTTGATCCTGGCTCA G-3。
Reverse 1492R:5’-TACGGCTACCTTGTTACG ACTT-3’。
② PCR扩增体系如表1所示。
③ 扩增条件:预变性95℃,5min;变性95℃,1min;退火55℃,1min;延伸72℃,90 s;重复上述3个步骤35个循环,然后延伸72℃,10min;最后10℃冷却。
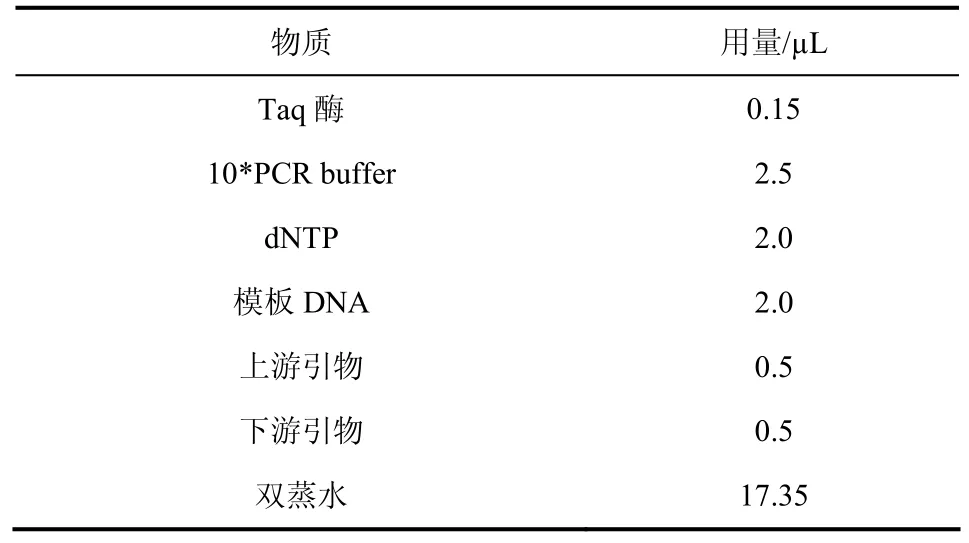
表1 PCR扩增体系
(3)电泳
扩增结束后,取2.5 µL PCR产物加入1 µL 10*Loading buffer混合均匀,通过1%琼脂糖凝胶进行电泳,利用溴酚蓝作指示剂,检测PCR扩增产物。最后用EB作染色剂涂布染色30min,在BIO-RAD凝胶成像系统中成像。
(4)序列测定
扩增产物引物合成及测序委托南京金斯瑞公司完成。
1.3.3气体检测和VFA分析
用SP-6890气相色谱仪进行生物气体成分测定,配置TCD检测器和TDX-01不锈钢柱(2m×3mm,配碳分子筛)。进样口温度、柱温、检测器温度分别为140℃、160℃和160℃,载气为Ar,柱前压为0.08mPa。
挥发性脂肪酸(volatile fatty acid,VFA)由气相色谱仪(GC-5890,HP)检测,配有氢火焰检测器(FID)和毛细管柱(安捷伦1909/N-133HPINNOWAX,30m×0.250mm),进样口和检测器温度分别为240℃和260℃。柱箱采用如下程序升温:初温100℃,保持1min;以15 ℃/min的速率升温至220℃,保持5min。载气为氮气,氮气、氢气和空气的流速分别为290mL/min、170mL/min和290mL/min。
2 结果与讨论
2.1产氢菌的形态特征
经过初筛和复筛,最终选定两株产气能力较强的菌株,分别命名为H-1和H-2。对分离出的两株菌进行生物学和扫描电镜观察,结果见图1和表2,由结果可知,H-1菌为短杆状革兰氏阴性菌,H-2菌为长杆状革兰氏阳性菌,两株产氢菌在固体培养基菌落形态均为乳白色、光滑、半透明,菌落表面微微突起。在厌氧环境下单胞生长,好氧环境下集结生长,属于兼性厌氧菌。两株菌在电子显微镜下都可观察到运动状态,在扫描电镜下均未观察到两株菌有芽孢出现。

图1 菌株H-1和H-2的扫描电镜图

表2 细菌的生物学特征
2.2基于16S rRNA 的系统发育分析
将筛选出的两株菌进行16S rRNA基因序列测定分析,所得序列与GenBank数据库中已知16S rDNA序列进行比较,通过NCBI的Blast序列比对进行同源性分析。结果表明新分离的两株菌的16S rDNA基因与Enterobacter属各种的同源性大于99%,但两株菌种之间不具有相关性。为了进一步确定该产氢菌在生命进化中的分类学地位,对两株菌进行了系统发育学分析,图2表明它们是Enterobacter属的成员,H-1种属为Enterobacter cancerogeous HG6 2A,同源性达到100%;H-2与Enterobacter homaechei 83的关系最亲近,其相似性达到99%。查阅大量文献发现,这两种菌株产氢特性尚未有报道。
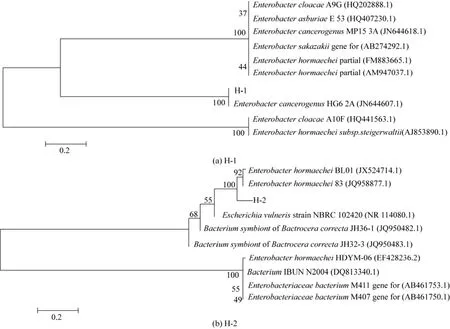
图2 基于16S rDNA序列的菌株的系统发育树
2.3氢气产量
图3显示了H-1和H-2菌的单独与混合发酵过程氢气积累量的变化。由图3可知,第1、2组(即H-1和H-2单独发酵)的起始阶段,H-1菌产氢速率较H-2菌快,发酵至25h时氢气产量不再增加,之后维持在119mL的水平不再变化;与H-1菌不同,H-2菌暗发酵初始阶段有显著的发酵迟滞期,发酵至60h后氢产量才有显著的提高,发酵至第100h时氢气量不再增加,说明发酵过程结束,发酵结束后的氢气量为187mL,与H-1菌相比,H-2菌的氢产量高68mL,占H-1菌总产氢量的57.1%,这说明H-2菌产氢能力比H-1菌高。
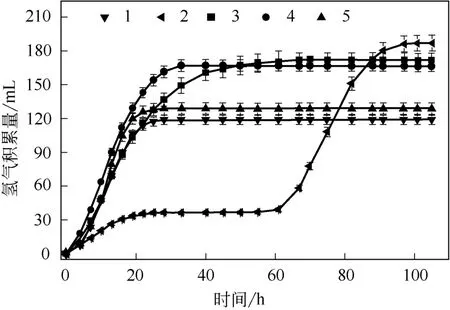
图3 H-1和H-2菌的产氢积累曲线
图3同时显示了H-1和H-2菌混合发酵的氢产量的变化,结果表明,第3、4、5组(H-1与H-2混合发酵)的产氢速率和氢产量均高于第1组(H-1菌单独发酵),第3、4、5组的氢产量分别为172mL、167mL和129mL,对应的发酵时间为67h、33h和28h。尽管第3组(H-1与H-2比例为3∶1)的氢产量比第4组(H-1与H-2比例为1∶1)时高5mL,但其发酵时间比后者高一倍多。因此,从发酵时间和氢产量判断,H-1菌液与H-2菌液比例为1∶1时的发酵性能最佳,在1∶1条件下,混菌发酵的氢产量比单独H-1菌发酵提高了48mL,发酵时间略有延长,比单独H-2菌发酵降低了20mL,但发酵时间缩短了67h,这说明H-1和H-2以1∶1混合发酵时性能优于每株菌单独发酵性能。
表3显示了不同比例下产氢菌发酵实验结果,在菌比例为1∶1(第4组)时,氢气和VFA浓度分别为61.6%和4.0 g/L,均为5组中最高,尽管VFA浓度相对较高,但第4组最终pH值却高于其他组,这说明第4组发酵液的缓冲能力高于其他组,进一步说明H-1与H-2以1∶1的比例混合时,发酵性能最佳。
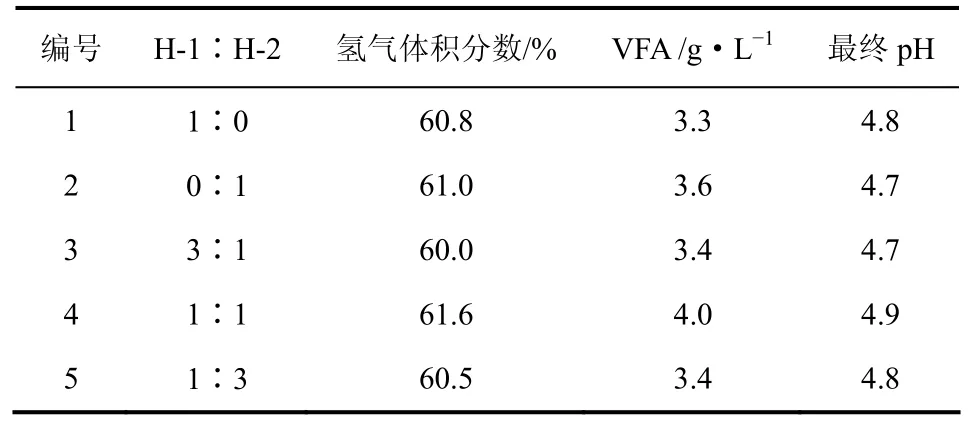
表3 两株产氢菌单独与混合发酵实验结果
由表4可知,H-1和H-2菌的氢产量分别为595mL/L和935mL/L,H-2菌产氢能力明显高于文献值。为了缩短发酵时间,将H-1与H-2菌按1∶1比例混合后,混合菌的产氢能力为861mL/L,比H-1菌单独发酵的产氢能力提高了44.7%,这说明混合菌发酵克服了单菌发酵的缺陷,提高了产氢性能。
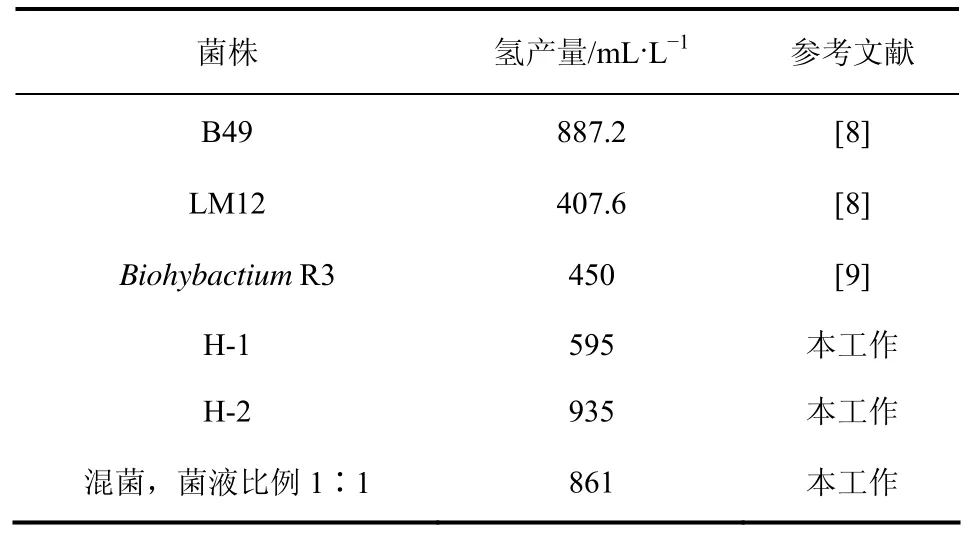
表4 筛选出的产氢菌产氢能力与文献值对比
2.4发酵液中VFA和乙醇浓度
两株菌发酵过程中VFA的变化如图4所示。除第2组(H-2单独发酵)外,其他组别的VFA在发酵的初始阶段均迅速升高,发酵至20h后,VFA积累量均在3.0 g/L以上,随后发酵液中VFA增加量明显减少,其中,第4组的VFA在发酵结束后VFA浓度达到4.0 g/L。而第2组的VFA呈现先迅速增加至1.8 g/L后缓慢降低,第60h后又迅速增加,最后维持在3.6 g/L左右,这说明H-2产氢菌对有机质的降解速率比较慢。
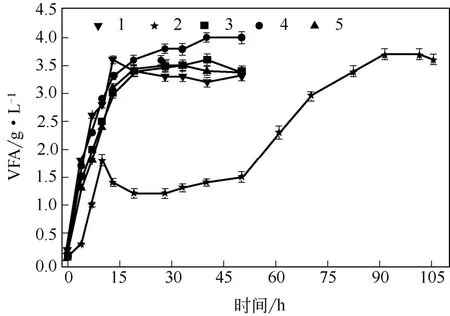
图4 两株菌发酵过程中VFA的变化
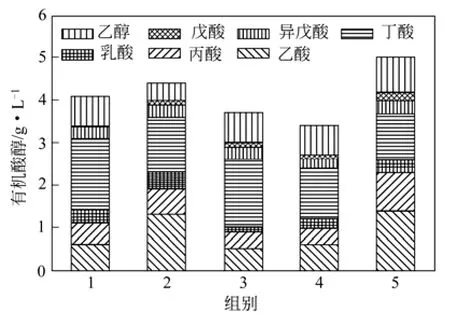
图5 发酵液中VFA和乙醇含量
发酵结束后发酵液中的VFA主要为乙酸和丁酸,如图5所示,同时含有少量的丙酸、乳酸、异戊酸和戊酸,值得注意的是,在每组的发酵液中均有一定量的乙醇存在,虽然所产气体主要成分为H2和CO2,但乙醇和乙酸的含量并不符合乙醇型发酵的要求[10]。因此,该两株菌的发酵类型为丁酸型发酵。
结合图3和图4可知,较快的VFA生成可以促进氢气的快速生成,发酵时间相对较短(第1、3、4、5组),而较慢VFA生成速率会导致较低的产氢速率(第2组)。H-2产氢菌单独发酵时,VFA生成速率较低,限制了氢气的生成,这说明产酸阶段是H-2菌产氢过程的限速步骤。而H-1菌单独发酵时,产氢曲线无较长的停滞期,说明H-1菌的产酸速率高于产氢速率。将两株菌混合发酵时,产氢速率得到了一定程度的提高,可能是由于发酵初始阶段H-1菌产生的过量VFA同时被H-2菌转化成氢气的原因;同时H-2菌对VFA的利用,减缓了体系VFA的积累速度,维持了系统的稳定性。因此,混合菌发酵性能提高是两株菌协同作用的结果。
3 结论
通过生物形态学观察和分子生物学鉴定,从碱处理后活性污泥分离出的两株产氢菌均为杆状细菌,种属为Enterobacter,其中,H-1种属为Enterobacter cancerogeous HG6 2A,H-2与Enterobacter homaechei 83的关系最亲近。单独产氢发酵时,H-1和H-2菌的发酵时间和氢产量分别为25 h、100 h和595mL/L、935mL/L,H-1菌产氢速率明显高于H-2,但H-2菌的氢产量比H-1菌高57.1%。混合发酵实验表明,将H-1和H-2菌混合发酵能够克服单菌发酵时的缺陷,显著提高了产氢速率和缩短发酵时间,两株菌的协同作用是混菌发酵性能提高的原因。
参考文献
[1]ZHANG J N,LI Y H,ZHENG H Q,et al. Direct degradation of cellulosic biomass to bio-hydrogen from a newly isolated strain Clostridium sartagoforme FZ11[J]. Bioresource Technology,2015,192:60–67.
[2]SUN L,HUANG A,GU W,et al. Hydrogen production by Enterobacter cloacae isolated from sugar refinery sludge[J]. International Journal of Hydrogen Energy,2015,40:1402-1407.
[3]KUMAR P,PATEL S K S,LEE J K,et al. Extending the limits of Bacillus for novel biotechnological applications[J]. Biotechnology Advances,2013,31:1543–1561.
[4]TRCHOUNIAN K,SARGSYAN H,TRCHOUNIAN A. H2production by Escherichia coli batch cultures during utilization of acetate and mixture of glycerol and acetate[J]. International Journal of Hydrogen Energy,2015,40:12187 -12192.
[5]张晓,何晓锐,庞园涛,等. 1株分离于铀矿的可利用玉米秸秆高效产氢的芽孢杆菌[J]. 食品与发酵工业,2015,41(3):39-45.
[6]WANG Z B,SHAO S P,ZHANG C S,et al. Pretreatment of vinegar residue and anaerobic sludge for enhanced hydrogen and methane production in the two-stage anaerobic system[J]. International Journal of Hydrogen Energy,2015,40:4494-4501.
[7]沈萍,范秀容,李广武,等. 微生物学实验[M]. 北京:高等教育出版社,1999.
[8]任南琪,林明,马汐平,等. 厌氧高效产氢细菌的筛选及其耐酸性研究[J]. 太阳能学报,2003,24(1):80-84.
[9]王东阳,李永峰,任南琪,等. 新型产氢细菌Biohybactium R3利用乳糖进行发酵产氢的实验研究[J]. 现代化工,2008,10(2):130-132.
[10]陈红. B.R3菌株生物制氢系统发酵条件与化学增强技术研究[D].哈尔滨:东北林业大学,2013.
综述与专论
Screening,identification of hydrogenogen and the research of its fermentation performance
ZHANG Cunsheng1,2,WANG Wenjuan1,WANG Zhenbin1,SHAO Shuping1,3,MA Haile1,
(1School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,Jiangsu,China;2Key Laboratory for Solid Waste Management and Environment Safety(Tsinghua University),Ministry of Eduction of China,Beijing 100084,China;3Tsingtao Brewery Co., Ltd., Qingdao 266100,Shandong,China)
Abstract:In order to obtain high performance hydrogen-producing bacteria,two strains (H-1 and H-2) were screened from activated sludge which was pretreated by alkali. Biological identification showed that the two strains were of Enterobacter species. H-1 was Enterobacter cancerogeous HG6 2A species and H-2 had the closest relationship with Enterobacter homaechei 83. Results showed that the best performance could be achieved from co-fermentation at the ratio of 1∶1 (H-1∶H-2). The corresponding fermentation time and hydrogen yield were 33h and 861mL/L,respectively. The defects of lower hydrogen yield by H-1 and longer fermentation time by H-2 were overcome by co-fermentation. The main volatile fatty acids (VFA) in the broth were acetate and butyrate,indicating that the fermentation of the two strains were both butyrate type. Due to the synergistic effect of the two strains,the accumulation rate of VFA reduced at the initial of fermentation. As a result,the stability of the system was enhanced.
Key words:hydrogenogen; 16S rDNA; hydrogen production; fermentation; synergistic effect
中图分类号:X 712;TK 91
文献标志码:A
文章编号:1000–6613(2016)04–1184–06
DOI:10.16085/j.issn.1000-6613.2016.04.035
收稿日期:2015- 09-06; 修改稿日期:2015-11-02。
基金项目:中国博士后科学基金(2014M561589)、江苏省自然科学基金青年基金项目(BK20150487)、中联环SWMES教育部重点实验室开放基金(SWMES 2015-11)及江苏高校优势学科建设工程项目。
