酒精发酵中杀菌剂的研究进展
2016-05-17张强长春理工大学生命科学技术学院吉林长春130022
张强(长春理工大学生命科学技术学院,吉林 长春 130022)
酒精发酵中杀菌剂的研究进展
张强
(长春理工大学生命科学技术学院,吉林 长春 130022)
摘要:酒精发酵是一个非常复杂的微生物反应过程。在这个过程中,除了生产菌外,还会从原料、空气、水等带入相当数量的杂菌,从而降低酒精得率,影响酒精的正常生产。因此如何有效控制杂菌的感染,对整个酒精生产至关重要。本文综述了酒精发酵中杀菌剂的研究进展,主要介绍了酒精发酵过程中染菌的原因、危害、检测方法以及常见的污染杂菌,重点介绍了漂白粉、青霉素、克菌灵、酒花及植物提取物等杀菌剂的使用。指出减少酒精发酵中的杂菌污染,加强细菌抗药性的研究,寻找安全天然杀菌剂替代品是未来研究的关键。
关键词:杀菌剂;酒精;克菌灵;发酵
第一作者:张强(1969—),男,博士,副教授,主要从事生物质能源研究。E-mail corn11@126.com。
自从20世纪70年代石油危机爆发以来,燃料短缺以及日益恶化的环境问题,使燃料酒精作为可再生能源越来越受到人们的关注[1]。
酒精发酵是一个复杂的微生物反应过程,一般要求纯种培养。在酒精发酵过程中,除了生产菌外,还会从原料、空气、水等带入一定数量的杂菌,杂菌感染是影响酒精得率的主要因素。常见杂菌包括乙酸菌、乳酸菌、枯草芽孢菌等。少量杂菌不会对发酵过程产生明显的影响,但是杂菌如果大量繁殖,就会给酒精生产带来严重危害。杂菌的扩繁可造成可发酵糖减少,其代谢产物会影响酵母菌的数量、质量以及酶的活力。可以说杂菌污染轻者影响酒精产量和质量,重者导致倒罐,甚至停产。因此,如何有效控制生产中杂菌污染是酒精发酵工业的重点工作之一,对于提高酒精企业生产的稳定性以及经济效益至关重要[2-3]。
本文主要介绍了酒精发酵过程中染菌的原因、危害、检测方法以及常见的污染杂菌,重点对漂白粉、青霉素、克菌灵、酒花及植物提取物等杀菌剂的使用进行概述。
1 酒精发酵过程中染菌原因
一般来讲,在采用玉米等粮食作物为原材料进行酒精发酵的过程中,都需要经过原料处理、添加酶制剂及营养物等过程,而在此过程中,很有可能会出现杂菌污染,主要来自以下几个方面[4]。
1.1原辅料污染
淀粉质原料发酵生产酒精,必须经过液化糖化步骤,由于糖化酶不能耐受较高温度,因此不能采用湿热灭菌来处理发酵液,从而使原料带来大量杂菌。目前酒精生产企业普遍采用中低温蒸煮,蒸煮的温度不能彻底杀灭自身所带来的杂菌,也导致了耐温杂菌的存在。另外采用淀粉质原料时,原料处理过程需添加一定数量的淀粉酶、糖化酶以及部分蛋白酶,这些辅料在出厂后、运输、使用过程中会出现污染,镜检时可检出杆菌、球菌等。发酵过程中需添加的磷酸盐、硫酸铵、尿素等营养物质也会带来杂菌污染。
1.2水污染
酒精生产的许多工序需要用水,例如湿法粉碎、干法粉碎以及酵母菌扩培等。这些工艺水直接参与发酵过程,如果没有经过消毒处理,或是仅仅经过简单处理,也会带来大量的杂菌污染。
1.3空气污染
自然空气中含有灰尘颗粒、水蒸气和各种杂菌,每立方米约有五千至十万个微生物。酒母繁殖阶段,需通风培养,如果空气没有进行有效除菌处理,将会带来大量的杂菌污染。
1.4设备及管道污染
设备和管道应定期灭菌,破损应及时维修,否则会带来杂菌。另外生产设备或管路存在死角,灭菌时如果不彻底,也会导致发酵液染菌。
1.5清液回配污染
清液回配是酒精厂提高酒精糟液固定物含量,降低蒸发负荷并节约用水、节约能耗的有效手段。采用清液回配发酵,虽然回配清液温度较高,但仍有耐温杂菌生存,也会导致发酵过程杂菌污染。
1.6酒母污染
酿酒酵母也可能成为一个污染源。用于酒精发酵的酿酒酵母接种量约为10%。酒精企业一般先培养小酒母,后培养大酒母,即自然培养法培养酵母,这个过程也可带来杂菌污染。
2 酒精发酵过程中染菌危害
随着发酵工业不断发展,发酵染菌率呈不断下降趋势,但仍有部分企业发酵染菌率居高不下。主要危害表现在以下几个方面[5]。
2.1竞争营养物质,导致酒精得率降低
酒精发酵中常见的杂菌乳酸菌和酵母菌有相似的营养需求。它们将争夺发酵醪中的营养物质,特别是碳源,使酒精得率降低。乙酸菌代谢所需碳源和能量主要来自酒精,随着代谢产物乙酸的不断积累,酒精会大量消耗,造成得率损失。
2.2改变生产环境,抑制酵母的生长繁殖
发酵过程中感染的乙酸菌是需氧菌,乳酸菌是厌氧菌,它们分泌乙酸、乳酸和其他副产物,导致pH值下降,挥发酸升高。由于H+浓度能改变原生质膜胶体的电荷,而原生质膜影响物质和离子通透性,所以酸度会改变酵母的存在环境,抑制酵母的生长繁殖[6]。
2.3杂菌会分泌多种有害物质,抑制或杀死酵母
细菌的代谢产物乳酸和乙酸对酵母有较强的抑制作用。发酵醪中乙酸质量分数达0.01%时,酵母的生命活动受到影响,0.2%时则全部被抑制。乳酸的抑制质量分数为1%~4%。另外乙酸和乳酸可协同抑制酵母的生长,这种协同作用所需的抑制浓度更低。丁酸的抑制浓度比乳酸和乙酸更明显,0.005%的丁酸就会抑制酵母的增殖[7]。另外,一定浓度的乳酸和乙酸也会对淀粉酶和糖化酶的活性起到抑制作用,造成发酵残糖升高,发酵不彻底。
3 酒精发酵杂菌判定
酒精发酵是否感染杂菌可通过两种方法进行判定[8]。一是通过镜检,酵母通常为圆形或卵圆形,而细菌一般较小,呈现圆形和细长形两种。当酒精发酵染菌时,从显微镜中可明显看出所染杂菌类型及数量,由此可以推断染菌的程度。二是通过测定发酵醪液的挥发酸,判断染菌程度。酒精发酵通常感染的是乙酸菌和乳酸菌等,它们代谢会产生一些易挥发的有机酸,因此测定挥发酸的高低是检验杂菌感染的重要指标。未感染杂菌时挥发酸一般在0.012% 以下。通常将两种方法结合起来使用,效果会更好。
4 常见的污染杂菌
自然界有许多微生物能进行酒精发酵,但是真正得到广泛应用的是酿酒酵母。利用酿酒酵母发酵生产酒精是目前最经济的方法。酒精发酵属于开放式发酵,在发酵液中还存在一定数量的其他微生物,危害酒精的生产,这些微生物称为杂菌[9-10]。常见的杂菌主要有两大类:细菌和野生酵母。①细菌对酒精发酵危害最大,革兰氏阳性细菌包括乳酸菌及丁酸菌等。革兰氏阴性细菌包括乙酸菌及大肠杆菌等。②野生酵母主要包括假丝酵母和嗜杀酵母。
4.1乳酸菌
乳酸菌是能使糖类生成乳酸的一类细菌的总称,形状为杆菌或球菌,它们有着复杂的营养需求。由于繁殖速率高且可以耐较低pH值环境,是每个酒精厂实际存在的最棘手的一类污染菌。NARENDRANATH等[11]指出,乳酸菌污染水平达到106CFU/mL(CFU为菌落形成单位)时,将使正常浓度的小麦醪液酒精产量减少近2%,较严重的污染(109CFU/mL)将有更明显的影响,可导致酒精产量降低3.8%~7.6% 。
乳酸菌的糖类代谢途径是严格的厌氧发酵,按发酵类型可分为3类:专性同型发酵、兼性异型发酵和专性异型发酵[12],代表菌株见表1。在专性同型发酵中,乳酸是己糖代谢的主要终产物,几乎全部通过糖酵解途径将一分子己糖发酵成两分子乳酸,这种类型的乳酸菌含有果糖二磷酸醛缩酶,但没有磷酸戊糖异构酶,所以不能发酵戊糖和葡萄酸盐。专性异型发酵的乳酸菌能够利用磷酸甘油醛或磷酸戊糖异构酶途径发酵糖产生几种终产物的混合物,这些终产物包括乳酸、乙酸、酒精和二氧化碳及少量的甲酸和丁二酸,见图1。乳酸菌对发酵的主要影响是产生和分泌对酵母有抑制作用的化合物,随着有机酸的不断积累,将严重地威胁酵母的生存。
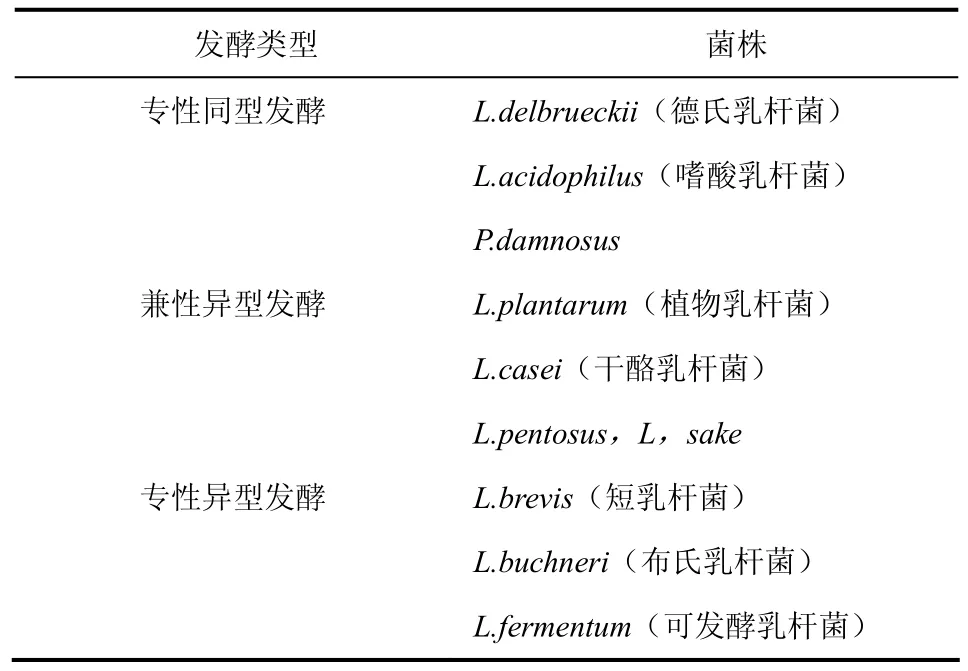
表1 乳酸菌发酵类型及代表菌株
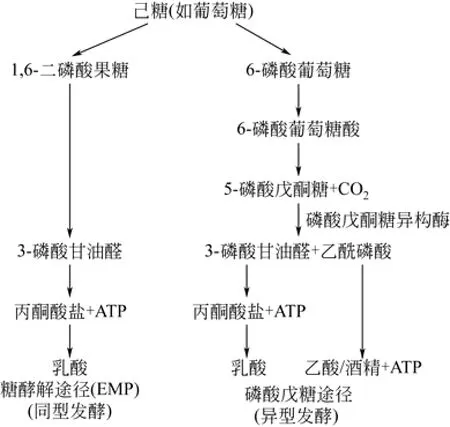
图1 乳酸菌己糖发酵的主要途径
4.2乙酸菌
乙酸菌是一种好氧菌,能将发酵液中的糖类等营养物质吸收利用,产生大量的乙酸,是酒精生产中害处最大的一种细菌[13]。如果发酵过程中发生乙酸菌污染,乙酸菌可将已生成的酒精氧化成乙醛、乙酸,进而氧化为水和二氧化碳。当发酵液中乙酸质量分数达0.01%时,酵母菌的生命活动即受影响;当乙酸质量分数达0.2%时,酵母菌就完全受到抑制。该菌可耐10%~11%的酒精。
酵母菌扩培罐和醪液罐最容易受乙酸菌污染。在扩培罐中,通风和强搅拌虽然可促进酵母生长和增殖,但也为乙酸菌的繁殖提供了适宜的生存环境,在扩培系统染菌逐步加重。实际上扩培罐中并不是真正的有氧环境,特别是在使用发酵醪时,其中溶解氧含量低,不过乙酸菌可以在罐顶部生长,该处流动溅起的醪液能为乙酸菌创造一个适宜的生存环境[14]。另外,在厌氧条件下,酵母产生的酒精也是乙酸菌的优良营养物。乙酸菌可以通过呼吸作用直接氧化糖和酒精生成能量,在含有酒精的发酵罐中更容易出现乙酸菌污染的问题。如果醪液和发酵罐顶部有充足的氧气,这些细菌将大量繁殖并把酒精转化为乙酸和其他产品。乙酸菌糖代谢途径有多种,磷酸己糖旁路(HMP)和三羧酸循环(TCA)是其中占优势的代谢途径,代谢主产物是乙酸,所需能量来自酒精、甘油和乳酸盐,主要取决于可利用的碳源。
4.3丁酸菌
丁酸菌属芽胞菌,多数为嫌气性,具有固定游离氮的能力,生长温度30~40℃。丁酸菌对酸抵抗性弱,pH值小于4.9时,就不再生长繁殖。发酵过程中一旦感染该菌,危害相当大,因为丁酸菌能将糖份转化为丁酸,丁酸具有较强的抑制酵母菌繁殖能力。当醪液中丁酸质量分数达0.005%时,酵母的增殖即受到抑制,其抑制酵母的能力是乙酸的20倍。因此,丁酸菌不仅造成酒精发酵过程糖分损失,还会严重抑制酵母的增殖和代谢,迫使发酵过程停止。
5 酒精发酵常用的杀菌剂
选择合适的杀菌剂是控制杂菌最有效方法和最关键的环节。目前生产中采用的杀菌剂有漂白粉、青霉素、克菌灵、酒花及植物提取物等。
5.1漂白粉
漂白粉作为消毒剂已经广泛应用在自来水中。它由氯气和热石灰反应所得,消毒作用是因为次氯酸钙在水中产生次氯酸的结果。次氯酸和次氯酸根能够穿过细菌的细胞壁进入细菌内部,在氯离子的氧化作用下,细菌内的某些酶系统受到破坏,导致细菌死亡。
陈世忠等[15]在酒母醪中添加漂白粉进行杀菌,酒母醪中挥发酸都在0.09mg/mL 以下。发酵醪中添加漂白粉杀菌,前期挥发酸从0.13~0.15mg/mL 降到0.11mg/mL 以下,杂菌从5~6个杆菌、4个球菌降至3~4个杆菌、2个球菌。发酵期的酒分、酵母数都很正常。
史淑芝等[16]采用不同杀菌剂对能源甜菜酒精发酵进行了研究,发现漂白粉时虽然使酒精发酵过程中pH值下降幅度较小,但它的酒精转化率较低,可能由于漂白粉对酵母具有一定的伤害作用,致使最终酒精得率降低。
漂白粉常用于发酵设备,例如发酵罐及管道的消毒。漂白粉使用时一般先配成质量分数为1%~2%的溶液,然后再加到糖化醪或发酵醪中。漂白粉有效氯含量一般为25%~35%。加量为0.5~2.0 mg/mL,这是国家的标准用量,使用中不得超标。
5.2青霉素
酒精工业生产一般通过添加抗生素以控制杂菌污染。据报道,使用青霉素己有150年以上的历史。青霉素由于分子中含有4 个原子构成的β-内酰胺结构(图2),故统称为β-内酰胺抗生素。青霉素是利用青霉菌进行培养,从其培养液中获得的一种有机酸,一般用其钾盐或钠盐,主要用于抑制革兰氏阳性细菌的感染。
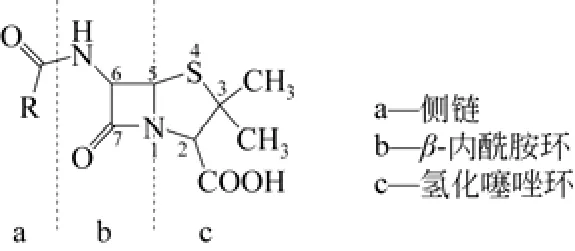
图2 青霉素结构
革兰氏阳性细菌细胞壁主要由黏肽构成。黏肽的前体物质通过相互交连形成网状结构,而这种交连作用需要在转肽酶的作用下才能完成。由于青霉素与黏肽的前体物质互相竞争转肽酶,导致黏肽合成受阻,细胞壁缺损,失去保护作用,从而导致细菌死亡。因此,青霉素对酒精发酵有害的细菌,例如乳酸菌、乙酸菌、丁酸菌等有明显的抑制作用,但这种抑制作用主要发生在细菌的繁殖旺盛期,而对静止状态下的细菌则作用较弱。酿酒酵母细胞壁主要由葡聚糖和苷露聚糖构成,因而青霉素对酵母没有影响。青霉素是目前酒精生产企业广泛应用的一种杀菌剂[17]。
利用抗生素抑制乳杆菌等杂菌,青霉素比氯四环素、杆菌肤、氯霉素和土霉素更有效,其用量介于0.75~2U/mL。HYNES等[18]认为在间歇发酵中青霉素的浓度一般要超过1.5mg/L才能抑制乳酸菌,因为青霉素不是一种耐酸的抗生素,在pH值为5以下会部分失活。
李继德[19]按0.6~1.2U/mL(醪液)的量把青霉素加入到发酵醪及酒母醪中,控酸效果非常明显,起到了较好的抑菌效果。环境条件好时少用,环境条件差时多用;冬季时少用,夏季时多用;原料经过高温蒸煮时少用,低温蒸煮时多用。另外青霉素的加入量应适当,过少不能达到灭菌效果,过多则会造成浪费。
范怀德[20]采用青霉素替代硫酸后,使用量为0.5~1 U/mL,可以有效地抑制杂菌污染,提高酒母质量,防止硫酸对人体的危害。此时酵母细胞的各项指标均符合工艺要求。酒母醪发酵正常,酸度降低,特别在夏季使用、效果更为明显。
范静等[21]在薯干酒精生产中添加青霉素,使用后可使酸度下降0.2,残糖下降0.15% ,外观糖度下降0.5 "BX,淀粉出酒率提高约2.7%。
然而人们发现,青霉素在酒精发酵使用过程中的滥用已引发多抗性菌株的出现。细菌耐药性系指细菌对于抗菌药物作用的耐受性,耐药性一旦产生,药物的疗效作用就明显下降。当长期应用抗生素时,占多数的敏感菌株不断被杀灭,耐药菌株就大量繁殖,替代敏感菌株,使细菌对该种药物的耐药率不断升高,这已经引起了人们的关注。
孙振江等[22]研究了青霉素、安菌泰、莫能菌素3种杀菌剂在木薯酒精发酵中的杀菌效果。指出3种杀菌剂均能有效进行杀菌,最好在发酵初期添加,但杀菌剂添加量不能超过10mg/L,否则会对酵母产生抑制作用。发酵过程中将3种杀菌剂交替使用,从而避免使用一种杀菌剂产生抗药性的问题。
李力群等[23]在15L 发酵罐中进行玉米浓醪酒精发酵。采用链霉素1.4U/mL,土霉素0.7U/mL,青霉素0.9U/mL 组成的优化复合抗生素,抑菌效果明显,最终酒精度达到了17.2% ,挥发酸0.20mg/L。3种抗生素的联合使用,增强了抑菌的效果,避免了抗药性的问题。
青霉素是酒精生产中最常用的杀菌剂,另外还有链霉素和抗乳菌素。虽然链霉素和抗乳菌素也有较好的杀菌作用,但成本较高,一般酒精企业都不采用。
5.3克菌灵
克菌灵具有广谱高效的杀菌效果,是酒精生产中专用杀菌剂。它主要通过抑制细菌细胞壁合成和干扰蛋白质合成而达到抑菌作用,因此能够有效抑制或杀灭酒精生产过程中的乳酸菌、乙酸菌等常见杂菌,而对生产菌株没有任何的毒副作用。
于成等[24]在玉米酒精生产中发现,在前发酵期添加克菌灵较为合适,加人量为6mg/L时,抑制杂菌的效果较明显。发酵速度加快,杂菌减少,发酵酒度高。发酵周期可维持在55~60h。
张家伟等[25]研究发现,克菌灵对酒精发酵过程中常见的乳酸菌、乙酸菌等杂菌具有较好的抑制杀灭作用,杀菌率在85%以上。克菌灵无论是低浓度还是高浓度,对酿酒酵母没有任何毒副作用,其形态、出芽率、发酵活力均不受影响,而且能够促进酵母生长,增强发酵活力。
本文作者[26]曾经在玉米酒精生产中添加克菌灵进行实验,发现克菌灵可有效抑制杂菌生长。在发酵前期加入,最佳使用量为6mg/L,酸度可降低0.2,酒精度可提高0.4%(体积比),原料出酒率提高0.9%。另据蒋敬全[4]报道,一个以糖蜜为原料年产5 万吨酒精厂,以克菌灵完全替代浓硫酸抑制杂菌,可直接增加经济效益296万元。而以淀粉质为原料年产5万吨酒精厂,可增加经济效益214万元。
克菌灵在酒精生产中杀菌效果显著,且不会出现耐药性。另外可以改变传统以浓硫酸抑制杂菌的生产工艺,减少发酵过程中浓硫酸的用量及对发酵设备的腐蚀作用。目前克菌灵已在国内多家酒精企业应用,国外的巴西、泰国、越南也有使用克菌灵产品。
5.4酒花及植物提取物
药用植物具有显著的生理活性,广泛应用于抗菌等领域。随着绿色消费的兴起,药用植物的开发和利用越来越引起人们的关注。同时,由于抗生素的滥用,在众多方面已引起许多问题,如多抗性菌株的出现等,因此已产生了使用安全天然代替品的迫切要求[27]。
酒花,即啤酒花,是来源于欧洲和西亚的野生植物,它生长迅速,在很多气候温和的地区如中国、英国、澳大利亚和法国等都有生长。人们很早就认识到β-酒花酸能够增强抑菌效果。1993年,SIMPSON[28]研究了乳酸菌对酒花酸的敏感性,指出酒花酸起移动离子载体的作用,可以消除跨膜pH值梯度,抑制乳酸菌的生长。另外质子从胞外越过细胞膜进入细胞内,导致细胞内外pH值差异,使细胞对糖的吸收受到抑制,乳酸或乙酸等代谢物不能够分泌。
2002年BetaTec与Hohenheim大学合作,采用全水相工艺从酒花的CO2萃取物中得到了两种可用于酒精工业的酒花天然抗菌剂Iso StabTM和Lacto StabTM。它们含有酒花酸,对酒精发酵过程中的杂菌具有良好的抗性。通过在一个1.9亿升玉米燃料酒精生产企业实践证明,在抑制浓度下,抗菌剂Iso StabTM被连续加入到600m3种子罐,前10h添加Iso StabTM,后14h不添加。采取这种方法试验进行了14天。4天后发现乳酸和乙酸的浓度明显降低,8天后乳酸和乙酸几乎消失[29]。这两种抗菌剂已经被美国和加拿大的酒精生产企业所采用,目前可在国际市场上购买到。
郑进保[30]对大量药用植物提取物在酒精发酵中的抑菌作用进行了系统研究,发现乌梅、麻黄、地榆、黄连、石榴皮、山茱英等提取物均能不同程度地抑制乳酸菌的生长。0.05g/mL的乌梅提取物可促进酿酒酵母的生长,却抑制乳酸菌的生长。0.01g/mL黄连提取物能够强烈抑制乳酸菌的生长,而对酿酒酵母基本不起抑制作用;发酵过程中添加0.05g/mL的乌梅提取物可使乳酸菌由6×107CFU/mL降低到1.0×104CFU/mL,而酒精产量可提高1.45mg/mL。
鉴于药用植物独特的抗菌活性,作为安全天然代替品已经引起了人们极大的关注[31]。
6 结语
解决酒精发酵工业中的染菌问题,应当“防重于治”,只有严防才能消除或减少杂菌的污染。防止染菌应严格工艺管理、防止空气带菌、培养基应彻底灭菌、合理消除管路、死角带菌等,另外要抓好菌种、原料和水的处理以及环境卫生,从根本上切断污染源。如果能有效防治杂菌感染,不仅能提高酒精得率,节省大量的人力物力,而且能避免由于染菌而造成的经济损失。
防菌固然重要,但抑菌才是关键,如同一个问题的两个方面。目前抗生素是酒精企业广泛使用的杀菌剂。为了保持抗生素的有效性,应重视其合理使用。尽管理论上认为抗生素在蒸馏等处理后会分解而不残留在酒糟中,但大量证据显示,工业抗生素的滥用会污染地表水和地下水。巴西在酒精生产中使用抗生素控制细菌,现已从该甘蔗农业生态系统中分离出多抗性细菌。2005年底,欧盟内用于作为动物饲料的复合物,其发酵产物已经不允许有抗生素残留。随着在农业和技术领域应用抗生素而使病原菌产生多抗性的关注日益增长,应加强细菌抗药性的研究,寻找安全天然的杀菌剂替代品,在此基础上,防抑结合,标本兼治,才能促进酒精工业健康发展。
参考文献
[1]李振宇,李顶杰,黄格省,等. 燃料酒精发展现状及思考[J]. 化工进展,2013,32(7):1457-1467.
[2]张鑫蕊,李煦颖,马秋娟. 从专利角度分析国家政策对燃料乙醇产业的影响[J]. 化工进展,2013,32(12):3032-3036.
[3]余培,雷明科,郑璐. 离子液体1-乙基-3-甲基咪唑乙酸盐对酿酒酵母AY93161的毒性及其酒精发酵过程的影响[J]. 化工学报,2013,64(11):4175-4180.
[4]蒋敬全. 酒精专用杀菌技术和无酸发酵新技术[J]. 广西轻工业,2011(5):1-4.
[5]覃洁. 糖蜜酒糖蜜酒精发酵染菌的药物抑菌作用的探讨[J]. 甘蔗糖业,2002(5):37-38.
[6]张强,郭元,韩德明. 酿酒酵母乙醇耐受性的研究进展[J]. 化工进展,2014,33(1):187-192.
[7]李德光. 甘蔗糖蜜酒精发酵污染问题[J]. 保山师专学报,2009,19(6):26-29.
[8]尚红岩,张远平. 糖蜜酒精发酵杂菌感染防治实践经验体会[J]. 甘蔗糖业,2002(4):38-41.
[9]毕生雷,金洪波,郑世. 抑菌剂在产油酵母培养过程中的应用[J].食品与发酵科技,2015(1):31-36.
[10]刘辉,施清. 酿酒酵母在酒精发酵过程中耐受环境胁迫影响研究[J]. 酿酒科技,2015(9):57-60.
[11]NARENDRANATH N V,HYNES S H. Effects of lactobacilli on yeast-catalyzed ethanol fermentations[J]. Applied & Environmental Microbiology,1997,63(11):4158-63.
[12]贾树彪. 新编酒精工艺学[M]. 北京:化学工业出版社,2004.
[13]张毅军. 酒精发酵过程中的控制与管理[J]. 化工质量,2006(4):25-26.
[14]李志强,费本华,江泽慧. 发酵抑制物对葡萄糖发酵产乙醇的影响[J]. 化工进展,2015,34(s1):80-84.
[15]陈世忠,汤士娟. 漂白粉在酒精生产中的应用[J]. 酿酒科技,2000 (4):57-60.
[16]史淑芝,代脆红,程大友,等. .不同杀菌剂对能源甜菜酒精发酵的效果[J]. 中国农学通报,2006(1):53-55.
[17]王印召,吴正云. 不同抑菌剂对丢糟降解液无蒸煮乙醇发酵的影响研究[J]. 酿酒科技,2014(12):19-22.
[18]HYNES S H,KJARSGAARD D M,THOMAS K C,et al. Use of virginiamycin to control the growth of lactic acid bacteria during alcohol fermentation[J]. Journal of Industrial Microbiology & Biotechnology,1997,18:284-291.
[19]李继德. 青霉素在酒精发酵中应用[J]. 酿酒科技,2001(4):49-51.
[20]范怀德. 青霉素在酒精酒母生产中的应用研究[J]. 西北民族学院学报(自然科学版),1999,20(2):29-31.
[21]范静,王列岗,张福明. 青霉素在酒精生产中的应用研究[J]. 杭州食品科技,1993(4):24-26.
[22]孙振江,崔师泰,张倩勉. 三种杀菌剂在木薯酒精发酵过程中的应用[J]. 轻工科技,2013(7):1-3.
[23]李力群,陈英伟,李志辉. 玉米酒精浓醪发酵中复合抗生素抑菌的实验研究[J]. 吉林化工学院学报,2011(3):24-27.
[24]于成,董薇薇.试析克菌灵在玉米酒精生产中的应用[J]. 黑龙江科技信息,2014(22):22-24.
[25]张家伟. 克菌灵对酒精发酵常见杂菌抑制效果的研究[J]. 广西轻工业,2011(8):11-13.
[26]张强,陆军,侯霖. 克菌灵在玉米酒精生产中的应用研究[J]. 酿酒科技,2006(1):53-55.
[27]尹璐,胡仁火. 7种中草药醇提取物抑菌杀菌作用的研究[J]. 安徽农业科学,2014,42(28):9722-9724.
[28]SIMPSON W J. Ionophoric action of trans-isohumulone on Lactobacillus brevis[J]. J. Gen. Microbiol.,1993,139:1041-1045.
[29]RÜCKLE L,李宜海. 天然抗菌剂酒花酸在酒精发酵中的应用[J].广西轻工业,2006(1):1-13.
[30]郑进保. 药用植物提取物在控制酒精发酵染菌和抑制肠道有害菌中的初步研究[D]. 厦门:厦门大学,2008.
[31]魏少鹏,国政,姬志勤. 小檗内生放线菌H21的鉴定及抑菌活性成分分析[J]. 中国农业科学,2015,48(6):1095-1102.
Research progress on fungicides during ethanol fermentation
ZHANG Qiang
(School of Life Science and Technology,Changchun University of Science and Technology,Changchun 130022,Jilin,China )
Abstract:Ethanol fermentation is a complex microbial process. During the process,a significant number of bacteria will be brought in from raw materials,air,water,etc.,which will reduce yield of ethanol and affect production of ethanol. Therefore,how to effectively control the bacteria infection is essential for the ethanol production. Research progress on fungicides during ethanol fermentation was reviewed in this paper. The source,contamination,testing methods of the common harmful bacteria during ethanol fermentation were introduced focusing on the application of bleaching powder,penicillin,“kejunling” and hops and plant extracts. Reducing the bacteria infection during ethanol fermentation,strengthening the study of bacteria resistance and finding safe and natural alternatives to fungicides are the keys to future research.
Key words:fungicide;ethanol;kejunling;fermentation
中图分类号:TK 6
文献标志码:A
文章编号:1000–6613(2016)04–1167–06
DOI:10.16085/j.issn.1000-6613.2016.04.032
收稿日期:2015-08-31;修改稿日期:2015-10-25。
基金项目:吉林省教育厅科研项目(吉教科合字[2014]第34号)。
