中药复方提取物HNA-1对SIV慢性感染恒河猴胸腺输出及胸腺细胞发育的影响
2016-05-17王小妹陈滢宇张晓宇宁兴旺朱惠斌
王小妹,陈 颂,陈滢宇,胡 燕,张晓宇,宁兴旺,朱惠斌*
(1.湖南中医药大学第一附属医院医学检验中心,湖南长沙410007;2.广州中医药大学热带医学研究所,广东广州510405;3.湖南省第二人民医院手足外科,湖南长沙410007)
中药复方提取物HNA-1对SIV慢性感染恒河猴胸腺输出及胸腺细胞发育的影响
王小妹1,陈颂2,陈滢宇2,胡燕1,张晓宇3,宁兴旺1,朱惠斌*
(1.湖南中医药大学第一附属医院医学检验中心,湖南长沙410007;2.广州中医药大学热带医学研究所,广东广州510405;3.湖南省第二人民医院手足外科,湖南长沙410007)
〔摘要〕目的探讨中药复方提取物湘A-1号方(HNA-1,湖南省艾滋病防治小组推荐免费使用的两个中药复方之一的提取物)治疗HIV-1感染及艾滋病(Acquired Immune Deficiency Syndrome,AIDS)的疗效机制。方法用8只已感染猴免疫缺陷病毒SIVmac239 16~21个月的中国恒河猴,治疗组采用2个月的HNA-1治疗;对照组给予等体积生理盐水灌胃。在预设时间点采集外周血提取DNA,采用定量PCR检测T细胞受体重排删除环(T cell receptor excision circles, TRECs)来评价胸腺输出功能;并用酶消化法分离胸腺细胞,利用流式细胞术检测胸腺内CD34+前体细胞、CD4+T细胞发育各阶段的比例改变。结果与模型对照组比较,HNA-1治疗组胸腺细胞输出明显增加(P<0.05);且胸腺内CD34+Lin-细胞比例明显增加(P< 0.05),胸腺双阳性T细胞(Double positive,DP)Ⅱ阶段比例减少,而DPⅢ和DPⅣ阶段比例均增加。结论HNA-1对艾滋病的疗效可能与其能显著增加胸腺输出有关;其作用机制可能涉及增加胸腺内前体细胞数量、以及促进胸腺细胞细胞从DPⅡ阶段发育至DPⅢ等。
〔关键词〕湘A-号方;CD4+T细胞;胸腺输出;胸腺细胞发育
艾滋病毒和宿主免疫系统的相互作用是艾滋病发病的关键因素。CD4+T是机体T细胞的重要功能群体,在机体的适应性免疫应答中发挥了关键作用,是HIV攻击的主要靶细胞[1-2]。CD4+T淋巴细胞数量的进行性减少和CD4+T淋巴细胞功能的受损是免疫系统损害的重要表现,是HIV感染进展的标志[2]。
湘A-1号方(HNA-1,湖南省艾滋病防治小组推荐免费使用的两个中药复方之一的提取物)是治疗艾滋病的有效方剂。本课题组在前期研究中发现HNA-1具有促进免疫重建的疗效,且研究中未发现毒、副作用[3-4];能改善模型小鼠的免疫缺陷、提高其CD4+T细胞数量[5];能明显提高猴免疫缺陷病毒SIV-mac239感染猴模型的CD4+T细胞数(尤其是初始型CD4+T细胞)、改善淋巴结组织结构的病理退变,对猴免疫缺陷病毒感染导致的免疫系统破坏具有一定的保护作用,同时有降低动物死亡率的趋势[6]。本研究进一步利用流式细胞术和T细胞受体重排删除环(T cell receptor excision cirles, TRECs)检测的方法,探讨HNA-1治疗机制与初始型CD4+T细胞、胸腺输出及胸腺细胞发育的关系。
1材料
1.1动物、药物
1.1.1动物恒河猴8头,全部为雄性,体质量4.75~7.2 Kg,5~7岁,外观健康。经血清学检测猴免疫缺陷病毒(SIV)、猴逆转录D型病毒(SRV)、猴疱疹病毒(Herpes B virus)和猴T淋巴细胞I型病毒(STLV-I)抗体阴性,结核菌素阴性,痢疾菌阴性。动物由广东康达实验动物公司繁育并提供动物实验室,动物许可证证号为SCKX粤2009-0025,并参照美国《实验动物饲养和使用指南》的相应规范进行管理[7]。实验获湖南中医药大学伦理委员会审批。
1.1.2药物HNA-1组由白蔻仁6 g,茵陈15 g,石菖蒲10 g,黄芩10 g,连翘10 g,白花蛇舌草15 g,藿香10 g,虎杖15 g,滑石15 g,川木通6 g,薄荷6 g,薏苡仁30 g组成,由湖南中医药大学药学院制剂教研室制备,薄荷提取挥发油用β环糊精包裹,其余药物与提取后的薄荷水煎、醇沉,制备干膏粉。根据猴/人换算系数3.08估算临床等效剂量[8],得出干膏粉与β环糊精包含物的等效剂量分别为0.74 g/kg和5.74 mg/kg。配成水溶液混悬剂,使得每毫升混悬液含干膏粉0.185 g、β环糊精包含物1.44 mg(即5 kg猴灌胃20 mL)。
1.2试剂和仪器
1.2.1试剂DNA提取试剂盒(天跟有限公司), CD34-PE、CD4-FITC, Dispase II (Roche,终浓度1 mg/mL), Collagenase IV (Invitrogen,终浓度1 mg/mL)和DNase I (Roche,终浓度0.5 mg/mL), SIVmac239毒种由美国P.A. Marx教授惠赠。
1.2.2仪器流式仪(Beckman Coulter);RevertAid First Strand cDNA Synthesis Kit (Fermentas);Premix Ex Taq Version2.0、RNAisoTMPlus、SYBR Premix-ExTaq (TaKaRa);Real-time PCR探针(MBI公司);C1 000 TM Thermal cycler荧光定量PCR仪。
2方法
2.1动物分组感染
SIVmac239毒种5MID100(5个100%猴感染剂量),1 mL静脉注射。经用健康中国恒河猴外周血单核细胞体外扩增2代的病毒液,用CEMx174细胞滴定,病毒滴定为105TCID50/mm3。感染时病毒液用双蒸水1∶50稀释,静脉注入1 mL(即200TCID50)。本实验使用8头恒河猴感染SIV,为期16~21个月。8头恒河猴均为本课题其他实验的模型对照组,感染后未进行过任何药物干预,其中541为直肠感染,其余均使用静脉感染。直肠感染方法为:动物禁食40 h,经氯胺酮麻醉后,取膝胸卧位,清洁直肠后,以2.5 mm儿科胃管从肛门插入约8 cm,注入1 mL 含104TCID50SIVmac239的病毒液;并保持该体位20 min。静脉感染方法为经头静脉注射1 mL含200 TCID50的病毒液感染。
2.2分组治疗
根据CD4数量对8头恒河猴分层后,随机分为对照组和治疗组,每组4只。治疗组给予HNA-1灌胃治疗,每日1次;对照组给予等体积生理盐水灌胃。两组均给药2个月。见表1。
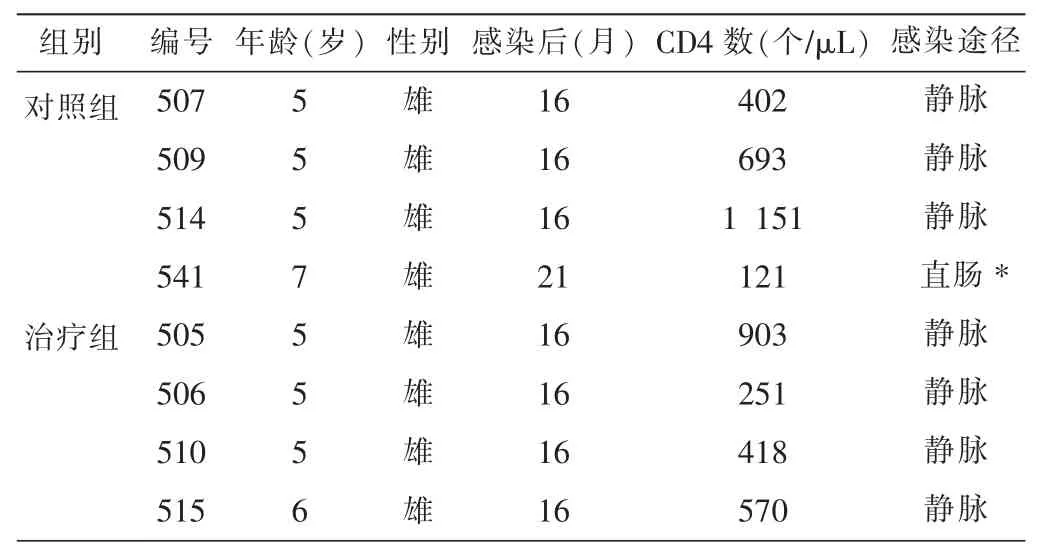
表1 动物感染情况及分组表
2.3 DNA的提取
在不同时间点收集对照组和治疗组恒河猴外周血单个核细胞,提取其DNA。DNA提取按照天跟试剂说明书操作。
2.4初始型CD4+T细胞的获得
处死对照组和HNA-1组的恒河猴,取出胸腺。胸腺细胞的分离采用酶消化法,所用酶为Dispase II、Collagenase IV、和DNase I,37℃消化50 min。离心洗去消化液,提取纯化的初始型CD4+T细胞。使用Real-time PCR进行检测,25 μL反应体系包括:10 μL细胞裂解产物(2.5×104),0.6μmol/L primers:(正向引物:5’-ATCACTCTGTGTCTAGCT CCCAGC-3’;反向引物:5’-ACTTGCTGAGTTTC ATGATGATT CCTCTA-3’)0.2 μmol/L Taqman探针;FAM-TGCG GG CTC CAT CCT CTC CTG T-TAMRA和ABI Master Mix。循环条件为:50℃,2 min; 95℃, 10 min; 40 cycles of 95℃, 15 s和60℃,1 min,40个循环。同时加入对ccr5基因检测作为细胞数量均一化的内参,扩增引物为:正向引物:5’-TTC TCT GGA ATC TTC TTC ATC C-3;反向引物:5’- CAA AGG TGA CTG TCC TGG CTT T-3;Taqman探针为:VIC-AAC ACA GCA TGG ACG ATA GCC AGG TAC C-TAMRA。
2.5指标检测
2.5.1 TRECs的检测参照Bains I的方法[10],使用T细胞受体重排删除环(T cell receptor excision cirles, TRECs)检测的方法,计算胸腺输出细胞在初始CD4+T细胞中占的比例。
2.5.2 Ki-67的检测取106-107待测单个胸腺细胞悬液,CD4分子染色洗涤后,每个流式管加入固定缓冲液100 μL,冰上避光孵育30 min,PBS液洗涤1遍,然后加入穿膜缓冲液300 μL,冰上避光孵育30 min,PBS液洗涤1遍,最后根据每管检测目的加入Ki-67-APC1 μL,轻轻混匀,置于冰上避光孵育30 min,然后用PBS液洗涤2遍,1 200 r/min离心8 min,弃去上清,用手指弹匀细胞,保证流式管剩余150~200 μL单细胞悬液,上流式细胞仪检测。
2.5.3 CD34+前体细胞的检测分离的胸腺细胞以磷酸盐缓冲液(PBS)洗涤后,1 200 r/min 10 min离心,弃掉上清液,加入适量鼠抗人CD14-FITC、CD3-FITC、CD20-FITC、CD34-PE荧光标记抗体5 μL,4℃避光孵育30 min,PBS洗涤2遍,4%多聚甲醛固定、洗去固定液并PBS重悬后,FACS检测,计算CD34+Lin-细胞的比例。
2.5.4胸腺细胞发育阶段的检测根据已有的文献[11],使用鼠抗人CD45RA(CD45的一种亚型),CD3 (SP34.2)将胸腺细胞(及发育成熟的T细胞)分为CD45RA-CD3dim(II期)、CD45RA-CD3+(III期)和CD45RA+CD3+(IV期)。再进一步用CD69,CD27分群进行检测分析。流式仪检测并统计分析胸腺细胞不同发育阶段的比例。
2.6统计学分析
3结果
3.1 TRECs的比例改变
TRECs统计分析结果显示,对照组经线性拟合后TRECs改变倍数明显呈下降趋势,其中3只动物降至接近治疗前的1/2。HNA-1治疗组在经过HNA-1治疗后,TRECs改变倍数总体呈明显的上升趋势。经重复测量分析,分析T值14.423,P<0.05显示两组间差异有统计学意义。同时,由于TRECs的比例会随着细胞分裂被逐渐稀释;因此增殖细胞减少可导致TRECs比例相对升高。而本研究同时显示CD4+T细胞表达Ki67+的比例并未增加,提示HNA-1治疗组TRECs比例的增高为胸腺细胞输出显著增加。如图1所示。
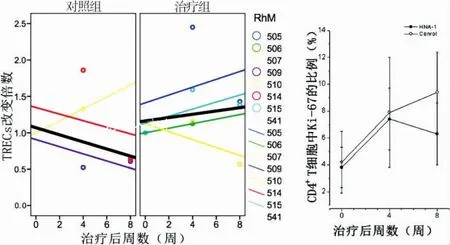
注:与对照组相比*P<0.05。图1 HNA-1治疗前、后TRECs(左)及Ki67(右)的改变
3.2胸腺CD34+Lin-细胞的比例
模型对照组和HNA-1组恒河猴胸腺内的细胞经流式检测,分析比较发现,HNA-1组CD34+Lin-细胞明显增加,提示SIV慢性感染后经HNA-1治疗,胸腺的前体细胞比例明显增加,分析T值10.699,P<0.01,有统计学意义。见图2。
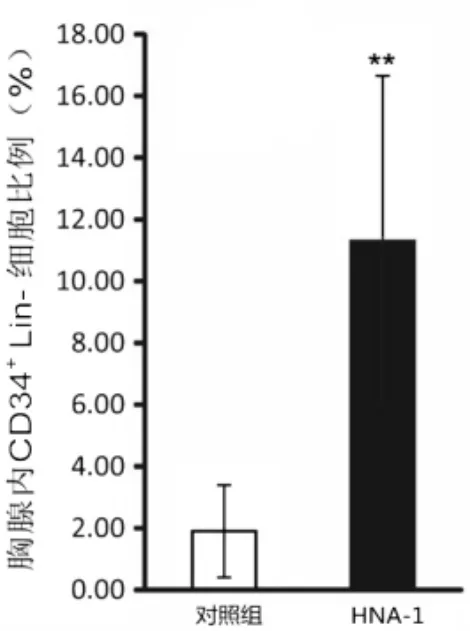
注:与对照组相比**P<0.01。图2 HNA-1治疗后胸腺CD34+Lin-细胞的比较柱形图
3.3不同发育阶段胸腺细胞的比例的改变
与模型对照组比较,HNA-1组双阳性T细胞(Double positive,DP)Ⅱ阶段的胸腺细胞比例减少,而DPⅢ和DPⅣ阶段的细胞比例均增加。这些研究结果提示,HNA-1治疗后可能促进了胸腺细胞从DPⅡ阶段发育至DPⅢ和DPⅣ阶段。见图3。

图3 HNA-1治疗后胸腺幼稚淋巴细胞不同发育阶段改变的柱形图
4讨论
在前期研究中,发现中药复方提取物HNA-1能有效增加外周血初始型CD4+T细胞的比例;但CD4+T细胞来源于骨髓还是胸腺并不清楚。在本研究中,首先使用TRECs检测的方法对胸腺输出功能进行了评价。TRECs在TCR重排的过程中产生,并在外周组织中的T细胞中稳定存在;它不参与细胞染色体DNA的复制,并随着细胞分裂被逐代稀释。本研究发现经HNA-1治疗SIV感染恒河猴后,外周血TRECs的比例明显增加,且随着HNA-1治疗的周数增加而更为显著;同时细胞增殖并未明显降低。这提示HNA-1能提升胸腺输出功能。
在AIDS发病和免疫重建的过程中,胸腺输出初始型CD4+T细胞起到了重要作用。在感染的前3个月左右[12-13],以及感染后期[14],胸腺输出初始型CD4+T细胞对于维持外周CD4+T细胞库的稳态起着主要作用。在高效抗逆转录病毒治疗法(highly active antiretroviral therapy, HAART)治疗晚期感染的患者,即使病毒载量被控制在低于检测水平,也常常由于初始型CD4+T细胞无法恢复而免疫重建失败。因此,我们发现HNA-1促进胸腺输出、提高外周血初始型CD4+T细胞比例,可能有重要的临床价值。
然而,如果HNA-1仅仅只是将未发育成熟的初始型CD4+T细胞动员至外周,有可能一时取得疗效,而无法取得持续的疗效。因此,本研究进一步对胸腺细胞发育的情况进行了分析。我们发现,HNA-1治疗后胸腺CD34+Lin-细胞的比例显著增加,这表明HNA-1治疗能提高骨髓的前体细胞进入胸腺。此外,我们还进一步发现,HNA-1治疗促进了胸腺细胞从DPⅡ阶段发育至DPⅢ和DPⅣ阶段。这就表明,HNA-1不仅仅只是将胸腺细胞动员至外周,而是提高前体细胞比例、促进胸腺细胞分化,是有可能实现持久的疗效的。然而,这还需要更进一步的试验结果证明。
总之,本研究发现,HNA-1治疗SIV感染的恒河猴后,通过提高胸腺输出初始型CD4+T细胞,从而起到维持CD4+T细胞数量、促进免疫重建的作用;且其机制与增高胸腺CD34+细胞的比例、以及促进CD4+T细胞发育密切相关。
参考文献:
[1] Mclean AR, Michie CA. In vivo estimates of division and death rates of human T lymphocytes [J]. Proc Natl Acad Sci USA. 1995,92(9):3 707-3 711.
[2]李太生.艾滋病的免疫发病机理和免疫重建[J].中华医学杂志,2001,81(5):310-313.
[3]卢芳国,朱惠斌,黄顺玲,等.湘A1号、2号对免疫缺陷模型小鼠T细胞亚群的影响[J].医学研究生学报,2009,22(8):804-806.
[4]朱惠斌,卢芳国,葛金文,等.湘艾1号、2号对免疫缺陷动物免疫保护作用的研究[J].中华中医药学刊,2011,29(4):804-807.
[5]朱惠斌,符春林,陈颂,等.中药复方提取物HNA-1治疗猴免疫缺陷病毒感染的实验研究[J].中华中医药杂志,2011,26(4):91-94.
[6]朱惠斌,陈颂,卢芳国,等. HNA-1对SIV感染猴外周初始型T淋巴细胞亚群的影响[J].中国医药,2011,6(3): 618-619.
[7] Washington DC. National Research Council, Guide for the Care and Use of Laboratory Animals (Eighth Edition) [M]. National Academy of Sciences, 2011:35.
[8]黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学. 2004,9(9):1 069-1 072.
[9] Chen S, Lai C, Wu X, et al. Variability of bio-clinical parameters in Chinese-origin Rhesus macaques infected with simian immunodeficiency virus: a nonhuman primate AIDS model [J]. PLoS One,2011, 6: e23177.
[10] Bains I, Thiébaut R, Yates AJ, et al. Quantifying thymic export: combining models of naive T cell proliferation and TCR excision circle dynamics gives an explicit measure of thymic output[J]. J Immunol,2009,183(7):4 329-4 336.
[11] Gurney KB, Uittenbogaart CH. Human Immunodeficiency Virus Persistence and Production in T -Cell Development [J]. Clin Vaccine Immunol,2006,13(11):1 237-1 245.
[12] Sempowski GD, Hicks CB, Eron JJ, et al. Na觙ve T cells are maintained in the periphery during the first 3 months of acute HIV -1 infection: implications for analysis of thymus function[J]. J Clin Immunol, 2005,25(5):462-472.
[13] Borghans JA, Hazenberg MD, Miedema F. Limited role for the thymus in SIV pathogenesis[J]. Eur J Immunol, 2005,35(1):42-45.
[14] Ribeiro RM, de Boer RJ. The contribution of the thymus to the recovery of peripheral naive T-cell numbers during antiretroviral treatment for HIV infection [J]. J Acquir Immune Defic Syndr, 2008,49(1):1-8.
(本文编辑杨瑛)
Effects of HNA-1 Extracted from a Chinese Medicine Compound on the Thymic Output and Thymocyte Development in Rhesus Macaques with SIV Chronic Infection
WANG Xiaomei1, CHEN Song2, CHEN Yingyu2, HU Yan1, ZHANG Xiaoyu3, NING Xingwang1, ZHU Huibin*
(1. The First Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 2. The Research Institute of Tropical Medicine of Guangzhou University of Chinese Medicine, Guangzhou, Guangdong 510403, China; 3. Department of Surgery, the second People's Hospital of Hunan Province, Changsha, Hunan 410007, China)
Abstract〔〕Objective To investigate the effect of Chinese herbal extract HNA-1 on HIV -1 infection and AIDS. Methods Eight Chinese rhesus macaques had been infected by SIVmac239 for 16 to 21 months were enrolled into this study, the treatment group received HNA -1, control group received normal saline for consecutively 2 months, respectively. In predesigned time-points, peripheral blood were drawn for DNA extraction, and thereby thymic output was evaluated by T-cell receptor excision circle (TRECs) quantification. The thymocyte cells were seperated by enzyme digestion, the proportions of CD34+cells and thymocytes in various development stages were analyzed by flow cytometry. Results Compared with control group, the thymic output function obviously was elevated in HNA-1 group (P<0.05). And the proportion of CD34+Lin-book=7,ebook=10cells was significantly increased (P <0.05). More interestingly, the thymocytes in double positive (DP) stage Ⅱdecreased dramatically, while thymocytes in stage DPⅢand stage DPⅣincreased. Conclusion Enhanced thymic output function may contribute to the effect of HNA-1 on AIDS treatment with underlying mechanisms involving increased thymic progenitor cells and promoted development of thymocytes from stage DPⅡto stage DPⅢ.
Keywords〔〕HNA-1; CD4+T cells; thymic output; thymocyte development
〔通讯作者〕*朱惠斌,女,教授,主任技师,E-mail:1587370309@qq.com。
〔作者简介〕王小妹,女,检验师,主要从事中药新药的研究与开发。
〔基金项目〕国家自然科学基金资助项目(81274169);湖南省高等学校科学研究重点项目(12A102);湖南省教育厅项目(13C688);湖南省高校科技创新团队“感染性疾病中医药防治研究”资助项目(NO:15)。
〔收稿日期〕2015-11-03
〔中图分类号〕R285.5
〔文献标识码〕A
〔文章编号〕
doi:10.3969/j.issn.1674-070X.2016.04.002
