大肠癌唾液蛋白指纹图谱分子诊断模型研究
2016-05-17贺佐梅黄飞娟周小青吴正治谢梦洲
贺佐梅,黄飞娟,周小青,吴正治,,4,5*,谢梦洲,2*
(1.湖南中医药大学中医诊断国家重点学科,湖南省2011数字中医药协同创新中心,湖南长沙410007;2.抗肿瘤中药创制技术湖南省工程研究中心,湖南长沙410007;3.广东医学院附属福田医院,广东深圳518033;4.深圳大学第一附属医院,广东深圳518035;5.深圳市老年医学研究所,广东深圳518020)
大肠癌唾液蛋白指纹图谱分子诊断模型研究
贺佐梅1,黄飞娟3,周小青1,吴正治1,3,4,5*,谢梦洲1,2*
(1.湖南中医药大学中医诊断国家重点学科,湖南省2011数字中医药协同创新中心,湖南长沙410007;2.抗肿瘤中药创制技术湖南省工程研究中心,湖南长沙410007;3.广东医学院附属福田医院,广东深圳518033;4.深圳大学第一附属医院,广东深圳518035;5.深圳市老年医学研究所,广东深圳518020)
〔摘要〕目的研究建立大肠癌(colorectal cancer,CRC))唾液蛋白质指纹图谱新型分子诊断模型。方法采集34例肠癌患者、45例健康志愿者(正常组)的唾液标本,用弱阳离子交换型(WCX)纳米磁珠联合基质辅助激光解析电离飞行时间质谱(matrix assisted laser desorption ionization time-of-flight mass spectrometry, MALDI-TOF MS)技术进行检测,获得各标本的蛋白指纹图谱。用Biomarker Wizard软件分析所获得的蛋白指纹图谱找出差异蛋白,再用Biomarker Patterns 5.0.2建立鉴别诊断模型。结果共检测到312个肠癌差异蛋白质峰,两组比值大于3(肠癌/正常对照>3,或者正常对照/肠癌>3),其中有37个差异蛋白质峰有统计学意义(P<0.05);其中有7个差异蛋白质峰肠癌组表达上调,28个差异蛋白质峰肠癌组表达下调,有35个差异蛋白质峰有显著差异(P<0.01)。筛选建立了由m/z为2 501.26、4 779.95、3 140.39的3个差异蛋白峰组成的肠癌与正常组的诊断模型,该模型的灵敏度和特异度分别为88%(30/34)和98 % (44/45);通过交叉验证法进一步验证诊断模型的可靠性,结果该模型的灵敏度和特异度分别为85% (29/34)和88% (37/45)。结论用WCX结合MALDI-TOF-MS技术建立的唾液蛋白诊断模型为肠癌的诊断提供了新途径。
〔关键词〕大肠癌;唾液;蛋白质组;分子诊断模型;蛋白指纹图谱;基质辅助激光解析电离飞行时间质谱
大肠癌(colorectal cancer,CRC)是世界范围内男性和女性第三个常见的癌症[1],是胃肠道常见的恶性肿瘤,以41-65岁发病率最高[2]。肠癌如果早期发现5年生存率可达90%,而有转移的进展期大肠癌其5年生存率低于10%[3]。
内窥镜检查仍然是大肠癌诊断的金标准,虽然内镜设备得到了一次次升级变革,从传统的全结肠电子内镜到放大内镜及染色内镜、窄带内镜(NBI)、自发荧光内镜(AFE)、共聚焦激光显微内镜(CEM)、超声内镜(EUS)、结肠胶囊内镜(CCE)[4]等各项先进技术在内镜中的应用,提高了分辨率,但仍然价格昂贵且对人体伤害较大,严重限制了大肠癌的早期诊断[5]。而新近发展起来的大肠癌肿瘤标志物检测,单项指标检测准确率低,多项指标联合检验虽可一定程度上提高检测的准确性,但结果的准确性(<70%)仍不能满足临床诊断肠癌需要,且血液检测亦为有创检测[6]。目前为止还没有一个快速、准确而又适合于大规模筛查的大肠癌早期诊断方法,因此,寻求一个简便、快速、准确率高的无创伤检查新方法势在必行。
因此,本研究选用大肠癌患者唾液标本,运用弱阳离子交换型(WCX)纳米磁珠芯片联合基质辅助激光解析离子化飞行时间质谱(matrix assisted laser desorption ionization time-of-flight mass spectrometry, MALDI-TOF MS)技术,拟从唾液蛋白质组学变化探索肠癌的分子基础并建立分子诊断模型。
1临床资料
1.1病例选择标准
1.1.1诊断标准大肠癌诊断标准:有明确的肠镜下活检病理和手术病理学确诊的大肠癌[7]。
健康人标准:经病史、查体、常规心电图、超声心动图、常规生化检查未发现相关疾病者[8]。
1.1.2纳入标准(1)符合诊断标准而且未经手术和放化疗;(2)年龄在20-75岁之间;(3)自愿且能够配合参加的受试对象。以上3项必须全部符合才能纳入。
1.1.3排除标准(1)不符合上述诊断标准者;(2)年龄<20或>75岁者;(3)患有口腔局部及唾液腺的炎症、消化道溃疡、肿瘤及先天性疾病;患有舍格伦综合征、囊性纤维病;患有其他系统严重并发疾病。1.1.4质量控制(1)釆用统一诊断标准、统一调查表格、统一调查方法;(2)调査者在调査时严格按照“标准化”执行,减少调查者偏倚,确保资料的一致性和真实性;(3)电子胃镜及病理结果均由1月内三级甲等医院诊断。
1.2病例来源
本研究共纳入2014年12月-2015年04月在湖南省肿瘤医院肠癌组患者34例,其中直肠癌20例,结肠癌13例,结直肠癌1例;男22例、女12例;年龄26~74岁,中位年龄58岁。正常对照组45 例,男28例、女17例;年龄23~72岁,中位年龄52岁,均来自于湖南中医药大学附属第一医院体检科健康自愿者。所有病例均按照纳入标准进行纳入。
2实验方法
2.1主要仪器和试剂
蛋白指纹图谱(液体芯片)试剂盒(WCX磁珠、Wash Buffer、Elution Buffer、U9裂解液)及MALDITOF-MS(蛋白指纹图谱仪I型),均为湖州赛尔迪生物医药科技有限公司产品,试剂盒批号为K20150501;dH2O(HPLC级)、CHCA为Sigma公司产品。
2.2样品收集与预处理
按照本课题专用临床观察表进行临床观察记录。取材前一天晚上临睡前清水漱口三次(不再进任何食物和药物),采用非刺激性唾液采集方式,第二天晨起漱口前空腹取材。由经过培训的课题组专人取材,前5 min内的唾液自然吞下后开始收集,患者将已经过消毒的无菌小圆柱形棉花含入口中,口腔唾液积聚至一定量后,将该棉花吐入置于冰浴中的15 mL唾液离心管内,4℃下静置1 h后,3 000 r/min、4℃下离心10 min,冰浴上分装在1 mLEP管中,每管200 μL,于-80℃冰箱冷冻保存。实验时取出样本,冰上解冻,所有检测唾液样本均一次冻融。取5 μL唾液加入10 μL U9裂解液,混合孵育30 min后,加入185 μL Wash Buffer稀释(唾液最终上样量为2.5 μL)。
2.3纳米磁珠预处理、上样和洗脱
(1)取WCX纳米磁珠50 μL加入到200 μLPCR管,置于磁铁上孵育1 min(注意避免由于孵育时间过长导致磁珠结块),去除上清液;(2)再依次加入100 μL Wash Buffer洗脱5 min,在磁铁上孵育1 min,去除上清液;再重复操作本项步骤一次;(3)向每个装有纳米磁珠的PCR管中加入100 μL处理好的唾液样品,混匀后,置于室温孵育30 min,将PCR管置于磁铁上孵育1 min,去除上清液;(4)每管加入100 μL Wash Buffer洗脱5 min,然后将PCR管置于磁铁上孵育1 min,去除上清液;再重复操作本项步骤一次;(5)在PCR管中加入10 μL E-lution Buffer洗脱5 min(不能少于5 min),将PCR管置于磁铁上孵育1 min,取5 μL上清液移至另一个PCR管中;(6)装有5 μL上清液的PCR管中加入5 μL CHCA(基质)饱和溶液,充分混匀(混合到样品颜色发灰,而没有明显的沉淀并及时上样),取2 μL混合溶液(1 μL唾液样品+1 μL基质)加样到Au/Steel芯片上,待干后放入仪器读取。
2.4芯片检测、数据采集和参数设置
采用MALDI-TOF MS读取芯片信息。设置激光强度为190,灵敏度为5,收集数据的质荷比(m/z)范围为2 000~25 000 m/z,优化范围为2 000 ~15 000 m/z,信号收集位置40~60,平均每点收集20次,收集总点为100次。已知多肽标准芯片标准(all-in-one),激光离子流0.5.用Ciphergen Proteinchip Software 3.2.1软件自动采集数据,纵坐标为峰强度(蛋白相对含量),横坐标为蛋白质质荷比(m/z)。
2.5数据分析
对位于2 000~25 000 m/z峰值,用Biomarker Wizard软件过滤噪音。设置初始的噪音过滤值为5,二次信噪比为2,以10%为最小阈值进行聚类,经上述数据预处理后,采用t检验比较2组唾液蛋白质质谱数据(由Biomarker Wizard软件完成),找出2组之间具有统计学意义的差异表达蛋白质峰。用Biomarker Pattern Software 5.0.2采用决策树算法计算出多个变量(m/z蛋白质质谱峰)变化对两样本的判别价值,确定最佳的筛选模型(即诊断模型)。
3结果
3.1数据分析及建立诊断模型
肠癌组、正常对照组两组共79份唾液标本,经过标准化后,在相对分子质量为2 000~25 000 m/z范围内共检测到312个蛋白质峰,两组比值大于3(肠癌/正常对照>3,或者正常对照/肠癌>3),其中有37个差异蛋白质峰有统计学意义(P<0.05,见表1),28个差异蛋白质峰表达下调(典型下调对比图谱,图1-A、图1-B),其中有7个差异蛋白质峰表达上调(典型上调对比图谱,图1-C),有35个差异蛋白质峰有显著差异(P<0.01)。
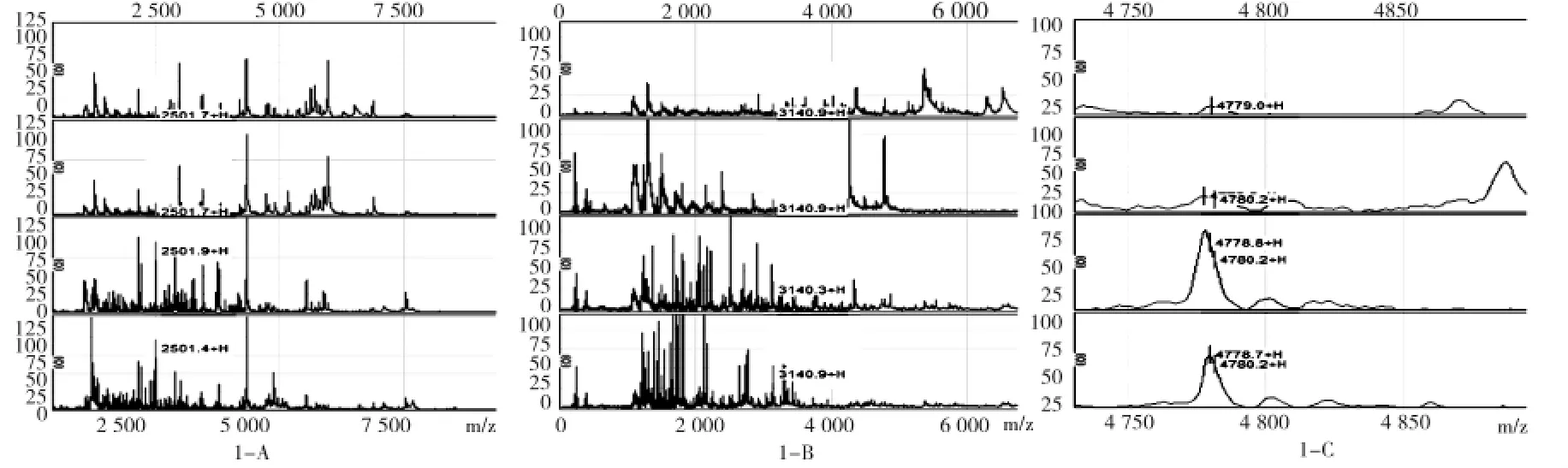
图1 -A:m/z为2501的峰,上第1、2幅图为肠癌组,下第3、4幅图为正常对照组。与正常对照组相比,肠癌组表达下调。纵坐标为峰强度(蛋白相对含量),横坐标为蛋白质质荷比(m/z)。图1 -B:m/z为3140的峰,上第1、2幅图为肠癌组,下第3、4幅图为正常对照组。与正常对照组相比,肠癌组表达下调。纵坐标为峰强度(蛋白相对含量),横坐标为蛋白质质荷比(m/z)。图1 -C:m/z为4779的峰,上第1、2幅图为正常对照组,下第3、4幅图为肠癌组。与正常对照组相比,肠癌组表达上调。纵坐标为峰强度(蛋白相对含量),横坐标为蛋白质质荷比(m/z)。图1 肠癌组与正常对照组MALDI质谱峰图
用Biomarker Pattern Software 5.0.2采用决策树算法计算出多个变量(m/z蛋白质质谱峰)变化对两样本的判别价值,确定最佳的筛选模型(图2),最终选定m/z为2 501.26、4 779.95、3 140.39建立大肠癌与正常对照组的判别模型,该模型的灵敏度和特异度分别为88%(30/34)和98%(44/45)(表2)。
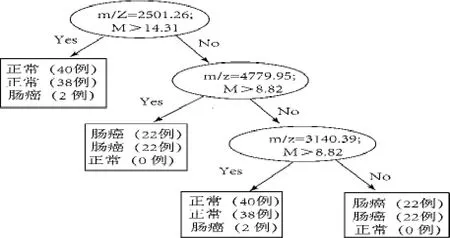
图2 2 501.26、4 779.95和3 140.39三个差异峰组成的诊断模型
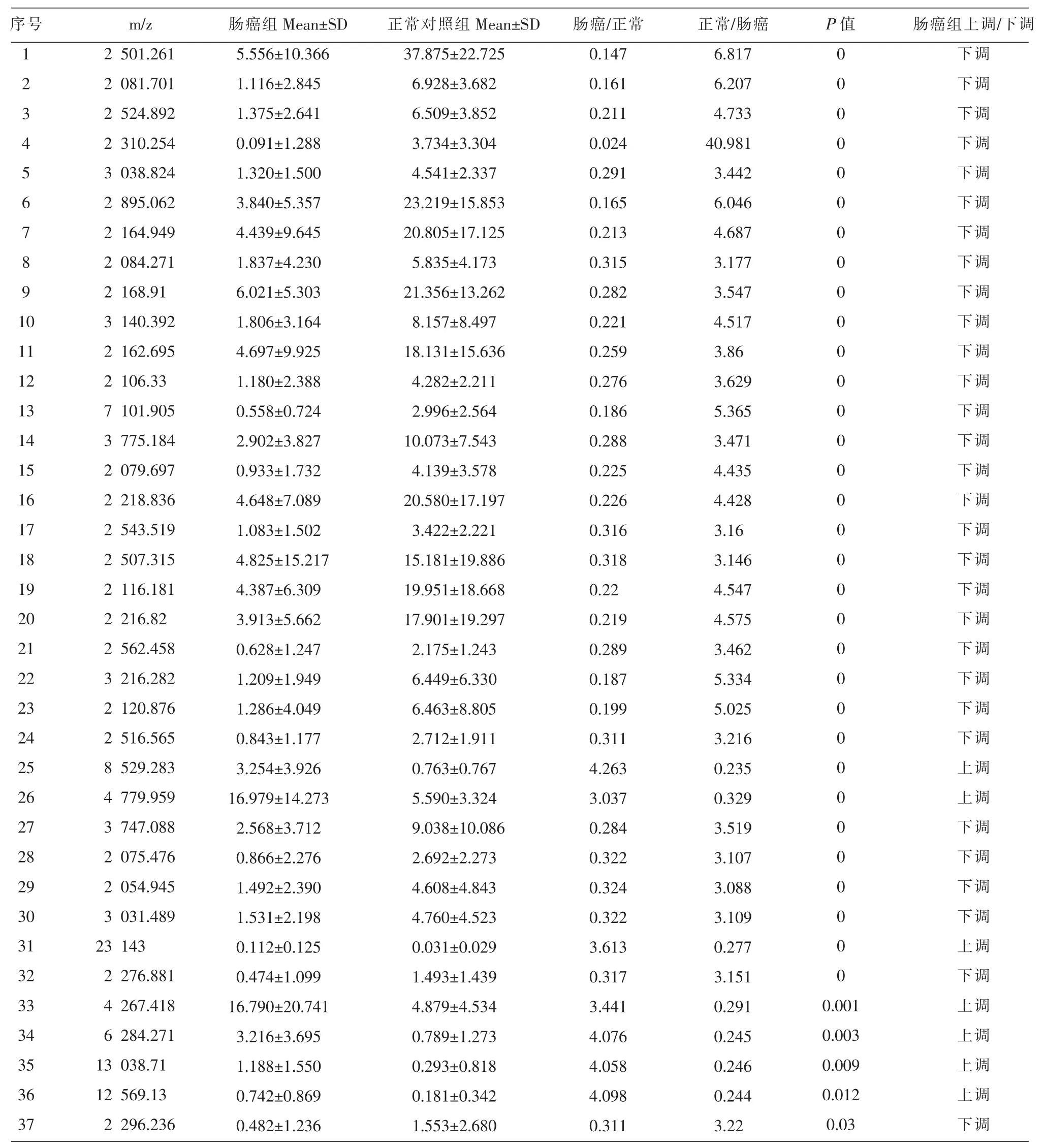
表1 肠癌组与正常组之间差异有统计学意义的蛋白质峰
当满足条件以下条件之一者:①2 501.26 m/ z≤14.31且4 779.95 m/z>8.82;②2 501.26 m/z≤14.31且4 779.95 m/z≤8.82、3 140.39 m/z≤3.09,提示为大肠癌标本;当满足条件以下条件之一者:①14.31且4 779.95 m/z≤8.82、3 140.39 m/z>3.09,提示为正常标本。M:质谱峰相对强度。

表2 所建诊断模型对肠癌的诊断效率(临床回顾检验结果)
3.2诊断模型十字交叉验证
对所建立的大肠癌诊断模型采用十字交叉法进行验证,结果该模型的灵敏度和特异度分别为85% (29/34)和88%(37/45)(表3)。十字交叉验证的ROC曲线值为0.958(图3-A、图3-B),进一步的分析验证了所建立模型的准确性。
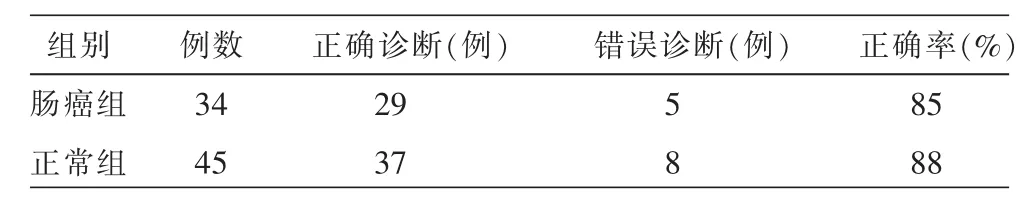
表3 所建诊断模型对肠癌的诊断效率(十字交叉验证结果)
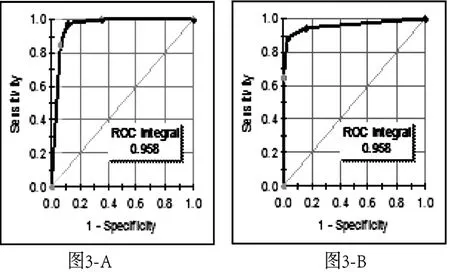
图3 -A,肠癌组十字交叉验证的敏感性、特异性及ROC曲线。横轴坐标为假阳性率(1-特异度),纵坐标为真阳性率(灵敏度)。图3 -B,正常对照组十字交叉验证的敏感性、特异性及ROC曲线。横轴坐标为假阳性率(1-特异度),纵坐标为真阳性率(灵敏度)。图3 肠癌组与正常对照组的鉴别诊断模型十字交叉验证的ROC曲线
4讨论
结直肠癌是常见肿瘤之一,肝脏是结直肠癌最常见、最易发生的转移器官[9],然而结直肠癌的早期诊断、与肠良性病变的鉴别以及判断是否发生转移尚缺乏有效手段。目前蛋白指纹图谱技术在肠癌的研究主要有:大肠癌与正常人的鉴别诊断、大肠癌无转移与大肠癌肝转移(同时性肝转移/异时性肝转移)的鉴别、大肠良性病变与大肠癌鉴别,以及大肠癌预后模型等。采用蛋白质组学技术进行大肠癌研究,各研究者均得到敏感性、特异性、准确性较高的分子诊断模型,然而,各研究者所筛选得到的差异蛋白质峰差异很大。大肠癌与正常对照组的差异蛋白对比研究,柳俊刚等[10 ]发现m/z为3 223.43、7 971.57、11 493.00;崔丹瑜等[11]发现m/z为5 909、5 341、2 685、2 811、3 928、6 635、8 933;林建军等[12]发现m/z为2 870.7、3 084.0、9 180.5、13 748.8;张巍等[13]发现为2 974、3 282、5 948、2 957、2 982、5 920、6 647、6 661;Liao CC等[14]发现1 800~16 000 Da范围内的73个峰;Xu W[15]发现15个差异蛋白(2 900~9 000 Da);周智勇等[16]发现26个下调蛋白、52个上调蛋白,范围在4 000 Da~1 110 Da。大肠癌无转移与肝转移的差异蛋白对比研究,柳俊刚等发现m/z为3 223.43、3 511.88、8 894.49;崔丹瑜等发现在肝转移组m/z为7 570、7 795、7 939、8 137、8 925、9 196、11 814、7 837低表达,而m/z为5 813蛋白点高表达。肠良性病变与大肠癌差异蛋白对比研究,Xu W等发现m/z为3 570、3 101、4 869在腺瘤组高表达,在大肠癌组低表达;张巍等发现m/z为3 016、66 172个蛋白点在两组比较中差异显著。李小琼等[17]对正常组、良性病变组以及(术前)组三者的差异蛋白研究发现7个差异点,m/z分别为4 955、5 325、5 890、6 615、7 739、8 109、8 575。于新哲等[18]发现,.结直肠癌无转移对比结直肠癌异时性肝转移组,得到0个差异蛋白峰,无统计学差异(P>0.05);结直肠癌异时性肝转移组对比同时性肝转移组,得到1个差异蛋白峰,m/z=4 355.26(P<0.05);由此可见,实验可重复性不足,可能与实验中样品的预处理方法(芯片的种类、厂家、批号等)、试验操作者技能水平、研究者所采取的质谱方法(MALDI、SELDI或其他)、数据分析方法(SVM、留一法等)等不一致有关。
现有研究多针对肠癌患者血液标本或者组织标本的有创检测,受试者依从性差,不利于反复采样、实时动态监测以及人群盲筛推广,具有一定的限制性,不能广泛应用。笔者从无创角度,采用唾液样本进行肠癌的诊断研究,拟取得肠癌早期、无创诊断新方法。唾液取样是一种快速、无创、安全、无痛苦的过程,唾液中大量物质能够很好地反映人体全身状态,是一种生物全息律的具体表现之一。唾液检测可用于自身免疫系统疾病[19]、内分泌系统疾病[20]、心理学研究[21]等各系统疾病的诊断、疗效监测及病情进展的研究,尤其在各系统肿瘤的研究颇多。研究发现大肠癌疾病与唾液中的B型内皮素受体(endothelin receptor type B,EDNRB)量有关联[22]。因而,本课题设想可通过唾液中的特异生物标志物实现大肠癌的无创诊断。吴正治[23]等将唾液蛋白质组学技术运用于中医舌苔原理与微观辨证学的研究,发现不同舌苔与唾液蛋白质组具有相关性,并认为舌苔原理研究的进一步突破,有赖于以分子整体观为基础的技术方法学的突破。唾液由唾液腺产生,是消化系统的重要组成部分。“脾在液为涎,肾在液为唾”,因而中医认为唾液与脾肾密切相关,尤其是与脾胃密切相关。蛋白质是生命活动的表达者,而中医病证各阶段必有蛋白质为物质基础,因此,推断唾液中的某些生物标志物(蛋白质)能够有助于中医脾胃系统病证诊断的研究[24]。
本实验将WCX与MALDI-TOF-MS技术相结合,进一步探索肠癌患者唾液差异表达蛋白,发现了312个肠癌差异蛋白质峰,两组比值大于3(肠癌/正常对照>3,或者正常对照/肠癌>3),其中有37个差异蛋白质峰有统计学意义(P<0.05),其中有7个差异蛋白质峰肠癌表达上调,28个差异蛋白质峰肠癌表达下调,有35个差异蛋白质峰有显著差异(P<0.01)。选取m/z为2 501.26、4 779.95、3 140.39建立肠癌组与正常对照组的判别模型,该模型的灵敏度(88%)和特异度(98%)均高,采用十字交叉验证,灵敏度和特异度分别为85%、88%,可见,该模型对肠癌的诊断具有一定的价值。
参考文献:
[1] Qiao J, Fang CY, Chen SX, et al. Stroma derived COL6A3 is a potential prognosis marker of colorectal carcinoma revealed by quantitative proteomics. Oncotarget. 2015 Oct6; 6 (30):29 929-29 946.
[2]康清杰,向征.结肠癌筛查和诊疗的研究进展[J].重庆医学, 2015,44(28):4 001-4 003.
[3]王丽强,玄延花.大肠癌早期诊断研究进展[J].中国实验诊断学, 2014,18(8):1 380-1 383.
[4]吴忠.大肠癌结肠镜检查与分析[J].中国药物经济学,2015,(1): 137-138.
[5]邱云平.基于色谱质谱联用技术的大肠癌代谢组学研究[D].上海:上海交通大学,2008.
[6]张祯,徐晓莉,徐笛.直肠癌血清肿瘤标志物联合检测的临床意义[J].国际检验医学杂志,2015,36(20):3 053-3 054.
[7]付晓伶,张彦博,王文海.健脾清肠法对化疗致肠屏障功能障碍的大肠癌患者细胞因子的影响[J].中华中医药杂志,2015,30(6):2 171-2 175.
[8]万素娟,王红宇.健康人Tp-Te间期和Tp-Te/QT比率的探讨[J].实用医技杂志,2011,18(2):122-123.
[9]孙敏,黄东,李恒,等.结直肠癌肝转移血清蛋白指纹图谱诊断模型的建立及临床应用[J].湖北医药学院学报,2012,31(3):191-196.
[10]柳俊刚.应用蛋白指纹图谱技术筛选结直肠癌及肝转移特异性相关蛋白的初步研究[D].南宁:广西医科大学,2010.
[11]崔丹瑜.应用蛋白指纹图谱技术对大肠癌及其肝转移蛋白质组的研究[D].广州:第一军医大学,2007.
[12]林建军,刘池波,郭仁勇.基于WCX纳米磁珠的血清蛋白指纹图谱模型在大肠癌诊断中的应用[J].中国病理生理杂志,2010,26 (11):2 086-2 090.
[13]张巍,邓明明,王开正.SELDI蛋白质芯片技术在结直肠癌临床诊断中的应用研究[J].泸州医学院学报,2010,33(1):5-10.
[14] Liao CC, Ward N, Marsh S, et al. Mass spectrometry protein expression profiles in colorectal cancer tissue associated with clinico -pathological features of disease [J]. BMC Cancer,2010,10:410.
[15] Xu W, Chen Y, He W, et al. Protein fingerprint of colorectal cancer, adenomatous polyps, and normal mucosa using ProteinChip analysis on laser capture microdissected cells[J]. Discov Med,2014,17(95):223-231.
[16]周智勇.应用蛋白指纹图谱技术对结直肠癌血清蛋白质组的研究[D].南昌:南昌大学,2012.
[17]李小琼.大肠癌血清差异蛋白质组诊断和预后模型的建立[D].泸州:泸州医学院,2011.
[18]于新哲.应用CLINPROT技术建立早期诊断结直肠癌及肝转移预测模型[D].上海:复旦大学,2010.
[19] Condò R, Costacurta M, Docimo R. The anti-transglutaminase auto -antibodies in children's saliva with a suspect coeliac disease: clinical study[J]. Oral Implantol (Rome),2013,6(2): 48-54.
[20] Mook-Kanamori DO, Selim MM, Takiddin AH,et al, 1,5-Anhydroglucitol in saliva is a noninvasive marker of short -term glycemic control[J]. J Clin Endocrinol Metab,2014,99(3): 479-483.
[21] Sigurdsson B, Palsson SP, Aevarsson O, et al, Saliva testosterone and cortisol in male depressive syndrome, a community study. The Sudurnesjamenn Study [J]. Nord J Psychiatry,2014,68(8):579-587.
[22] Schussel J, Zhou XC, Zhang Z, et al. EDNRB and DCC salivary rinse hypermethylation has a similar performance as expert clinical examination in discrimination of oral cancer/dysplasia versus benign lesions[J]. Clin Cancer Res,2013,19(12): 3 268-3 275.
[23]张晓丽,王济国,曹美群,等.消化系疾病不同舌苔唾液蛋白质组学的初步研究[J].中国中医药科技,2010,17(4):336-338.
[24]谢梦洲,贺佐梅,周小青,等.唾液检测的应用进展[J].湖南中医药大学学报,2016,36(2):76-80.
(本文编辑李杰)
Establishment of Saliva Protein Fingerprint Molecular Diagnostic Models for Screening Colorectal Cancer
HE Zuomei1, HUANG Feijuan3, ZHOU Xiaoqing1, WU Zhengzhi1,3,4,5*,XIE Mengzhou1,2*
(1. National Key Descipline of TCM Diagnosis, 2011 Collaborative Innovation Center of Digital Chinese Medicine, Hunan University of Chinese Medicine, Changsha Hunan 410007, China; 2.Hunan Engineering Research Center for the Technology of Creation & Mannufacture of Chinese Medicine for Anti-tumor, Changsha Hunan 410007, China; 3. Futian Affiliated Hospital of Guangdong Medical Institute, Shenzhen, Guangdong 518033, China; 4.The Fist Affiliated Hospital of Shenzhen University, Shenzhen, Guangdong 518035, China; 5.Shenzhen Institute of Geriatrics, Shenzhen, Guangdong 518020, China)
Abstract〔〕Objective To establish a novel molecular diagnostic model of saliva protein fingerprint in colorectal cancer (CRC) patients. Methods Saliva samples from 34 patients with CRC, and 45 healthy people were analyzed by weak cationicexchange magnetic beads (MB-WCX) and matrix-assisted laser desorption ionization time-of-flight mass spectrometry (MALDITOF -MS) methods. Subsequently, we compared the saliva peptide signatures of the two groups and obtained differently expressed peptides by using of Biomarker Wizard, then establish a diagnostic model to diagnose gastric carcinoma by using of Biomarker Patterns 5.0.2. Results 312 differentially expressed protein peaks were detected, the ratio of two groups>3.0 (CRC/control>3.0, or control/ CRC>3.0), including 37 protein peaks were statistically significant (P<0.05); 7 peaks were upregulated, 28 peaks were down -regulated, there were 35 different protein peaks have significant difference (P <0.01). Further more, we screened and built a saliva proteomic models with 3 protein molecules m/z 2501.26, 4779.95, 3140.39book=20,ebook=23to distinguish CRC groups and normal groups. The sensitivity of this model was 88% (30/34), and the specificity was 98 % (44/45). The reliability of this model was further verified with a sensitivity of 85% (29/34) and a specificity of 88% (37/45) by cross validation method. Conclusion Saliva proteomic profiling by using MALDI-TOF-MS combined with WCX technique is a novel potential tool for the clinical diagnosis of CRC.
Keywords〔〕colorectal cancer; saliva; proteome; molecular diagnostic model; protein fingerprint; matrix -assisted laser desorption ionization time-of-flight mass spectrometry
〔通讯作者〕*吴正治,男,博士,教授,博士研究生导师,E-mail: szwzz001@163.com。谢梦洲,女,博士,研究生,教授,硕士生导师,E-mail: xiemz64@qq.com。
〔作者简介〕贺佐梅,女,硕士,研究方向为中医诊断(消化系统病病证结合唾液蛋白质组学研究)。
〔基金项目〕国家自然科学基金项目资助(81273665);湖南中医药大学中医诊断学国家重点学科开放基金项目(201401)。
〔收稿日期〕2016-01-28
〔中图分类号〕R735.3;R241
〔文献标识码〕A
〔文章编号〕
doi:10.3969/j.issn.1674-070X.2016.04.005
