碳包覆对钛基锂离子电池负极材料的影响
2016-05-14刘昶杨巍
刘昶 杨巍
摘 要:本文以钛基材料为例,研究了碳包覆改性对过渡金属化合物电化学性能的影响,发现碳层不仅可以缓冲电解液对电极材料的破坏,还可提供部分可逆容量并降低了界面阻抗。实验表明:钛基材料晶粒内部的导锂性在包碳后明显提升,而且相比于尖晶石Li4Ti5O12,电极反应中应变较大的TiO2导锂性提升更加明显,从而有利于其高理论容量的发挥,包碳后材料晶粒内部导锂性的提升可能是过渡金属化合物包碳后可逆容量大幅提升的重要原因。
关键词:碳包覆;锂离子电池;负极材料;改性
1 引言
锂离子电池在能量密度和使用寿命方面具有很大优势,目前已经广泛应用于各种便携式电子设备,并可能进一步应用在交通运输、航空航天、国防军事等领域,但是传统的碳负极材料理论容量偏低,限制了锂离子电池的进一步应用。自从J-M. Tarascon等人率先提出用过渡金属氧化物代替石墨作为锂离子电池负极材料的思路后[1],关于过渡金属化合物储锂性能的研究被广泛开展。然而大多数过渡金属化合物的导电性和导锂性很差,以致其实际可逆容量远低于理论容量,限制了其实际应用。
利用碳材料进行复合或包覆是过渡金属化合物负极材料常见的改性方法,之前认为碳材料可以保护电极材料免受电解质侵蚀[2, 3],其优良的导电性和不低的可逆容量也可能为电极材料提供了一部分可逆容量、提高了材料导电性并降低了界面阻抗,从而使材料的综合电化学性能得以提升。Hongjun Luo等人以葡萄糖为碳源水热合成的碳包覆Li4Ti5O12的倍率性能和可逆容量明显提升[2]。Tonghua Wu等人制备的石墨-MnO在100次循环后仍保持了705.8 mAh·g-1的高可逆容量,保持率高达94.5% [3]。Sang-Jun Park等人通过水热法在不同温度下制备的碳包覆一维纳米氧化钛的容量均有明显提升,其中400 ℃下合成的材料在250 mAh·g-1下循环50次后仍保持了275 mAh·g-1的可逆容量[4]。
2 实验目的
笔者研究发现,碳包覆前后的高钛TiO2/Li4Ti5O12复合材料电化学性能差异巨大,锂钛摩尔比为4:8的材料包碳后在100 mAh·g-1的电流密度下循环100次后仍能保持227.2 mAh·g-1可逆容量,而包碳前仅为83.8 mAh·g-1,二者的电化学性能差异显著[5]。为具体探明碳层在材料中的作用,本文在前期工作的基础上,利用Li-Ti-O体系,以钛基材料为例,详细研究了碳层对过渡金属化合物电化学性能的影响。
3 实验内容
3.1 合成方法
1) 先将40.84 gTBT溶解在乙醇中,再将其缓慢滴定到4.137 g LiNO3、10 mL水和乙醇的混合溶液中,期间保持充分搅拌;
2)滴定完全后将混合物在105 ℃烘箱中保温12 h,之后在电阻炉中加热,并在600 ℃下保温5 h,以完成锂钛摩尔比为4:8的TiO2/Li4Ti5O12复合材料(TLTO4-8)的合成;
3)将1.5 g样品和1.05 g葡萄糖在坩埚中加少量水混合,在105 ℃烘箱中彻底干燥后放入密封的反应釜中,在电阻炉中加热并在600 ℃下保温5 h,以实现对材料的碳包覆(C-TLTO4-8)。
3.2 材料表征手段
本实验采用Rigaku Dmax-2500型X射线衍射仪(电压50 kV,电流100 mA)以4°/min的速度扫描获得材料的X射线衍射(XRD)数据,其光源为Ni滤波的铜靶Kα射线;采用SDT-Q600 V8.3 Build 101型热重仪测量含碳量,以10.0 ℃·min-1的升温速率从室温上升到800 ℃测得TG-DSC曲线。
3.3 电化学性能测试方法
本实验材料的电化学性能通过2025型纽扣电池进行测试。在组装电池前,先将合成的样品与导电剂乙炔黑和粘结剂聚偏二氟乙烯(PVDF)按照8:1:1的质量比称量,并加入适量N-甲基-吡咯烷酮搅拌混合,配成浆料;之后将浆料均匀刮覆在铜箔上,并在120 ℃真空干燥箱中干燥12 h后取出冲制成负极极片。电池的组装过程在氩气保护的手套箱中进行,组装时以锂片为正极,以Celgard 2300型材料为隔膜,电解质为1 mol/L的六氟磷酸锂的碳酸二甲酯和碳酸亚乙酯混合溶液。
电池的恒流测试在蓝电(LAND)测试平台上进行,电压范围为0.02~3.0 V,循环伏安曲线以0.3 mV/s的扫描速度在IviumStat型电化学工作站上获得,阻抗曲线在AC响应幅度10 mA下由频率从100 kHz变化到0.1 Hz获得。
4 结果与讨论
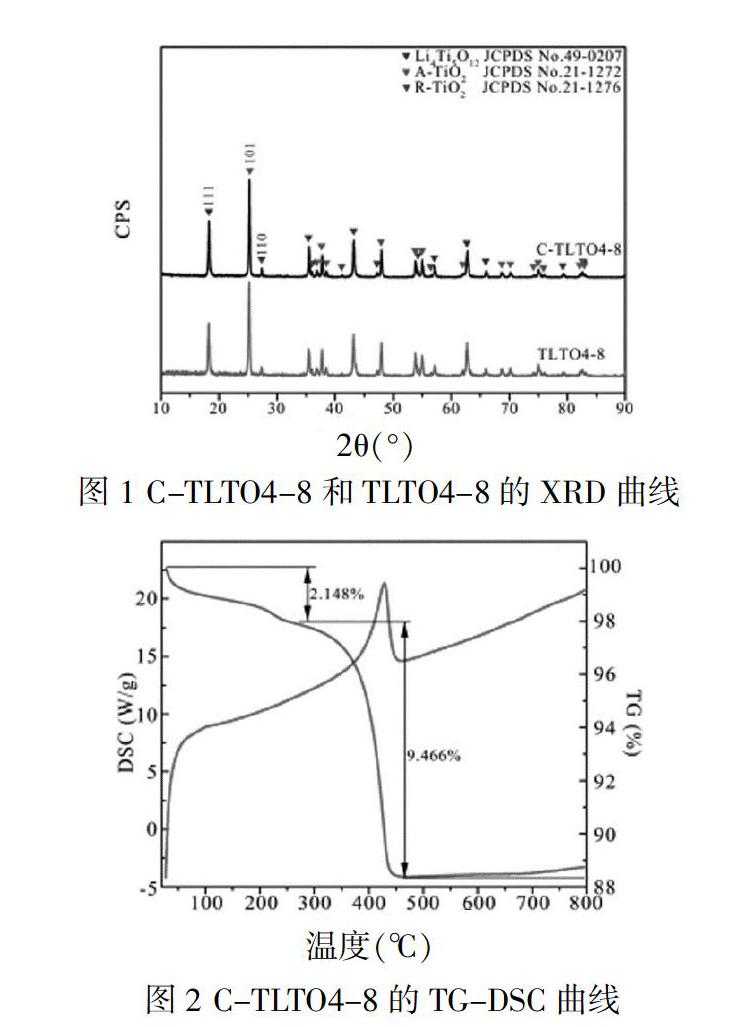
C-TLTO4-8和TLTO4-8的X射线衍射结果如图1所示。从图1可以看出,材料主要由Li4Ti5O12(LTO)和锐钛矿(A-TiO2)组成,并伴有少量的金红石相(R-TiO2),而在碳包覆前后三者的比例未发生明显变化,表明包碳过程中除碳源碳化外并未发生其他反应。而根据谢乐公式(D=0.89λ/(Bcosθ))计算的C-TLTO4-8和TLTO4-8中的Li4Ti5O12、A-TiO2和R-TiO2的晶粒尺寸均为40 nm左右。
为准确衡量C-TLTO4-8中的含碳量,我们对其进行了热重分析,其结果如图2所示。其中放热峰出现在270~450 ℃,材料在270 ℃之前出现的2.148%的质量损失由材料中潮气脱吸附造成,材料中的碳含量约为9.466%。
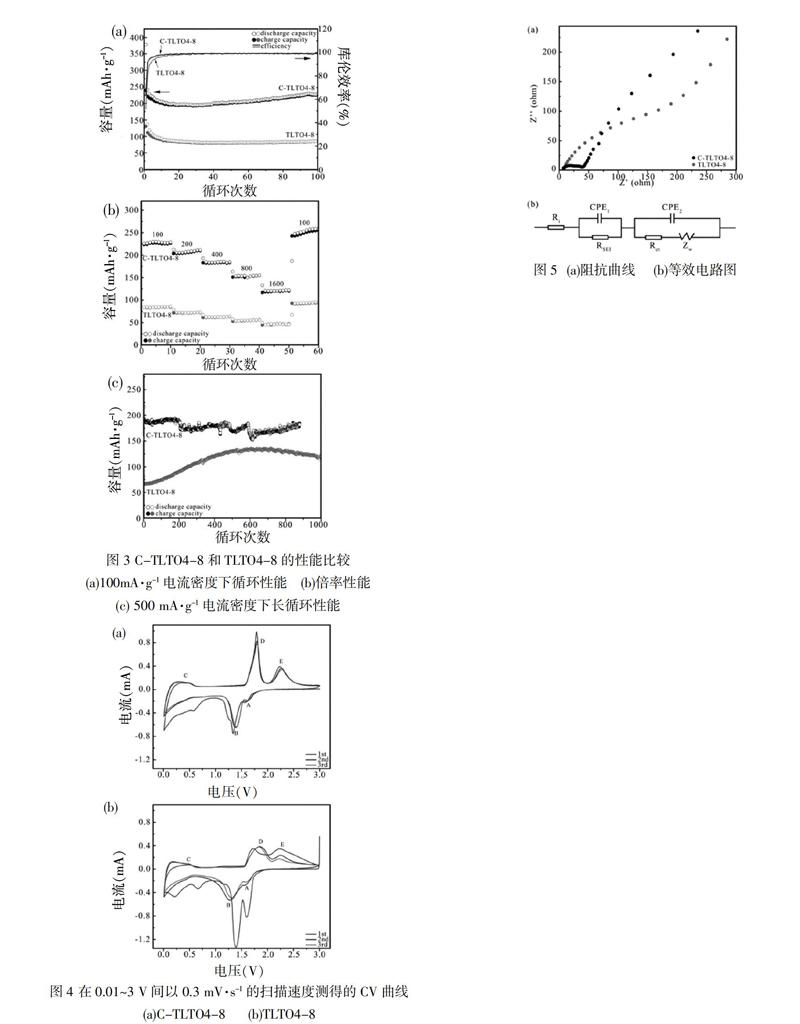
C-TLTO4-8和TLTO4-8的100 mA·g-1电流密度下循环性能比较、倍率性能比较和500 mA·g-1电流密度下长循环性能比较分别如图3(a)、图3(b)和图3(c)所示。由图3(a)可以看出,TLTO4-8在100 mA·g-1下的可逆比容量仅为83.8 mAh·g-1,远低于C-TLTO4-8 (227.2 mAh·g-1)。同时C-TLTO4-8具有优秀的倍率性能[如图3(b)所示]和高倍率长循环性能[如图3(c)所示]。C-TLTO4-8和TLTO4-8电化学性能的巨大差异,表明碳层在提升钛基材料电化学性能方面具有重要作用。
为了更好地理解碳层的作用,我们在0.3 mV·s-1的扫描速度下测试了C-TLTO4-8和TLTO4-8在前三次循环过程中的CV曲线,如图4所示。从图4可以看出,C-TLTO4-8和TLTO4-8中都能观察到两对氧化还原峰,其中1.39/1.80 V(B和D) 峰对应于LTO 中锂的嵌入脱出,1.56/2.28 V(A和E) 峰对应于A-TiO2中锂的嵌入脱出,0.6 V(C)的氧化峰由LTO 中的Ti4+引起[5]。与C-TLTO4-8不同,TLTO4-8在前三次循环中的循环稳定性很差,这与材料前几次循环中容量的急剧下降(图3(a))和高倍率下的容量波动(图3(c))相吻合,因为碳层可以充当电极材料与电解液间的缓冲层来保护电极材料免于破坏,从而提升循环稳定性。相比之下,C-TLTO4-8的峰值电流更高,表明碳材料可能会参与电化学反应并为界面储锂提供位点,进而导致材料的容量提升。比较图4(a)和图4(b)可以看出,TLTO4-8 比 C-TLTO4-8的极化更加严重,表明包碳可明显提升材料的电极反应阻抗和导锂性。
为进一步研究C-TLTO4-8和TLTO4-8的反应阻抗,我们测得了C-TLTO4-8和TLTO4-8的阻抗曲线,如图5(a)所示,其等效电路如图5(b)所示,其中Ri表示未平衡的电池内部阻抗,CPE1和CPE2表示表面层和双电层的电容,RSEI 和Rct表示SEI膜(Solid Electrolyte Interface)和电荷转移过程中的电阻,Zw表示扩散阻抗。从图5(a)中可看出材料在包碳后Rct下降明显,证明包碳后电子导电性提升,从而有利于材料理论容量的发挥。
材料的导锂性即锂离子在材料晶里内部的扩散系数可由Randles-Sevcik方程近似计算。
Ip=2.678×105An3/2CLiDLi1/2v1/2 (25 ℃) (1)
其中,Ip 表示峰值电流(amps);n表示转移电荷数;A表示电极面积(cm2);CLi和 DLi表示锂离子浓度(mol/cm3)和扩散系数(cm2/s);v表示扫描速率(V/s)。
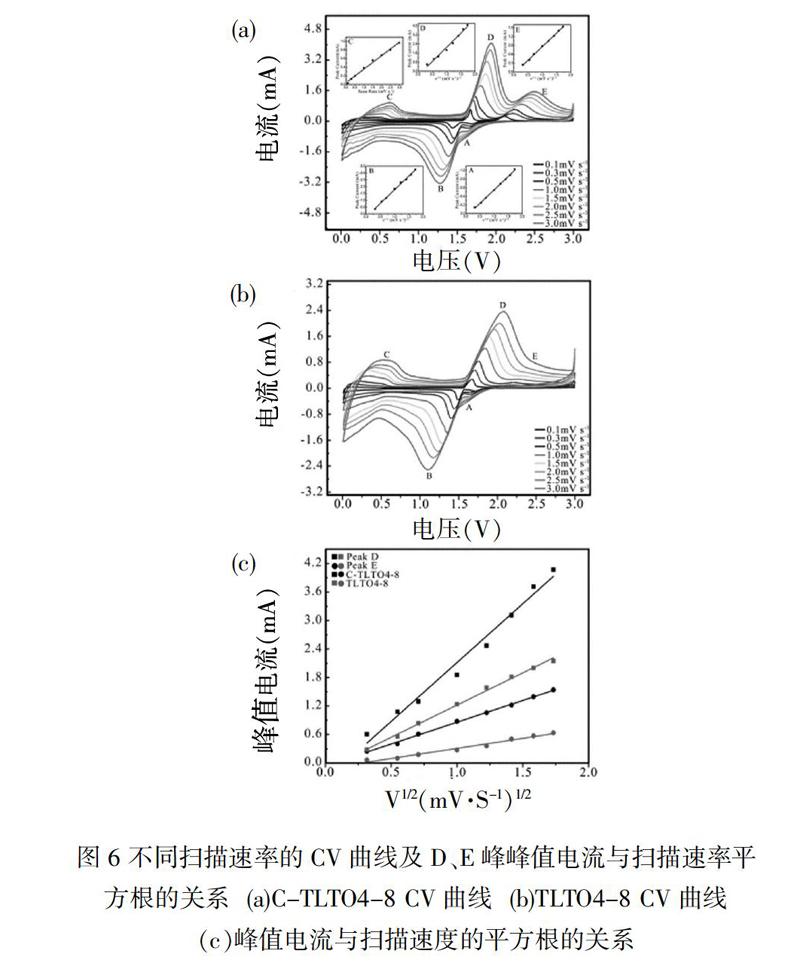
从公式(1)中可以看出峰值电流与扫描速率的平方根成正比,其斜率与扩散系数的平方根成正比,由于C-TLTO4-8中碳含量不高(图2),为简化计算,认为C-TLTO4-8和TLTO4-8相组成相同。C-TLTO4-8和TLTO4-8在0.01~3 V间以不同扫描速率下的CV曲线如图6(a)、图6(b)所示,D、E峰(对应扩散控速的锂离子在LTO和A-TiO2中的扩散反应)峰值电流与扫描速率平方根的关系如图6(c)所示。从图6峰值电流与扫描速率平方根的正比关系图中可以看出,包碳后图中斜率明显上升,表明LTO和A-TiO2晶粒内部导锂性在包碳后提升明显,从而更好地发挥材料的理论容量。值得一提的是E峰与D峰斜率之比从包碳前的0.46上升到包碳后的0.55,比较图6(a)、图6(b)亦能看出随着扫描速率增加,TLTO4-8中的E峰逐渐消失,表明包碳对电极反应中结构应变较大的A-TiO2的导锂性提升更加明显。
5 结论
综上所述,碳层在钛基材料中有如下作用:
(1) 碳层可以保护电极免受破坏;
(2) 碳层可以参与电化学反应并因界面储锂产生额外容量;
(3) 碳材料优良的电子导电性和丰富位点可以提升界面处的电性和导锂性并降低Rct;
(4) 碳包覆可以改善材料晶粒内部的导锂性,对于体积应变较大的A-TiO2作用更加明显,这一规律也可能适用于其他过渡金属化合物材料。
参考文献
[1] P.Poizot,S.Laruelle,S.Grugeon,L.Dupont,J.M.Tarascon.Nanosized
transition metal oxides as negative electrode materials for lithium
ion batteries[J].Nature,2000,407:496~499.
[2] Hongjun Luo,Laifa Shen,Kun Rui,Hongsen Li,Xiaogang Zhang.
Carbon coated Li4Ti5O12 nanorods as superior anode material for
high rate lithium ion batteries [J].Journal of Alloys and
Compounds,2013,572:37~42.
[3] Tonghua Wu,Feiyue Tu,Suqin Liu,Shuxin Zhuang,Guanhua Jin,
Chunyue Pan.MnO nanorods on graphene as an anode material
for high capacity lithium ion batteries [J].Journal of Materials
Science,2014,49:1861~1867.
[4] Sang-Jun Park,Hansu Kim,Young-Jun Kim,Hyukjae Lee,Prepa
ration of carbon-coated TiO2 nanostructures for lithium-ion
batteries[J].Electrochimica Acta,2011,56:5355~5362.
[5] Wei Yang,Xue Bai,Tao Li,Yuan-Yuan Ma,Yong-Xin Qi,Long-
Wei Yin,Hui Li,Ning Lun,Yu-Jun Bai.Excellent performance of
carbon-coated TiO2/Li4Ti5O12 composites with low Li/Ti ratio for
Li-ion storage [J].RSC Advances,2015,5:93155~93161.
