一种从羊奶中检测牛奶和大豆成分多重实时荧光定量PCR方法的建立
2016-05-14范阳阳张荦嘉刘艳艳卞如如霍胜楠张卉张全芳步迅
范阳阳 张荦嘉 刘艳艳 卞如如 霍胜楠 张卉 张全芳 步迅

摘要:羊奶制品因其良好的营养功效备受消费者的青睐,也是乳制品主要掺假对象。本研究参考市场可能掺假现状,分别根据羊和牛线粒体基因组16S rRNA基因序列和大豆的KTi-S基因(GI:510514)序列,设计一对牛和羊特异性引物、一对大豆特异性引物以及相应的TaqMan-MGB 探针,建立羊奶中牛奶和大豆成分多重实时荧光定量PCR检测方法,并引入内标质控有效保证检测体系的准确性。本检测体系对羊奶、牛奶及豆浆的基因组DNA检测敏感度为0.01 ng;对羊奶中掺入牛奶和豆浆的体积掺假检测灵敏度均为0.1%。因此,本研究建立的羊奶中牛奶和大豆成分多重实时荧光定量PCR检测体系具有通量大、灵敏度高、特异性好等优点,实现了对羊奶中其他源性成分快速、准确的检测,对保障相关产品市场安全具有重要意义。
关键词:羊奶;牛奶;豆浆;多重实时荧光定量PCR
中图分类号:S879.1文献标识号:A文章编号:1001-4942(2016)06-0118-06
由于羊奶中含有的维生素和微量元素均高于牛奶,并且含有大量的乳清蛋白,其所含有的蛋白结构成分与母乳基本相同,被营养学界称之为“奶中之王”[1]。羊奶中不含引起人体过敏的异性蛋白,尤其适合胃肠较弱、体质较差的婴幼儿饮用,但市场上的羊奶品质参差不齐。随着消费者认可度的不断提高,在利益的驱动下,在羊奶中掺入牛奶或者豆浆的现象非常普遍,掺假手段多种多样,不断变换,仅靠感官鉴评和传统的试验方法已不能满足市场需要[2],严重影响我国奶业的健康发展。
目前,用于检测羊奶掺假的方法主要有气象色谱、液相色谱、电泳、PCR、ELISA和近红外光谱法等[3~6]。实时荧光定量PCR方法是以DNA为基础的一种检测技术,不受掺假形式的影响,可以进行快速、批量、自动、实时检测分析,具有灵敏度高、准确性好等优点,已经在动物源性成分检测项目上逐步取代一般PCR方法成为最常用的分子生物学检测手段[7]。为了保障羊乳及其产品品质,确保消费者的利益,建立准确检测牛羊乳及豆浆混掺的技术越来越重要。本试验旨在利用TaqMan探针实时荧光定量PCR方法,建立一种快速、准确检测羊奶中是否掺有牛奶和豆浆的方法。
1材料与方法
1.1材料与试剂
1.1.1试验材料试验所用标准液态牛奶、液态羊奶取自山东省畜牧研究所奶牛及山羊养殖基地,液态豆浆是本实验室用大豆加工而成。市售样品为购自济南市大、中、小型超市的不同品牌奶制品。
1.1.2主要试剂与仪器试剂:Chelex-100(天根生化科技有限公司,北京)、蛋白酶K(TaKaRa,日本)、核算定量检测试剂盒(TaKaRa,日本)。
仪器:ABI7500实时荧光定量PCR仪(ABI,美国)、高速冷冻离心机(Eppendorf,德国)、Nanodrop 核酸蛋白含量测定仪(Eppendorf,德国)。
1.2试验方法
1.2.1样品基因组DNA的提取分别取牛奶、羊奶、豆浆液体样品2 mL加入2 mL无菌离心管中,2 500 r/min、4℃恒温离心30 min,弃上清液保留沉淀;向离心管中加入1 mL无菌磷酸钾缓冲液(pH 7.4),轻轻混匀后转移至1.5 mL离心管中,3 500 r/min室温离心10 min,弃上清;向沉淀中分别加入280 μL 5%Chelex-100和20 μL 20 mg/mL蛋白酶K,56℃孵育30 min,漩涡震荡10 s混合均匀,100℃煮沸8 min,13 000 r/min离心3 min;将上清加入吸附柱中13 000 r/min离心1 min收集液体;向收集液中加入20 μL GlassMilk 和600 μL gDNA Binding Buffer充分混匀,65℃水浴15 min(其间不断轻柔地上下翻转离心管),室温放置5 min(其间不断轻柔上下翻转离心管);4 000 r/min离心1 min,弃上清;向离心管中加入500 μL 70%乙醇,8 000 r/min离心1 min,弃上清,重复2次;加入500 μL无水乙醇轻轻混匀,8 000 r/min离心1 min,弃上清;8 000 r/min离心30 s,用10 μL枪头吸走残余液体,室温放置至彻底干燥;加入100 μL TE(pH 7.0)70℃水浴5 min,瞬间离心,转移上清液至新的离心管中-20℃保存备用。使用Nanodrop 核酸蛋白含量测定仪测定核酸浓度。
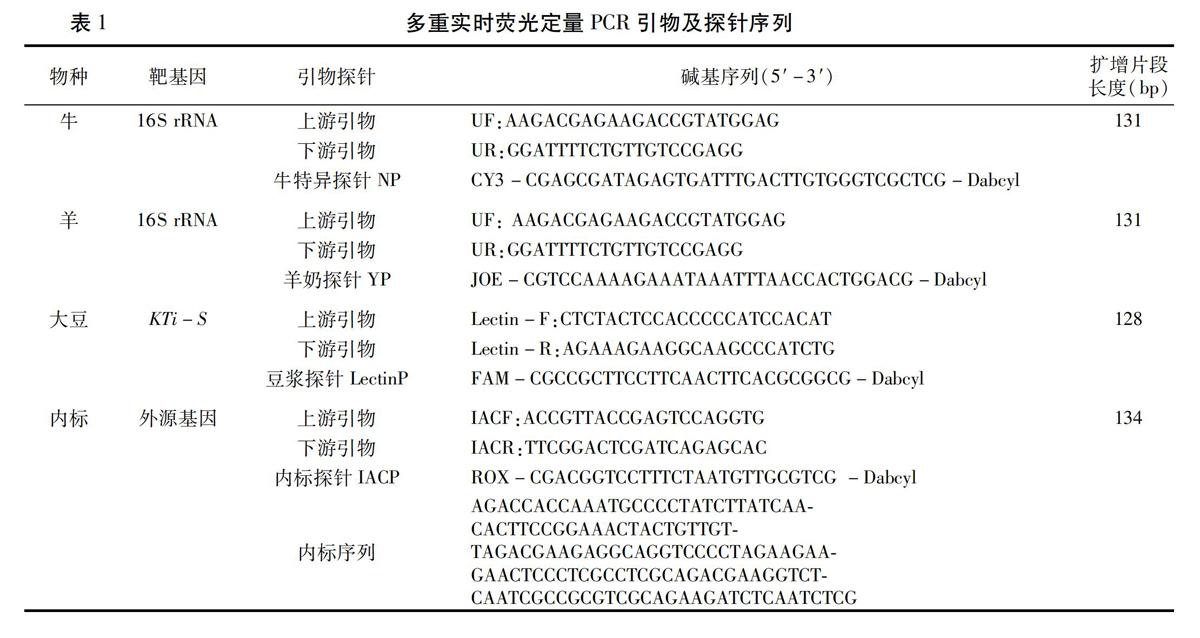
1.2.2引物及探针设计分别参照牛、山羊和绵羊线粒体基因组中高度保守的16S rRNA基因序列和大豆的KTi-S基因(GI:510514)序列,用Primer Premier 5.0设计牛奶、羊奶通用引物序列(UF、UR),大豆引物序列(Lectin-F、Lectin-R),内参引物序列(IACF、 IACR)。使用Beacon Designer 2.0 设计特异分子信标(MB)探针,其中牛奶探针(NP)用CY3标记,羊奶探针(YP)用JOE标记,豆浆探针(LectinP)用FAM标记,内标探针(IACP)用ROX标记,3′端的淬灭基团用Dabcyl修饰。引物及探针序列见表1。
1.2.3多重实时荧光定量PCR检测体系建立通过优化反应体系中的引物浓度、探针浓度和退火温度等条件,建立分别检测羊、牛和大豆源性成分的单重荧光定量PCR体系。将4种引物及探针组合在一起,分别或同时以羊、牛和大豆基因组DNA为模板,优化引物、探针浓度和退火温度等反应体系和条件,建立能同时检测羊、牛和大豆源性成分的多重荧光定量PCR体系。
1.2.4结果判定实时荧光定量PCR扩增结束后获取Ct值,当Ct值<35时,视为检出动物源性成分;当Ct值≥35时,视为未检出动物源性成分。
1.2.5基因组DNA检测灵敏度试验分别提取羊奶、牛奶及豆浆的基因组DNA,用Nanodrop定量到50 ng/μL,做10倍梯度稀释(10-1、10-2、10-3、10-4),对每个梯度按照优化后的扩增体系和条件分别进行检测。
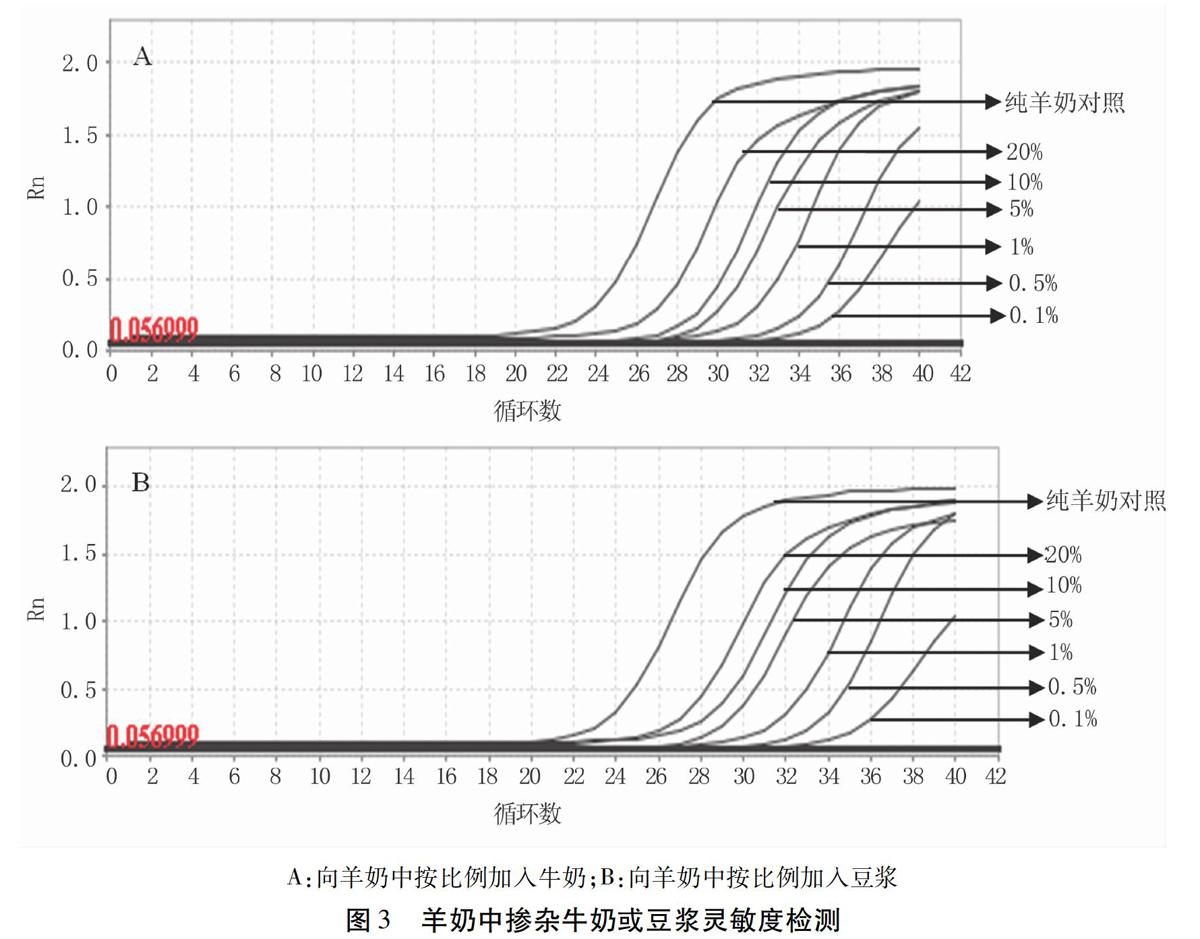
1.2.6羊奶中掺杂牛奶或豆浆灵敏度试验将豆浆和羊奶以一定体积比例混合,制成豆浆含量分别为0、0.1%、0.5%、1%、5%、10%和20%的混合奶样品;将牛奶和羊奶以一定比例混合,制成牛奶含量分别为0、0.1%、0.5%、1%、5%、10%和20%的混合奶样品。按照优化后的反应体系和条件分别进行检测。
1.2.7市售样本检测使用优化后的荧光定量PCR方法对35份奶制品样本进行源性鉴定,验证检测方法的实用价值。
2结果与分析
2.1多重实时荧光定量PCR检测体系的建立
参照优化的单重荧光定量PCR反应体系及条件,将羊、牛、大豆和内标质控的引物及探针组合在一起,先分别以羊、牛和大豆基因组DNA为模板优化反应体系,然后同时加入3种基因组DNA模板,通过调整反应体系中主要成分浓度和体积以及反应条件,优化反应体系,最终筛选出最适宜的多重实时荧光定量PCR体系。20 μL反应体系包括5× Premix 4 μL,HS-Taq酶(5 U/μL)0.2 μL,引物 Mix(2 μmol/L)2 μL, 探针 Mix(2 μmol/L)2 μL,内标质控IAC DNA模板(1 ng/μL)2 μL,检测样品DNA 模板2 μL,双蒸水7.8 μL。PCR反应条件为:95℃、30 s;95℃、5 s,60℃、34 s,40个循环,60℃延伸时收集荧光信号。图1为多重实时荧光定量PCR扩增曲线图,其中A图同时检测出羊和牛源性成分,大豆源性为阴性;B图样本中同时检测出大豆和牛源性成分,羊源性成分为阴性。
2.2基因组DNA灵敏度试验
结果(图2)显示,当模板DNA浓度稀释至10-4倍,即DNA质量为0.01 ng时,所建立的荧光定量PCR检测体系仍然能够产生良好的特异扩增曲线。此时纯羊奶、牛奶及豆浆模板检测到的Ct值分别为33.64±0.02、34.80±0.018和34.87±0.03,均<35,因此确定本研究中多重实时荧光定量PCR体系模板DNA质量检测下限为0.01 ng。
2.3羊奶中掺杂牛奶或豆浆灵敏度试验
将牛奶或豆浆以0.1%、0.5%、1%、5%、10%和20%的体积比掺入至纯羊奶中,结果显示当牛奶或豆浆含量为0.1%时,多重实时荧光定量PCR体系仍有特异性扩增曲线,并且其Ct值均<35(图3A、B),且随着牛奶或豆浆掺入比例增加,Ct值越来越小。说明本研究建立的多重实时荧光定量PCR检测体系对牛奶和豆浆的体积掺假检测限为0.1%。
2.4市售样本的实际检测
利用本研究建立的羊奶中牛奶和大豆源性多重荧光定量PCR检测体系对35份市售羊奶、羊奶粉、牛奶、牛奶粉进行源性鉴定。结果如表2所示,15份羊奶及相关制品中都含有羊源性成分,其中10份含有牛源性成分,4份含有大豆成分,分别占样本总数的66%和26%;20份牛奶及相关制品中全部检出牛源性成分,9份样品中检测出大豆成分,占样本总数的45%。
3讨论与结论
目前现有的牛羊乳检测方法多是依据羊乳和牛乳化学组成上的差异,以牛羊乳中蛋白质、脂肪、DNA、维生素等为特征指标进行检测[8]。色谱-质谱结合技术是分离蛋白质、定量检测牛羊乳混掺的重要方法,有研究表明该方法可以实现牛羊乳混掺的快速检测,能检测牛羊混合乳中牛乳含量的最低水平为5%[9]。毛细管电泳-质谱联用(CE-MS)技术也在牛羊乳检测中得到了应用[10],但存在检测灵敏度偏低的缺点[11]。利用近红外光谱法检测掺假羊奶需要足够的专业知识,建立模型才能对检测结果进行分析,对检测人员的要求较高,不易普及推广[12]。荧光定量PCR方法是基于DNA水平的检测,克服了以上技术的不足,被越来越多地应用到奶制品的检测中。由于核酸比蛋白质更稳定,抗热能力更强,并且含有更多遗传信息,所以基于DNA的动物源性检测方法比蛋白免疫法更有优势[13]。
曾少灵等用多重实时荧光定量PCR检测牛、山羊和绵羊源性成分[14];孟芳等应用荧光定量PCR方法仅能鉴别牛、羊奶[15];刘小艳等用实时荧光定量PCR方法检测模拟奶制品中常见谷物成分的检出限为0.5%[16]。本研究参照牛、山羊和绵羊线粒体基因组中高保守的16S rRNA基因和大豆的KTi-S基因为靶基因设计探针建立多重实时荧光定量PCR检测方法,该方法不仅能够针对羊奶、牛奶和豆浆进行快速准确的鉴别,而且能对奶制品进行掺假检测;在扩增循环内只出现特异性扩增曲线无交叉扩增曲线;对纯DNA含量的最低检出浓度为0.01 ng;对模拟掺假的奶制品中目标成分的最低检出限为0.1%(V/V),说明本研究建立的多重实时荧光定量PCR方法具有特异性好、灵敏度高等优点。经实际市售奶制品检测验证了其可行性和适用性,适用于奶类样品掺假的快速检测。
参考文献:
[1]焦凌梅, 袁唯. 改善山羊乳风味的方法研究[J]. 中国乳业, 2006(6):56-58.
[2]蒋儒林, 张金丽. 关于原奶掺假提高脂肪和蛋白质含量的检测方法 [J]. 乳品加工,2005,10(5):37-39.
[3]Chen R K, Chang L W, Chung Y Y, et al. Quantification of cow milk adulteration in goat milk using high-performance liquid chromatography with electrospray ionization mass spectrometry [J]. Rapid Commun. Mass Spectrom., 2004, 18(10): 1167-1171.
[4]López-Calleja I M, González I, Fajardo V, et al. Application of an indirect ELISA and a PCR technique for detection of cow s milk in sheeps and goat, milk cheeses[J]. International Dairy Journal, 2007, 17(1): 87-93.
[5]薛海燕,胡围围,宋宏新,等.羊乳中掺入牛奶的间接ELISA定量检测[J].食品科学,2010,31(24):370-373.
[6]郭美兰,孙正鹏,张超,等. 近红外透反射光谱用于掺假牛奶的快速识别初探[J].化学界,2010(5):270-273.
[7]刘旭辉,马贵平,史喜菊,等.商品中动物源性成分检测方法的研究进展[J].动物医学进展,2007,28(10):91-94.
[8]张晓旭,葛武斌,李宝宝,等. 牛羊乳混掺检测鉴别技术研究进展[J]. 食品安全质量检测学报,2015,6(9):3594-3601.
[9]Ferreira I M, Caote H. Detection and quantification of bovine, ovine and caprine milk percentages in protected denomination of origin cheeses by reversed-phase high-performance liquid chromatography of beta-lactoglobulins [J]. J. Chromatogr. A, 2003, 1015(1/2):111-118.
[10]Mu~ller L, Barták P, BednrˇP, et al. Capillary electrophoresis-mass spectrometry-a fast and reliable tool for the monitoring of milk adulteration [J]. Electrophoresis, 2008, 29(10):2088-2093.
[11]王宁,刘佳,李书文,等. 毛细管电泳-质谱联用技术研究进展[J]. 氨基酸和生物资源,2015,37(2):1-5.
[12]李亮,丁武.掺有植物性填充物牛奶的近红外光谱判别分析[J].光谱学与光谱分析,2010,30(5):1238-1242.
[13]邵碧英,杨婕,张体银. 动物产品的DNA提取方法[J] .畜牧与兽医,2005,37(9):47-49.
[14]曾少灵,秦智锋,花群义,等.多重实时荧光PCR检测牛、山羊和绵羊源性成分[J].生物技术与方法,2009,25(1):139-146.
[15]孟芳,张卿,蔡婧怡,等.荧光定量PCR方法鉴别牛、羊奶粉[J].检验检疫学刊,2013,23(1):34-36.
[16]刘小艳,付春玲,李培,等.实时荧光PCR法检测奶制品中常见谷物成分[J].中国食品卫生杂志,2014,26(2):123-127.
