铜和硝酸银溶液反应的创新设
2016-05-14李静媛
李静媛

摘要:初中化学中金属与盐溶液的反应是帮助学生认识金属活动性顺序的重要依据,此类实验原理清晰、操作简单且现象明显。铜和硝酸银溶液的反应是金属与盐溶液反应中十分具有代表性的一个实验,该实验的创新设计能缩短实验时间、展现丰富的实验现象,更能激发学生对影响化学反应的各种因素的思考,阐释了化学实验对于化学教学的重要功能。
关键词:硝酸银溶液:金属与盐溶液反应:创新设计
文章编号:1008—0546(2016)07—0093一02
中图分类号:G632.41
文献标识码:B
doi:10.3969/i.issn.1008—0546.2016.07.033
一、问题提出
铜和硝酸银溶液的反应是帮助学生理解金属活动性顺序的重要实验。该实验在教材中力求通过铜丝表面产生银白色固体以及溶液由无色变为蓝色说明铜和硝酸银发生了置换反应,由此得出铜比银活泼的结论。
而在教学中的实际情况却是将铜丝插入现配的或久置的硝酸银溶液后,铜丝上的沉积物均呈现黑色而不是白色的银,需经过较长时间后,才能在粗铜丝上看到海绵状灰白色的银,并且比较易脱落,而且在课堂演示的短时间内很难观察到溶液颜色的变化。这些问题的出现究竟是什么原因?该如何解决呢?正当笔者困惑之际,读到了田博文、刘怀乐老师的《cu和AgNO3反应生成的Ag是什么颜色?》一文,深受启发,于是笔者也在实验室中对Cu和AgNO3溶液的反应进行了一系列的探究。
二、猜想与假设
问题1:铜丝上的黑色物质是什么?
观点1:是银。这与物质的状态有关,从溶液中生成的银是非常小的颗粒,对光全吸收,因此为黑色;观点2:铜丝表面生成的银被氧化,所以呈现黑色观点;观点3:该反应在生成银的同时,还生成了Cu,也就必有Cu2+的水解,因此铜丝上附着的物质成分并不单一。
问题2:为什么很长时间后才能看到溶液呈现蓝色?
观点1:反应时间较短时,溶液中的Cu2+浓度小,所以看不出溶液的颜色。观点2:因为在酸性溶液中,银有较高的氧化势(Ag+e=Ag,E=0.799V),但在中性溶液中,Ag+面对不活泼金属Cu,首先可能发生的反应是Ag+Cu=Ag+Cu,进而是Ag+Cu=Ag+Cu,两式相加才是2Ag+Cu=2Ag+Cu。
三、证据搜集
实验操作:将蒸馏水煮沸冷却后配制硝酸银溶液,测定溶液pH,然后向试管中滴加植物油,再插人铜丝。
实验现象:硝酸银溶液的pH接近7:铜丝与硝酸银溶液刚接触部分表面呈现黑色,较长时间后逐渐呈现白色,且越是远离铜条,生成的物质越银白。
分析解释:由上述实验现象不难看出,铜和硝酸银溶液的反应其实并非我们想象的那么简单。铜丝上黑色物质主要为银,也有少量的Cu水解的产物,反应后溶液颜色的呈现与反应时间有很大关系。这个实验的关键在于要使Ag表现应有的氧化性,就需要溶液具有合适的酸度和浓度。平时实验时,实验室中提供的硝酸银溶液往往没有标明浓度,也没有经过酸化处理,这些因素是造成该实验现象不如意的原因之一;另外铜丝如果在实验室存放已久,表面失去了金属光泽,意味着铜丝表面覆盖了氧化物,这也是对该实验造成影响的因素之一。该实验操作和实验装置均较简单,无需进行特别改进。
创新设计关键:(1)铜丝表面进行去除氧化物处理,尽量消除铜丝表面的氧化物对实验的影响;(2)对硝酸银溶液的酸碱度进行测试并配置不同浓度的溶液进行对比,找寻最适合进行该实验的溶液酸碱度和浓度;(3)酸化硝酸银溶液,抑制水解,增强Ag+的氧化性;(4)适度提升反应温度,加快反应。
五、实验过程
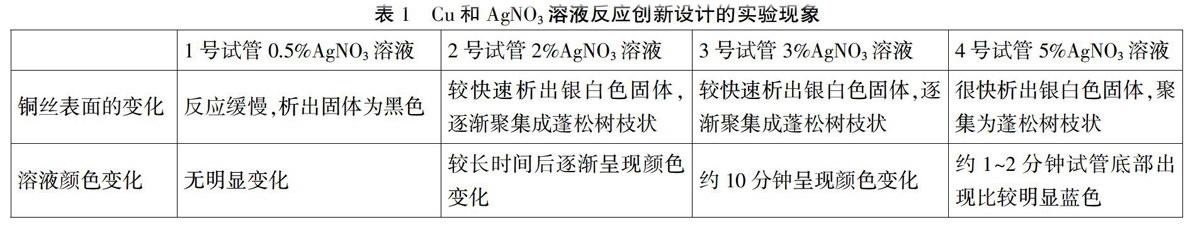
1.用蒸馏水和硝酸银固体分别配制0.5%AgNO3溶液、2%AgNO3溶液、3%AgNO3溶液、5%AgNO3溶液。
2.向四支贴有标签的试管中分别加入0.5%AgNO3溶液、2%AgNO3溶液、3%AgNO3溶液、5%AgNO3溶液
由上述实验可见得,本实验要达到比较迅速观察到铜丝表面析出银白色固体且溶液颜色变为蓝色,AgNO3溶液的浓度应稍大些对于缩短实验时间有比较明显的帮助,而且为了能确保Ag析出,需要对溶液进行酸化处理,加入浓硫酸既能够酸化溶液,抑制水解,同时浓硫酸溶于水放热,又能提高反应温度,可谓一举两得。当然,在实验前要仔细处理用于反应的铜丝,确保实验成功。约3mL,再向试管中各滴加1滴浓硫酸,置于试管架上备用。
3.将铜丝底端绕成螺旋状以增加接触面积,在酒精灯火焰上加热至红热,再将加热后的铜丝伸入酒精溶液中至表面光亮后取出。此举目的是去除铜丝表面可能残留的氧化物。
4.将处理光亮的铜丝分别伸入上述各浓度AgNO3溶液中,观察现象。
六、实验现象及结论
