小麦ent—柯巴基焦磷酸合酶基因TaCPS1的克隆与荧光定量分析
2016-05-14郭庆东李全权田秋菊钱艳丽许田杨艳林王洪刚封德顺
郭庆东 李全权 田秋菊 钱艳丽 许田 杨艳林 王洪刚 封德顺

摘要:ent-柯巴基焦磷酸合酶(ent-copalyl diphosphate synthase, CPS)是植保素合成途径中的关键酶。本研究利用mRNA差异显示技术,从小偃麦异附加系种质SN6306中得到一个与抗白粉病相关的TaCPS1基因。该基因ORF长2 394 bp,编码797个氨基酸。对其进行生物信息学分析表明,该序列推导的蛋白无信号肽,主要由亲水性氨基酸组成,可能存在于细胞质中;其具有类异戊二烯合成酶超家族的保守结构域。荧光定量分析结果表明,SN6306中的TaCPS1基因在白粉病菌E09诱导处理72 h时,表达量上调了大约45倍,但感病亲本烟农15(YN15)基本不受诱导。在茉莉酸甲酯诱导下,TaCPS1基因表达量升高将近15倍;在水杨酸诱导下,TaCPS1基因表达量升高将近 2.4倍。推测TaCPS1基因可能参与小麦抗白粉病机制中的水杨酸和茉莉酸激素调节途径。
关键词:小麦;ent-柯巴基焦磷酸合酶;TaCPS1;基因克隆;生物信息学分析;荧光定量PCR;白粉病抗性
中图分类号:S512.101文献标识号:A文章编号:1001-4942(2016)07-0001-09
小麦白粉病由禾本科布氏白粉菌(Blumeriagraminis f. sp.tritici (Bgt))引起,该病菌是一种专性寄生的子囊菌,只能在活的寄主组织上生长发育,白粉病菌对湿度和温度的适应范围很广,小麦从幼苗到成株均可被白粉病菌侵染[1]。20世纪60年代以来,由于小麦半矮秆品种的推广、氮肥施用量的增大,白粉病的危害日趋严重,在世界主要麦区由次要病害上升为主要病害,也成为我国小麦安全生产的主要限制因子[2]。虽然化学农药对小麦白粉病防治有一定的作用,但会造成环境污染。克隆、鉴定和应用在小麦抗白粉病中起重要作用的基因对小麦抗病育种及稳定粮食生产具有重要意义。
ent-柯巴基焦磷酸合酶(ent-copalyl diphosphate synthase, CPS)是赤霉素生物合成途径中的关键酶,也是植保素合成途径中的一个关键酶,其催化牻牛儿基牻牛儿基焦磷酸(geranyl geranyl diphosphate, GGDP)环化成古巴基焦磷酸(ent-copalyl diphosphate, CDP)[3]。
赤霉素是高等植物体内非常重要的一种植物激素,调控着茎的伸长、花的分化、种子和果实的发育以及休眠等多个生理过程[4,5]。高等植物中赤霉素生物合成途径已基本确定[6,7],CPS是其合成途径中的关键酶。CPS的活性主要取决于CPS基因的表达水平,该基因主要受植物生长发育的调控[8,9]。CPS 基因若完全突变,植物不能产生任何赤霉素,这将导致植物种子不能萌发、植株矮化和雄性不育等[10,11]。
植保素是植物受到生物或非生物因子侵袭时在体内合成并迅速积累的抗微生物活性的小分子化合物,在植物抗病过程中起着重要作用。目前已分离鉴定的植保素大致可分为以下几种:黄(烷)酮类、类黄酮类、倍半萜类、吲哚类、双苯类、香豆素类、萜类、环二酮类、内酯类、醌类、苯乙酮类、苯并呋喃类以及生物碱类等。其中萜类成分广泛存在于植物、真菌等生物体中,既包括固醇、胡萝卜素等初级代谢产物,又包括成千上万结构各异的次级代谢产物。萜类合酶是萜类成分生物合成的关键酶,萜类成分结构的丰富性与萜类合酶家族成员的多样性密不可分。自1992年开始有植物萜类合酶基因克隆的报道,迄今为止,已有超过200种植物萜类合酶基因的cDNA被克隆,包括烟草、薄荷、番茄、丹参等多种植物的单萜合酶、倍半萜合酶、二萜合酶[12~17]。牻牛儿基牻牛儿基焦磷酸(GGPP) 是植物中二萜化合物的共同前体物质,其首先通过不同的环化酶催化成环,然后进一步形成结构各异的二萜化合物[18]。柯巴基焦磷酸合酶(CPS)是植物三环二萜类化合物生物合成过程中的起始环化酶。
Otomo等[19]报道了CPS在水稻中的生物学功能,指出其是赤霉素和植保素生物合成分支点的关键酶之一,并发现OsCyc1(即OsCPS4)、OsCyc2(即OsCPS2)和OsCPS1等酶分别参与了momilactones A、B,oryzalexin S、oryzalexins A~F和phytocassanes A~E以及赤霉素的合成,并且前二者基因表达量受紫外线诱导上调,而OsCPS1的表达量不受紫外线的诱导。Prisic等[20]报道了水稻中包含两种不同的CPS基因,分别编码CPS1ent和CPS2ent两种酶。这两种酶有不同的代谢功能,CPS1ent通常参与赤霉素的生物合成,而CPS2ent参与植保素的生物合成,这与Otomo等[19]的报道相一致。Prisic等[20]同时指出OsCPS1ent与玉米中参与赤霉素合成的An1/ZmCPS1ent的相似性比与其Ⅱ类萜合成酶旁系同源物的相似性要高,这种生物合成过程中跨物种的保守性反映出从赤霉素初级生物合成过程衍生出的相关次级代谢的分化先于禾本科内部导致现代玉米和水稻产生的不同世系的早期分化。Toyomasu等[21]根据小麦表达序列标签从小麦中扩增出了三个CPS基因(TaCPS1、TaCPS2和TaCPS3),并且利用大肠杆菌进行了原核表达,证明这三个基因编码的蛋白具有ent-柯巴基焦磷酸合酶的活性。通过进化树和表达分析认为TaCPS3负责参与赤霉素的生物合成,而TaCPS1和TaCPS2则有可能在功能上与水稻中的OsCPS2 和OsCPS4同源,参与植保素的生物合成[22]。在玉米CPS的研究中,Harris等[22]在2005年报道了玉米的CPS基因(An2)受镰刀菌诱导,An2编码的蛋白和玉米中参与赤霉素生物合成的An1编码的蛋白有约60%的相似性,其催化产生的二萜中间产物可能参与了初级或者次级代谢。Schmelz等[23]指出An2基因转录量的积累先于植保素kauralexin区域化的大量产生,这也印证了An2在玉米抗病中的重要作用。Falara等[24]报道了在百瑞木中克隆到一个二萜合成酶基因,该酶催化copal-8-ol二磷酸的合成,和其他物种中的柯巴基二磷酸合酶有较高的相似性,且该酶的表达量受伤害诱导。Kurusu等[25]报道显示水稻CPS4(OsCPS4/OsCyc1)和类内根-贝壳杉烯合酶4(OsKSL4/OsKS4)负责参与momilactones的生物合成,而CPS2(OsCPS2/OsCyc2)和类内根-贝壳杉烯合酶7(OsKSL7/OsDTC1)则负责参与phytocassanes的生物合成,这些酶都受TvX/EIX的诱导。Kurusu等[25]研究还发现OsCIPK(Calcineurin B-like protein-interacting proteinkinases)14/15可能参与TvX/EIX诱导的植保素生物合成的调节,因此钙离子信号途径很有可能参与到这一过程中。
前人的研究表明柯巴基焦磷酸合酶在水稻和玉米等作物中具有抗植物病害作用,但其是否具有抗小麦白粉病的作用尚未见报道。在前期的研究中,我们以本实验室培育的高抗白粉病异附加系小麦种质SN6306与高感白粉病亲本小麦品种烟农15为材料,利用未经侵染和经过白粉病菌E09 诱导处理12 h 的小麦SN6306叶片cDNA来挖掘小麦白粉病菌诱导的差异表达片段,发现其中编号为47969的contig在诱导后表达量明显上调。本研究根据小麦测序数据库(http://wheat-urgi.versailles.inra.fr/)中的相似性比对,通过PCR 方法从SN6306的cDNA中克隆到一个TaCPS1基因,并对此序列进行生物信息学和基因表达分析,为进一步研究TaCPS1基因在小麦抗白粉病中的作用及在育种中的应用奠定基础。
1材料与方法
1.1试验材料
供试材料为小麦-中间偃麦草双体异附加系SN6306与其亲本小麦烟农15。其中SN6306高抗小麦白粉病菌生理小种E09,为高感白粉病小麦品种烟农15 (YN15)(Triticum aestivum L., 2n=42)与小麦近缘属中间偃麦草(Thinopyrum intermedium, 2n=42)的杂交后代,附加了一对来自中间偃麦草的染色体。烟农15由烟台市农业科学研究院育成,高感白粉病菌生理小种E09。
挑选籽粒饱满的小麦种子用10% NaClO消毒10 min,随后用蒸馏水漂洗数次,蒸馏水中催芽1 d 后,移至蛭石与基质(1∶1)的混合培养基中,培养条件为光照时间16 h,光照强度12 000 lx,25℃;黑暗时间8 h,18℃。白粉病菌为北方和黄淮麦区流行小种E09,通过高感白粉病小麦品种YN15 来进行传代培养。接种方法为首先用干净棉棒在长满白粉病菌的YN15 叶片上进行涂抹,然后对长至一叶一心期的SN6306 进行叶片接种涂抹。
1.2RNA提取与反转录
按照全式金公司RNA 提取试剂盒操作说明进行总RNA 提取。所用材料为SN6306经白粉病菌E09诱导12 h的叶片。琼脂糖凝胶电泳和分光光度法检测提取的总RNA 的质量与纯度。以提取的3 μg 总RNA 作为模板,以Oligo-dT为引物,利用TransScriptFirst-Strand cDNA Synthesis Super Mix (全式金)试剂盒进行反转录。具体方法如下:将RT管置于冰上,用移液器添加3 μL提取的总RNA,2 μL浓度为10 μmol/L的dT-ACP1,加RNase-free 水补至9 μL,用移液器吸打混匀;80℃水浴3 min,冰上放置2 min,短暂离心后,再加入2×TS Reaction Mix 10 μL与TransScriptRT/RI Enzyme Mix 1 μL,使反应体系总体积为20 μL,轻轻混匀;混匀后于42℃孵育90 min,94℃加热2 min,冰上放置2 min,轻轻混匀;最后向反应体系中添加DNase-free 水80 μL,使其稀释到100 μL,反转录产物放于-20℃备用。
1.3TaCPS1基因的克隆
通过对前期mRNA差异显示技术得到的数据进行分析,发现编号为47969的contig受小麦白粉病菌诱导后上调表达,将该片段在NCBI上进行BlastN,发现比对区段与TaCPS1(已注册,注册号为AB439588.1)的相似性为99%。
根据比对结果我们推测该基因为TaCPS1基因,并根据其序列设计特异引物对TaCPS1F:5′-ATGCAGGTGTTTAACGGTAACC-3′和TaCPS1R:5′-GTAGTAAGGGAGGTTTTTCTCCAAC-3′,以SN6306经白粉病菌侵染后的叶片cDNA为模板进行扩增。PCR 反应体系为:2×PCR mix 10 μL (百泰克),10 μmol/L 的引物TaCPS1F和TaCPS1R各0.5 μL,反转录产物cDNA 2 μL,剩余用ddH2O补至20 μL。PCR 反应程序采用Touch-Down PCR 程序,即95℃ 5 min 预变性后,首先10个循环,每个循环退火温度降一度(94℃ 40 s, 62~52℃ 40 s, 72℃ 2.5 min),后进行27 个普通循环(94℃ 40 s, 52℃ 40 s, 72℃ 2.5 min),最后72℃延伸10 min,10℃保存。PCR 产物用1%琼脂糖凝胶进行电泳分离,按照TaKaRa的胶回收试剂盒说明回收扩增产物,将回收产物与pEASY-T1 (全式金)载体过夜连接,转化DH5α大肠杆菌感受态细胞。选取3 个独立阳性克隆送公司测序(上海博尚),以保证结果的准确性。
1.4生物信息学分析
按照黄春丽等[26]的方法对TaCPS1基因序列和蛋白序列进行生物信息学分析:使用ORF finder软件对TaCPS1基因序列的开放阅读框进行分析;使用在线SignalP工具对编码蛋白序列的信号肽有无进行分析;使用ExPASy的ProtScale对编码蛋白的亲疏水性进行分析;利用NCBI上的BlastP功能对其蛋白结构等进行预测与分析;使用软件DNAMAN进行蛋白的多序列联配分析;使用软件MEGA5 进行系统进化树分析。
1.5小麦白粉病菌诱导下TaCPS1基因的表达情况分析
1.5.1小麦叶片总RNA的提取与cDNA第一链的合成所用材料为SN6306与YN15幼苗未经侵染(0 h)与经白粉病菌E09诱导处理12、24、48、72 h的叶片,共计10个样品。总RNA提取及cDNA第一链的合成方法同1.2。
1.5.2TaCPS1基因的荧光定量PCR(quantitative real-time PCR,qRT-PCR)分析设计扩增引物47969F/R,47969F:5′-ACCGTTGCAGCTCT
GAAGAA-3′与47969R: 5′-AGGGGCTCACCTCTTCCATA-3′,使该引物扩增的目的片段跨一个内含子序列且引物在高度同源的TaCPS2与TaCPS3的cDNA中无匹配。选用小麦β-Actin基因作为内参基因,引物序列为β-Actin F:5′-CCGGCATTGTCCACATGAA-3′与β-Actin R:5′-CGGTTCAGCTTTTCCTTTTGG-3′。以SN6306与YN15各时间点第一条链cDNA为模板,对白粉病菌诱导下TaCPS1基因的表达特征进行分析。
按照SYBRPremix Ex TaqTM说明书进行操作,于CFX96TM Real-Time PCR Detection System扩增仪上进行扩增。qRT-PCR反应体系(反应液配制在冰上进行):2×SYBR Premix Ex Taq(TliRNaseH Plus)10 μL,2.5 μmol/L PCR 47969F/R引物各2 μL,模板cDNA<100 ng,ddH2O补至20 μL。
qRT-PCR反应程序:95℃预变性90 s;95℃变性5 s,60℃退火30 s,共40个循环;65℃至95℃,每次升高0.5℃,每温度持续5 s,绘制熔解曲线。反应结束后确认qRT-PCR的扩增曲线和熔解曲线,按照Livak 2-ΔΔCT方法进行结果分析[27]。
1.6水杨酸和茉莉酸甲酯诱导后TaCPS1基因的表达情况分析
1.6.1叶片处理将事先配制好的SA(100 μmol/L)、JAMe(0.5 g/L)两种激素溶液分别喷洒于SN6306叶片,分别采取0、12、24、36、48、60 h和72 h七个时间点的叶片,于液氮中速冻,随后转入-80℃冰箱中长久保存,备用。
1.6.2总RNA的提取与cDNA第一链的合成将分别经SA和JAMe处理0、12、24、36、48、60 h和72 h的SN6306叶片共计14个样品进行总RNA的提取及cDNA第一链的合成(方法同1.2)。
1.6.3荧光定量分析以上述反转录得到的cDNA为模板,以47969F/R为引物进行qRT-PCR,方法同1.5.2。
2结果与分析
2.1TaCPS1基因的克隆
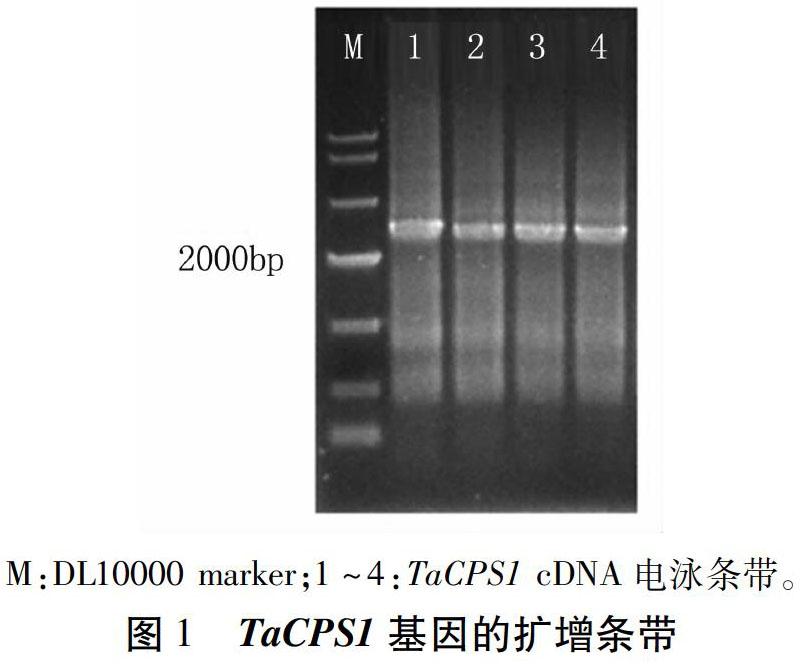
将在SN6306的差异表达cDNA中筛选到的编号为47969的contig在NCBI上进行比对,发现其和普通小麦TaCPS1的序列相似度达到99%。以SN6306 cDNA为模板,用特异引物TaCPS1F/R扩增目的基因,1%琼脂糖凝胶分离扩增产物,电泳后显示大小约2 500 bp的条带(图1),经测序得到长度为2 531 bp的TaCPS1序列。该序列的部分片段与前期获得的编号为47969的contig完全相符。
2.2TaCPS1基因的cDNA和氨基酸序列分析
使用ORF finder软件对TaCPS1基因序列的开放阅读框进行分析,预测TaCPS1基因编码区长度为2 394 bp,编码含有797个氨基酸的蛋白(图2)。在ExPASY网站上对TaCPS1蛋白进行分析,其分子量为90 200.4 D,理论pI为5.88。
2.3TaCPS1的生物信息学分析
使用SignalP 4.1对TaCPS1蛋白序列的信号肽进行预测分析,结果表明该蛋白无信号肽。使用ProtScale工具在线分析TaCPS1蛋白序列亲疏水性,结果表明该蛋白的氨基酸残基主要为亲水性氨基酸,推测其可能存在于细胞质中。采用NCBI 的BlastP对TaCPS1的蛋白结构进行预测,发现其具有类异戊二烯合成酶超家族(Isoprenoid-Biosyn-C1 superfamily)的保守结构域(图3)。
通过DNAMAN对TaCPS1基因编码的蛋白与从NCBI查找到的18个其它物种的CPS蛋白进行多序列比对分析,结果表明TaCPS1和其它物种的CPS蛋白在氨基酸序列上具有很高的相似性(图4)。用MEGA5.0对共计19个CPS蛋白进行进化树分析,从系统进化树可以看出TaCPS1与粗山羊草CPS蛋白遗传距离最近,进化上同源(图5)。
2.4TaCPS1基因在小麦白粉病菌诱导后的表达情况分析
为了验证TaCPS1基因在响应小麦白粉病菌中的作用,对其在SN6306与YN15对照(0 h)以及白粉病菌诱导12、24、48、72 h共计10个样品中的表达模式进行了qRT-PCR分析。结果表明,荧光定量的熔解曲线峰单一,判断无杂带;SN6306中的TaCPS1基因在白粉病菌诱导处理24 h后,表达量开始上升,到72 h时,其表达量上调了大约45倍,但YN15基本不受诱导(图6)。由此推测,TaCPS1基因受小麦白粉病菌诱导上调,可能和SN6306抗小麦白粉病有关。
2.5TaCPS1基因在水杨酸和茉莉酸甲酯诱导后的表达情况分析
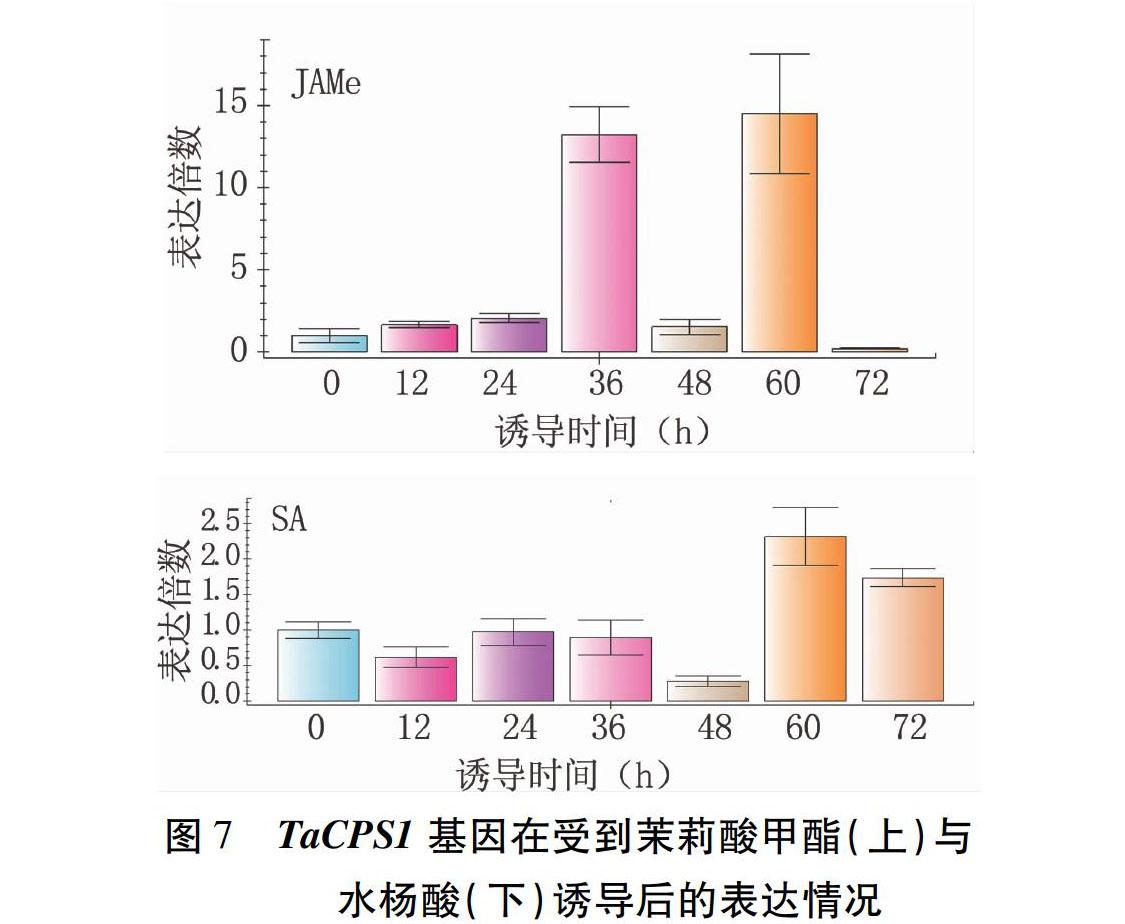
为了进一步探究TaCPS1基因可能参与的抗白粉病机制,利用水杨酸和茉莉酸甲酯两种激素对SN6306分别进行诱导,并分别采取各时间点叶片,进行实时荧光定量分析。结果表明,在茉莉酸甲酯诱导下,与0 h相比,TaCPS1基因表达量呈现出先升高后降低再升高的趋势,并在诱导60 h时达到最高值,是0 h的近15倍(图7);在水杨酸激素诱导下,与0 h相比,TaCPS1基因表达量先降低后升高,并在诱导60 h时达到最高值,是0 h的2.4倍(图7)。这表明TaCPS1基因可能参与了水杨酸和茉莉酸激素调节途径。
3讨论与结论
已有文献报道在多种植物中存在多个CPS基因[28],如日本粳稻全基因组中存在4个CPS基因,其中OsCPS1与植物激素赤霉素合成相关,OsCPS2与非赤霉素类二萜的生物合成相关,OsCPSsyn与
图7TaCPS1基因在受到茉莉酸甲酯(上)与水杨酸(下)诱导后的表达情况syn-半日花烷型的二萜合成相关[20]。这些二萜化合物中的植保素成分在某种程度上促进了植物对相关外源伤害如紫外伤害等产生抗性。前人对小麦CPS基因已做了很多研究,Toyomasu等[21]根据小麦表达序列标签从小麦中扩增出了三个TaCPS基因(TaCPS1、TaCPS2和TaCPS3);Wu等[29]在小麦中发现了TaCPS4与TaCPS5基因;Huang等[30]在小麦7A、7B和7D染色体中分别发现了一个TaCPS基因。但是关于TaCPS基因在小麦中的功能没有太多研究,大部分研究仅说明TaCPS基因与植物激素赤霉素和非赤霉素类二萜的生物合成相关,对TaCPS基因在小麦抗白粉病方面的作用还没有报道过。本研究中,TaCPS1基因受小麦白粉病诱导表达量上调,说明其与抗白粉病作用有关;TaCPS1基因被水杨酸和茉莉酸甲酯诱导表达量上调,推测TaCPS1基因参与了小麦抗白粉病反应的水杨酸和茉莉酸激素调节途径;TaCPS1基因的表达量明显上调发生在第60 h,推测TaCPS1基因可能位于抗白粉病反应的下游途径,受水杨酸和茉莉酸激素调控。
本研究克隆到TaCPS1基因,并发现该基因可能与小麦白粉病抗性有关。下一步我们将针对该基因构建大麦花叶病毒诱导的基因沉默(BSMV-VIGS)载体,拟进一步通过基因沉默技术探讨该基因的功能,为研究TaCPS1基因在小麦抗白粉病中的作用及在育种中的应用奠定基础。
参考文献:
[1]孙苏阳,李海军,王永军,等. 小麦白粉病的发生因素及防治对策[J]. 安徽农学通报,2009,15(6):101,157.
[2]张海泉. 小麦抗白粉病分子育种研究进展[J]. 中国生态农业学报,2008, 16(4):1060-1066
[3]Xu M, Hillwig M L, Prisic S, et al. Functional identification of rice syn-copalyl diphosphate synthase and its role in initiating biosynthesis of diterpenoid phytoalexin/allelopathic natural products[J]. Plant Journal, 2004, 39(3):309-318.
[4]Blázquez M A, Soowal L N, Lee I, et al. LEAFY expression and flower initiation in Arabidopsis[J]. Development, 1997, 124(19):3835-3844.
[5]Carzoli F G, Michelotti V, Fambrini M, et al. Molecular cloning and organ-specific expression of two gibberellin 20-oxidase genes of Helianthus annuus[J]. Plant Molecular Biology Reporter, 2009, 27(2):144-152.
[6]Hedden P, Phillips A L. Gibberellin metabolism: new insights revealed by the genes[J]. Trends in Plant Science, 2001, 5(12):523-530.
[7]Hedden P. Gibberellin metabolism and its regulation[J]. Journal of Plant Growth Regulation, 2008, 59(4):225-251.
[8]Smith M W, Yamaguchi S, Ait-Ali T, et al. The first step of gibberellin biosynthesis in pumpkin is catalyzed by at least two copalyl diphosphate synthases encoded by differentially regulated genes[J]. Plant Physiology, 1999, 118(4):1411-1419.
[9]Silverstone A L, Chang C, Krol E, et al. Developmental regulation of the gibberellin biosynthetic gene GA1 in Arabidopsis thaliana[J]. Plant Journal, 1997, 12(1):9-19.
[10]Koornneef M, Veen J H V D. Induction and analysis of gibberellin sensitive mutants in Arabidopsis thaliana (L.) Heynh.[J]. Theoretical & Applied Genetics, 1980, 58(6):257-263.
[11]Sun T P, Kamiya Y. The Arabidopsis GA1 locus encodes the cyclase ent-kaurene synthetase A of gibberellin biosynthesis[J]. Plant Cell, 1994, 6(10):1509-1518.
[12]Tholl D. Terpene synthases and the regulation, diversity and biological roles of terpene metabolism[J]. Current Opinion in Plant Biology, 2006, 9(9):297-304.
[13]Facchini P J, Chappell J. Gene family for an elicitor-induced sesquiterpene cyclase in tobacco[J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(22):11088-11092.
[14]Colby S M, Alonso W R, Katahira E J, et al. 4S-limonene synthase from the oil glands of spearmint (Mentha spicata). cDNA isolation, characterization, and bacterial expression of the catalytically active monoterpenecyclase[J]. Journal of Biological Chemistry, 1993, 268(31):23016-23024.
[15]Colby S M, Crock J, Dowdle-Rizzo B, et al. Germacrene C synthase from Lycopersicon esculentum cv. VFNT cherry tomato: cDNA isolation, characterization, and bacterial expression of the multiple product sesquiterpenecyclase[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(5):2216-2221.
[16]Gao W, Hillwig M L, Huang L Q, et al. A functional genomics approach to tanshinone biosynthesis provides stereochemical insights[J]. Organic Letters, 2009, 11(22):5170-5173.
[17]Vasiliki F, Akhtar T A, Nguyen T T H, et al. The tomato terpene synthase gene family[J]. Plant Physiology, 2011, 157(2):770-789.
[18]Trapp S C, Croteau R B. Genomic organization of plant terpene synthases and molecular evolutionary implications[J]. Genetics, 2001, 158(2):811-832.
[19]Otomo K, Kenmoku H, Oikawa H, et al.Biological functions of ent-and syn-copalyl diphosphate synthases in rice: key enzymes for the branch point of gibberellin and phytoalexin biosynthesis[J]. The Plant Journal, 2004, 39(6): 886-893.
[20]Prisic S, Xu M, Wilderman P R, et al. Rice contains two disparate ent-copalyl diphosphate synthases with distinct metabolic functions [J]. Plant Physiology, 2004,136(4): 4228-4236.
[21]Toyomasu T,Kagahara T,Hirose Y,et al.Cloning and characterization of cDNAs encoding ent-copalyl diphosphate synthases in wheat: insight into the evolution of rice phytoalexin biosynthetic genes [J].Bioscience Biotechnology and Biochemistry, 2009,73(3):772-775.
[22]Harris L J, Saparno A, Johnston A, et al.The maize An2 gene is induced by Fusarium attack and encodes an ent-copalyl diphosphate synthase [J].Plant Molecular Biology, 2005, 59(6):881-894.
[23]Schmelz E A, Kaplan F, Huffaker A, et al.Identity, regulation, and activity of inducible diterpenoid phytoalexins in maize[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011,108(13):5455-5460.
[24]Falara V, Pichersky E, Kanellis A K.A copal-8-ol diphosphate synthase from the angiosperm Cistus creticus subsp. creticus is a putative keyenzyme for the formation of pharmacologically active,oxygen-containing labdane-type diterpenes [J]. Plant Physiology, 2010, 154 (1): 301-310.
[25]Kurusu T, Hamada J, Nokajima H, et al.Regulation of microbe-associated molecular pattern-induced hypersensitive cell death, phytoalexin production, and defense gene expression by calcineurin B-like protein-interacting protein kinases, OsCIPK14/15, in rice cultured cells [J].Plant Physiology, 2010,153(2):678-692.
[26]黄春丽, 宋静, 李全权,等. 小偃麦异附加系TaXTH基因的克隆与生物信息学分析 [J]. 山东农业科学, 2015, 47(7):1-6.
[27]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4):402-408.
[28]Toyomasu T. Recent advances regarding diterpene cyclase genes in higher plants and fungi[J]. Bioscience Biotechnology & Biochemistry, 2008, 72(5):1168-1175.
[29]Wu Y, Ke Z, Toyomasu T, et al. Functional characterization of wheat copalyl diphosphate synthases sheds light on the early evolution of labdane-related diterpenoid metabolism in the cereals[J]. Phytochemistry, 2012, 84(6):40-46.
[30]Huang Y, Yang W, Zhong P, et al. The genes for gibberellin biosynthesis in wheat[J]. Functional & Integrative Genomics, 2011, 12(1):199-206.
