CD4+/CD8+比例和LAG3+细胞
2016-05-14何兴桢杨安李曦
何兴桢 杨安 李曦
x[摘要] 目的 研究胃癌患者外周血CD4/CD8比例以及胃癌组织淋巴细胞活化基因3(LAG-3)阳性细胞/CCR类趋化因子受体3(CCR3)阳性细胞比例在胃癌发病机制中的意义。 方法 选取2013年1月~2014年12月在北京大学深圳医院诊断的胃癌患者(胃癌组)20例及健康者(正常组)20名,采用流式细胞仪检测和分析外周血中CD4/CD8比值,采用免疫荧光法检测和分析LAG3+细胞/CCR3+细胞比值。 结果 胃癌组患者外周血中CD4+/CD8+比值为(1.68±0.87),正常组外周血中CD4+/CD8+比值为(1.80±0.52),与正常组比较,胃癌组有下降,但差异无统计学意义(P > 0.05)。胃癌组患者LAG3+细胞/CCR3+细胞比值为(1.47±0.54),正常组LAG3+细胞/CCR3+细胞为(2.27±0.58),与正常组比较,胃癌组有下降,且差异有统计学意义(P < 0.05)。 结论 胃癌患者存在明显的LAG3+细胞/CCR3+细胞比例失衡,一定程度上显示胃癌患者存在着Th1/Th2比例失衡及免疫失衡,可能是胃癌发病的重要因素之一,为胃癌的免疫治疗、临床诊断提供新的方向。
[关键词] CD4+/CD8+;LAG3+细胞/CCR3+细胞;胃癌;发病机制
[中图分类号] R735.2 [文献标识码] A [文章编号] 1673-7210(2016)03(b)-0104-04
[Abstract] Objective To investigate the significance of CD4/CD8 in peripheral blood and lymphocyte activation gene-3 (LAG3+) cells/ chemokine receptor 3 (CCR3+) cells in the pathogenesis of patients with gastric cancer. Methods Twenty patients with gastric cancer (gastric cancer group) and 20 healthy controls (normal group) diagnosed in Shenzhen Hospital of Peking University from January 2013 to December 2014 were chosen, the CD4/CD8 in peripheral blood was detected and analyzed by flow cytometry. LAG3+ cells/CCR3+ cells was detected and analyzed by analyzed linked immunosorbent assay. Results The CD4+/CD8+ in peripheral blood of gastric cancer group was (1.68±0.87), which of normal group was (1.80±0.52), compared with normal group, gastric cancer group was lower, but the difference was not statistically significant (P > 0.05). LAG3+ cells/CCR3+ cells of gastric cancer group was (1.47±0.54), which of normal group was (2.27±0.58), compared with normal group, gastric cancer group was lower, and the difference was statistically significant (P < 0.05). Conclusion The patients with gastric cancer have a significant imbalance of LAG3+ cells/CCR3+ cells, to some extent, which shows that there is a proportion of Th1/Th2 and immune imbalance in patients with gastric cancer. And it may be one of the most important factors in the pathogenesis of gastric cancer, which provides a new direction for immune therapy and clinical diagnosis of gastric cancer.
[Key words] CD4+/CD8+; LAG3+ cells/CCR3+ cells; Gastric cancer; Pathogenesis
胃癌是最常见的恶性肿瘤之一,每年全世界因胃癌死亡的人数高达70万名[1]。近年来研究发现,肿瘤的发生、发展与机体免疫功能的抑制和免疫状态的异常密切相关[2]。T细胞亚群是在肿瘤免疫中具有重要作用的一类淋巴细胞,按其表面不同的分化抗原可分为CD4+T细胞(Th)和CD8+T(Ts/Tc)细胞两大亚群。CD4+T细胞按其产生细胞因子的不同又可以分为Th1和Th2两大亚型,其在机体免疫应答调节中具有重要作用。其中Th1介导细胞免疫应答,Th2介导体液免疫应答。正常状态下,T细胞及其亚群数目处在平衡状态,免疫功能稳定。CD4+T细胞产生淋巴因子,加强CD8+T细胞杀伤肿瘤细胞的功能,具有辅助细胞和体液免疫的作用。CD8+T细胞是一类细胞毒性T细胞和抑制性T细胞,是一类效应细胞,两者平衡从而维持机体正常免疫应答状态[3]。LAG3在一定程度上作为Th1细胞的特异性标志,选择性表达于人类Th1细胞[4],CCR3选择性表达于人类Th2细胞上[5]。本研究通过流式细胞仪检测胃癌患者外周血中CD4+/CD8+比例,通过免疫荧光法检测胃癌患者LAG3+细胞/CCR3+细胞的比例,探讨CD4+/CD8+比例和LAG3+细胞/CCR3+细胞在胃癌患者发病机制中的意义。
1 资料与方法
1.1 一般资料
选取2013年1月~2014年12月在北京大学深圳医院(以下简称“我院”)门诊或住院行内镜检查,内镜下诊断胃癌并且最终经过病理诊断明确的20例患者(胃癌组)作为研究对象;同时选择内镜下表现正常且没有糜烂、溃疡或萎缩等其他表现(活检最终符合病理诊断)的20名健康者(正常组)作为对照。胃癌组平均年龄(47.7±12.5)岁,其中男10例,平均年龄(52.2±14.0)岁,女10例,平均年龄(43.2±9.4)岁;正常组平均年龄(38.6±9.6)岁,其中男10名,平均年龄(41.0±9.4)岁,女10名,平均年龄(36.2±9.8)岁。提取患者血清5 mL备检测,实验获得我院医学伦理委员会批准和患者知情同意。
1.2 方法
1.2.1 流式细胞仪检测患者CD4/CD8细胞比例 取患者外周血2 mL加入DETA抗凝管(或其他抗凝剂)中。分设试验管3支,试验管依次加10 μL荧光标记CD3/4/8/45,CD3-FITC/CD19-PE抗体10 μL+CD45-PC5抗体5 μL、CD3-FITC/16+56-PE抗体10 μL+CD45-PC5抗体5 μL。每管加入100 μL新鲜抗凝全血,充分混匀后在室温暗处静置15~30 min。标本与抗体的比例:标本检测前应先计算白细胞总数,使反应体系中白细胞总数不超过5×105个细胞。若超过5×105个细胞,用PBS稀释后反应。取出试管:加500 μL OptilyseC,室温避光10 min,加500 μL PBS,室温避光10 min,1500 r/min离心5 min,弃上清,0.5 mL PBS悬浮细胞,24 h内检测。流式细胞仪检测:以CD45/SS双参数方案设门淋巴细胞群,选择CD3/4/8/45四色方案和CD3/CD16+56/CD45三色方案。标本上机后计数5000个淋巴细胞,测试完后由计算机进行数据分析。主要仪器及试剂如下:美国BeckmanCoulter公司NAVIOS型流式细胞仪。仪器序列号:AV40310,直接荧光标记单克隆抗体CD3/4/8/45、CD3/CD19、CD3/CD16+56、CD45-PC5购自法国Immunotech公司.
1.2.2 免疫荧光法检测LAG3+细胞/CCR3+细胞比例 由我院病理科获得患者胃癌组织切片,行二甲苯脱蜡2次,每次10 min。依次经100%、95%、85%、75%、50%乙醇和纯水各1次,每次5 min。PBS洗5 min。PBS洗3次,每次5 min。10%正常山羊血清封闭30 min。一抗4℃孵育过夜。PBS洗3次,每次5 min。荧光标记二抗室温湿盒避光孵育1 h。PBS洗3次,每次5 min。DAPI室温湿盒避光孵育5 min。PBS洗1次,5 min,去离子水洗2次,每次5 min;抗荧光淬灭剂封片;镜检,拍照。一抗Anti-CCR3生产商:Abcam;Anti-LAG3生产商:Abcam;二抗Goatanti-MsIgG生产商:LifeTech;Goatanti-RbIgG生产商:LifeTech;荧光显微镜生产商:Leica。对LAG3+、CCR3+细胞计数并进行分析。对每张切片随机取5个高倍视野(200倍)对CCR3阳性细胞和LAG阳性细胞进行计数,5个高倍视野的平均值为该切片的平均阳性细胞数,每张切片由两名观察者进行判断和读片,并取平均值。最终计算LAG3+细胞/CCR3+细胞比例。
1.3 统计学方法
应用SPSS 16.0统计软件进行统计学分析,计量资料采用均数±标准差(x±s)表示,行t检验,以P < 0.05为差异有统计学意义。
2 结果
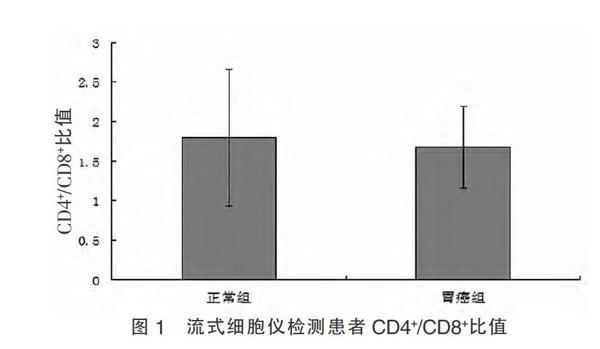
本研究发现胃癌组外周血中CD4+/CD8+比值为(1.68±0.87),正常组外周血中CD4+/CD8+比值(1.80±0.52)。与正常组比较,胃癌组有下降,但差异无统计学意义(P > 0.05)(图1)。而免疫荧光法检测提示胃癌组患者LAG3+细胞/CCR3+细胞比例为(1.47±0.54),正常组LAG3+细胞/CCR3+细胞比例为(2.27±0.58),差异有统计学意义(P < 0.05)(图2,封三),提示胃癌患者中存在着明显的LAG3+细胞/CCR3+细胞比例失衡。
3 讨论
胃癌在全球恶性肿瘤的发病率中排名第四,致死率排名第二[6]。近年研究发现,肿瘤的发生、发展、侵袭与机体免疫功能异常密切相关[7-8]。肿瘤发生时常伴有机体免疫低下或者免疫抑制。胃癌作为一种常见肿瘤,它的发生和机体抗肿瘤免疫功能异常密切相关。
T细胞是对抗肿瘤免疫具有重要意义的效应细胞,其数量和功能异常导致肿瘤细胞逃避宿主的免疫监控。在正常情况下,机体T细胞及其亚群的数目相对稳定,免疫功能稳定。有研究表明,反映恶性肿瘤患者机体免疫功能紊乱的敏感性指标是CD4+/CD8+细胞比值[9]。比值异常增高,提示机体细胞免疫功能“过度活跃”,机体发生自身免疫反应的概率增加;比值降低,提示机体处于“免疫抑制”状态。临床有研究结果显示,胃癌患者外周血CD4/CD8细胞比值比正常人低下,说明胃癌患者存在不同程度的T细胞免疫功能异常[10-11]。本研究结果显示,胃癌组外周血中CD4+/CD8+比值较正常组下降,但差异无统计学意义(P > 0.05)。可能与本研究样本量小、胃癌患者没有具体分期、技术方案相对简单有关,可以进一步扩大样本容量来证实CD4+/CD8+比例是否下降,胃癌患者是否处于免疫抑制状态。
LAG3是免疫球蛋白超家族中的一员。有研究证实其主要在CD4+T中的Th1细胞上表达,在大部分Th2细胞上不表达,提示可作为Th1、Th2细胞的区分标志[5]。但也有研究认为LAG3不能作为Th1细胞的特异性指标[12]。本研究检测出胃癌组及正常组LAG3+细胞并计数。虽然LAG3+细胞计数不完全等同于Th1细胞计数,但其主要在Th1细胞上表达,一定程度上反映了Th1细胞计数。CCR3是G蛋白偶联受体中的一种,其主要在Th2淋巴细胞、肥大细胞以及嗜酸性粒细胞上表达[13]。虽然CCR3在Th2细胞上选择性表达,但是又可以与多种受体结合[14],所以检测出来的CCR3+细胞计数只能在一定程度上反映了Th2阳性细胞计数。由于目前缺乏Th1和Th2细胞表面特异性标志物,只能通过检测细胞分泌的特征性细胞因子,间接检测出Th1/Th2的比值。本研究通过得出LAG3+细胞/CCR3+细胞比例,间接反映Th1/Th2的比值。有待将来进一步研究加深对T细胞体内分化及调控机制的认识,从而准确检测出Th1/Th2比值,有利于实验结果的准确分析,进一步促进胃癌的免疫诊断和治疗。
LAG3在多种免疫类型中表达,主要在活化的T细胞和NK细胞上选择性表达,其在部分活化的B细胞、肿瘤组织活化浸润的CD4+T细胞、CD8+T细胞也有表达[15]。多项研究表明,LAG3能激活CD4+T细胞、CD8+T细胞,从而杀伤肿瘤细胞,在肿瘤的发生、发展过程中发挥重要的免疫调节作用[16-17],表明肿瘤细胞生长与机体的免疫状态异常有关。CCR3主要在Th2淋巴细胞、肥大细胞以及嗜酸性粒细胞等各种免疫效应细胞上表达[13],其在神经系统肿瘤、卵巢癌、肾癌等多种肿瘤中被发现表达上调,具体机制不详,可能与机体免疫异常有关,有待未来的研究进一步证实。
Th1、Th2是CD4+T细胞的两个重要亚群,机体正常状态下Th1/Th2比值保持动态平衡[18]。在肿瘤等各种疾病状态下,比值会发生改变、偏移甚至逆转。有研究提示[19-20],消化道肿瘤患者Th1、Th2之间的平衡向Th2漂移,呈现免疫功能抑制状态,且肿瘤分化程度越低,失衡愈加明显。本研究用免疫荧光法检测LAG3+细胞/CCR3+细胞比值时使用一抗Anti-LAG3、Anti-CCR3,通过得出LAG3阳性细胞/CCR3阳性细胞比例失衡,一定程度上显示胃癌患者中存在着明显的Th1/Th2比例失衡,表明胃癌患者机体抗肿瘤免疫机制受损,这与众多国内外研究类似[21-23]。同时从侧面反映出胃癌患者的免疫紊乱可能与Th1/Th2相关的趋化因子受体的异常表达有关,是胃癌的发病机制之一,那么阻碍其相关受体的作用途径,可以为胃癌的早期诊断提供新的线索,为胃癌的治疗提供新的靶点。探讨LAG3+细胞/CCR3+细胞比值变化与胃癌发生的关系,深度剖析胃癌发生的免疫机制,从而为胃癌的免疫治疗、临床诊断提供新的方向。
[参考文献]
[1] Lee HJ,Cho do Y,Park JC,et al. Phase Ⅱ trial of biweeklypaclitaxel plus infusional 5-fluorouracil and leucovorin in patients with advanced or recurrent inoperable gastric cancer [J]. Cancer Chemother Pharmacol,2009,63(3):427-432.
[2] Chang WJ,Du Y,Zhao X,et al. Inflammation-related factorspredicting prognosis of gastric cancer [J]. World J Gastroenterol,2014,20(16):4586-4596.
[3] 张宏伟,吴昊.外周血T 细胞研究进展[J].北京医学,2006,28(2):108-109.
[4] Annunziato FR,Manetti L,Tomasevic MG,et al. Expression and release of LAG-3-encoded protein by human CD4+ T cells are associated with IFN-gamma production [J]. FASEB J,1996,10(7):767-776.
[5] Sarvaiya PJ,Guo D,Ulasov I,et al. Chemokines in tumor progressionand metastasis [J]. Oncotarget,2013,4(12):2171-2185.
[6] Xu L,Qu YH,Chu XD,et al. Urinary levels of N-nitroso compoundsin relation to risk of gastric cancer:findings from the Shanghai cohort study [J]. PLoS One,2015,10(2):e0117326.
[7] Chang WJ,Du Y,Zhao X,et al. Inflammation-related factors predicting prognosis of gastric cancer [J]. World J Gastroenterol,2014,20(16):4586-4596.
[8] Ho PP,Steinman L. The aryl hydrocarbon receptor:a regulator of Th17 and Treg cell development in disease [J]. Cell Res,2008,18(6):605-608.
[9] Klebanoff CA,GattinoniL,Torabi-Parizi P,et al. Centralmemory self-tumor-reactive CD8+ T cells confer superior antitumor immunity compared with effector memory T cells [J]. PNAS,2005,102(27):9571-9576.
[10] Kim KJ,Lee KS,Cho HJ,et al. Prognostic implications of tumor-infiltrating FoxP3+ regulatory T cells and CD8+ cytotoxic T cells in microsatellite-unstable gastric cancers [J]. Hum Pathol,2014,45(2):285-293.
[11] 童明宏,邵俊,陈燕红.CD3+、CD4+、CD8+T细胞水平在胃癌患者外周血中的变化[J].检验医学,2012,27(6):445-447.
[12] Triebel F,Jitsukawa S,Baixeras E,et al. LAG-3,a novel lymphocyte activation gene closely related to CD4 [J]. J Exp Med,1990,171(5):1393-1405.
[13] Peace JE,Horuk R. Recent progress in the development of antagonists to the chemokine receptors CCR3 and C'R4 [J]. Expert Opin Drug Discov,2014,9(5):467-483.
[14] Sarvaiya PJ,Guo D,Ulasov I,et al. Chemokines in tumor progression and metastasis [J]. Oncotarget,2013,4(12):2171-2185.
[15] Woo SR,Turnis ME,Goldberg MV,et al. Immune inhibitory molecules LAG-3 and PD-1 synergistically regulate T-cell function to promote tumoral immune escape [J]. Cancer Res,2012,72(4):917-927.
[16] 江露,吴昌平,徐斌,等.胃癌患者血清中可溶性LAG-3分子的水平及意义[J].临床检验杂志,2014,32(1):38-40.
[17] Kouo T,Huang L,Pucsek AB,et al. Galectin-3 shapes antitumor immune responses by suppressing CD8+ T cells via LAG-3 and inhibiting expansion of plasmacytoid dendritic cells [J]. Cancer Immunol Res,2015,3(4):412-423.
[18] Nagai H,Miyaki D,Matsui T,et al. Th1/Th2 balance:an important indicator of efficacy for intra-arterial chemotherapy [J]. Cancer Chemother Parmacol,2008,62(6):959-963.
[19] 凌雨田,凌志强,郑智国,等.术前消化道恶性肿瘤患者外周血Th1/Th2细胞外因子漂移分析[J].现代实用医学,2014,26(11):1398-1399.
[20] 彭建柳,吴平.责门癌患者外周血细胞因子检测的临床意义[J].广东教育学院学报,2006,26(3):63-66.
[21] Kang DY,Park CK,Choi JS,et al. Multiple gastrointestinal stromal tumors:clinicopathologic and genetic analysis of 12 patients [J]. Am J Surg Pathol,2007,31(2):224-232.
[22] 乔治,李荣,徐迎新,等.Th1/Th2及Tc1/Tc2在胃癌患者外周血中的漂移及意义[J].世界华人消化杂志,2009, 17(12):1238-1240.
[23] 周卫江.胃癌患者外周血Th1Th2检测及其临床意义[J].全科医学临床与教育,2013,11(3):275-277.
(收稿日期:2015-12-12 本文编辑:张瑜杰)
